-
1、直径为几十纳米的纳米金颗粒具有高电子密度和介电特性,它的一种制备方法是氯金酸与硼氢化钠(化学式为显+3价)反应:。下列有关说法错误的是( )A、纳米金分散在空气中形成的分散系属于胶体 B、硼氢化钠为还原剂 C、氧化产物为和 D、每生成 , 转移电子
-
2、设为阿伏加德罗常数的值。下列说法正确的是( )A、将的盐酸稀释10倍后所得溶液中的数目为 B、常温常压下,中含有的共价键的数目为 C、中含有的共价键数为 D、与足量的铁反应转移的电子数为
-
3、常温下,下列离子组在指定溶液中能大量共存的是( )A、遇酚䣭变红的溶液中: B、加入铝粉产生氢气的溶液中: C、的溶液中: D、的溶液中:、、、
-
4、下列物质属于电解质且为共价化合物的是( )A、 B、 C、 D、
-
5、下列化学用语表示正确的是( )A、CH4分子结构模型:
 B、NH4Cl的电子式:
B、NH4Cl的电子式: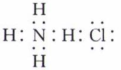 C、H2O2的结构式:H-O-O-H
D、中子数为46的硒原子:
C、H2O2的结构式:H-O-O-H
D、中子数为46的硒原子:
-
6、在化学反应中,若氧化反应和还原反应发生在同一物质的同一元素上,则这种自身的氧化还原反应被称为岐化反应。下列反应属于岐化反应的是( )A、 B、 C、 D、
-
7、科学技术是第一生产力。下列说法正确的是( )A、谷神星一号遥八运载火箭固体燃料燃烧时发生了氧化反应 B、钛合金力学超材料与该合金中的单一金属相比,熔点更高、密度更大 C、嫦娥五号月壤中发现撞击成因的磁铁矿,磁铁矿的主要成分为Fe2O3 D、新一代“人造太阳”原料中的2H与3H互为同素异形体
-
8、某厂的酸性工业废水中含有一定量的等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁局,从废水中回收金,并生产一定量的铁红和氧化铜。

填写下面空白。
(1)、图中标号处需加入的相应物质名称分别是①②③;(2)、任写两个①处发生反应的离子方程式 , 由得到氧化铜的化学方程式为。(3)、从与硝酸反应后的生成物中分离出金单质的操作名称为;铁红的化学式为 , 其在工业上的一种主要用途为。 -
9、我校化学社团的同学们通过查阅资料设计了一种制备氢氧化亚铁沉淀的实验装置,其实验原理是先在封闭体系中利用铁粉和盐酸得到氯化亚铁;亚铁盐溶液再与氢氧化钠溶液作用即可制得氢氧化亚铁。实验装置如图所示。回答下列问题:
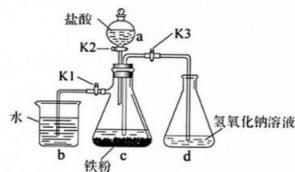 (1)、实验中所用蒸馏水均需经煮沸后迅速冷却,目的是。仪器的名称是。(2)、将过量铁粉置于中,按图连接好装置。打开(填“”“”或“”,下同),关闭。装置的作用是。(3)、经过一段时间,观察到中溶液逐渐变为浅绿色,同时中有气体产生,该气体的作用是。(4)、打开和关闭相应的旋塞,使中浅绿色溶液流入 , 其原因是;中观察到的现象是 , 相关的化学方程式为 , 。
(1)、实验中所用蒸馏水均需经煮沸后迅速冷却,目的是。仪器的名称是。(2)、将过量铁粉置于中,按图连接好装置。打开(填“”“”或“”,下同),关闭。装置的作用是。(3)、经过一段时间,观察到中溶液逐渐变为浅绿色,同时中有气体产生,该气体的作用是。(4)、打开和关闭相应的旋塞,使中浅绿色溶液流入 , 其原因是;中观察到的现象是 , 相关的化学方程式为 , 。 -
10、下图是元素周期表的一部分。
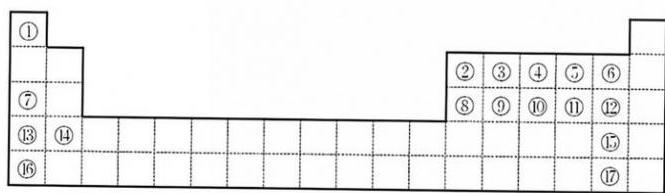
根据要求回答下列问题:
(1)、元素④⑤⑥⑦的简单离子的半径从大到小的顺序是(用离子符号表示)。(2)、元素①②⑦能够形成一种含有极性共价键的离子化合物,该化合物中的阴离子与元素③的简单氢化物分子具有相同的原子数和电子数,写出该阴离子的电子式;一定压强和温度条件下,实验测得元素⑧和组成的化合物的蒸气密度是相同条件下密度的133.5倍,且该化合物中各原子均满足价层8个电子的稳定结构,请写出该物质的结构式。(3)、元素②存在质量数分别为10和11的两种天然稳定同位素,元素②的相对原子质量为10.8,则质量数为10的同位素在自然界中的丰度为;元素也存在两种天然稳定同位素,质量数为35的同位素丰度为 , 质量数为37的同位素丰度为 , 则由这两种同位素构成的、相对分子质量分别为70、72、74的三种分子的个数比为。(4)、元素⑥的简单阴离子的还原性顺序由强到弱为(用离子符号表示),原因是(从结构角度回答) -
11、写出满足下列要求的三个置换反应的化学方程式。
i.所涉及的元素的原子序数不超过20
ii.所涉及的六种单质分属六个不同的主族
①
②
③
-
12、1819年德国矿物学教授E.Mitscherlich发现了化合物中的同晶形规律,这个规律是:相同晶型的化合物具有相同数目的原子且原子以相同的方式结合。例如,和就是互为同晶型的两种化合物。化学家们后来利用这一规律来推测当时某些元素的相对原子质量。现在已知两种非金属元素和的含氧酸钠盐互为同晶型化合物,在的含氧酸钠盐中,钠元素的质量分数为元素的质量分数为 , 其余为氧;在的含氧酸钠盐中,钠元素的质量分数为元素的质量分数为 , 其余为氧。若元素的相对原子质量为 , 则元素的相对原子质量是( )A、 B、 C、 D、
-
13、向镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体。向反应后的溶液中加入的氢氧化钠溶液 , 使金属离子刚好沉淀完全,得到的沉淀质量为。再将所得沉淀灼烧至质量不再改变为止,得到固体。则下列关系正确的是( )
① ② ③
④ ⑤ ⑥
A、①③⑤ B、②④⑥ C、②③④ D、①⑤⑥ -
14、下列选项描述与对应图像相符的是( )
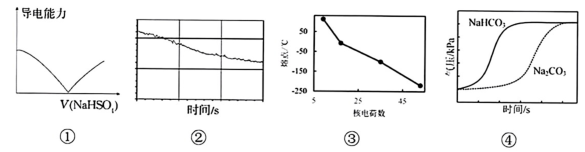 A、图①为向溶液中滴加等浓度的溶液时,溶液导电能力的变化 B、图②为新制饱和氯水在受到阳光直射时,溶液中的变化 C、图③为卤族元素单质的熔点随核电荷数递增的变化 D、图④为向盛有和溶液的密闭容器中滴入等浓度盐酸时气压的变化
A、图①为向溶液中滴加等浓度的溶液时,溶液导电能力的变化 B、图②为新制饱和氯水在受到阳光直射时,溶液中的变化 C、图③为卤族元素单质的熔点随核电荷数递增的变化 D、图④为向盛有和溶液的密闭容器中滴入等浓度盐酸时气压的变化 -
15、下列探究活动得出的结论正确的是( )A、向某无色溶液中滴加溶液,产生白色沉淀:该无色溶液中含有离子 B、向酸性高锰酸钾溶液中滴入溶液,溶液的紫红色褪去:离子具有还原性 C、向某盐的溶液中滴入足量盐酸,无现象,再滴入溶液产生白色沉淀:该盐中含有离子 D、加热铁粉和硫粉的混合物,当反应开始后立即撤去热源,观察到反应能够持续进行:该反应是放热反应
-
16、利用如图所示装置进行下列实验,能得出相应实验结论的是( )
选项 ①
②
③
实验结论
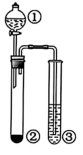
A.
稀硫酸
粉末
澄清石灰水
非金属性:
B.
浓盐酸
固体
KI-淀粉溶液
氧化性:
C.
水
固体
水
与水反应生成气体
D.
浓盐酸
晶体
溶液
浓盐酸有挥发性
A、A B、B C、C D、D -
17、下列化合物的微观结构中,同种原子间不形成共价键的是( )A、 B、 C、 D、
-
18、下列反应的离子方程式书写不正确的是( )A、未密封的绿矾溶液中出现絮状沉淀: B、将少量明矾溶液滴入过量的氨水中: C、溴水使淀粉试纸变蓝: D、与含有等物质的量的溶液反应:
-
19、实验中若皮肤不慎与白磷接触,可用稀溶液冲洗接触部位,其解毒原理包括两个反应:
①(未配平)
②
下列说法正确的是( )
A、反应①和②中都只是还原剂 B、反应②中被氧化的与还原剂的物质的量之比为 C、用溶液冲洗后,应再用饱和溶液和水冲洗接触部位 D、若有的转化为则理论上反应①和②消耗的分子数之比为 -
20、历史上相当长的一段时间内,人们试图合成高溴酸盐都一直未获得成功,直到1968年美国化学家E.H.Appelman利用含有的硒酸盐发生衰变第一次得到了高溴酸盐,该过程可表示为:。下列说法正确的是( )A、上述过程没有生成新物质,因此是一个物理变化 B、已知位于第四周期VIIA族则可推测在同一周期VIA族 C、根据上述过程可知一个的原子核比一个的原子核多一个中子 D、发生衰变产生的电子若全部用来还原 , 可得到