-
1、下列各组中的离子,能在溶液中大量共存的是( )A、、、、 B、、、、 C、、、、 D、、、、
-
2、下列物质中的硫元素不能表现出氧化性的是( )A、 B、 C、 D、
-
3、下列化合物不能通过单质直接化合得到的是( )A、 B、 C、 D、
-
4、下列有关性质的比较,不能用元素周期律解释的是( )A、碱性: B、热稳定性: C、酸性: D、与水反应的难易:
-
5、下列物质中,只含有共价键的是( )A、 B、 C、 D、
-
6、下列物质结构与对应的化学用语表达正确的是( )A、甲烷的结构式: B、氨气的电子式: C、氯化钠的电子式: D、的结构示意图:

-
7、适度饮水有益于健康,但过量你水会使体内电解质浓度过低,导致生理紊乱而引起“水中毒”,下列属于人体内常见电解质的是( )A、二氧化碳 B、氯化钠 C、硫酸钡 D、葡萄糖
-
8、下列材料中所涉及的合金不属于新型合金的是( )A、“深海一号”能源站使用的钢架 B、“蛟龙号”载人舱是用钛合金制造的 C、“飞机涡扇”使用的耐高温合金材料 D、新能源汽车使用的储氢合金
-
9、科学家利用粒子加速器在实验室创造出了超重铝 , 下列有关说法错误的是( )A、质子数为13 B、中子数为29 C、最外层电子数为13 D、原子序数为13
-
10、C、Si、Ge、Sn是同族元素,该族元素的单质及其化合物在材料、医药等方面有重要应用。请回答下列问题:(1)、C、Si、Ge、Sn的第一电离能从大到小的顺序是(用元素符号表示);在基态Ge原子中,电子占据的最高能层的符号为 , 该能层中有种不同运动状态的电子。(2)、有晶体和非晶体两种,可通过方法鉴别二者。(3)、C、Si、Ge、Sn均能与卤素化合,已知常温下为无色液体,遇水有白雾出现,发烟,则属于(填“共价”“分子”或“离子”)晶体;遇水有白雾出现的化学方程式为 .(4)、是一种优秀的透明导电材料,其晶胞结构如图所示。晶胞参数分别为a pm、apm、c pm,晶胞中立方体的边长为a pm,阿伏加德罗常数的值为。

①白球表示的是(填元素符号)。
②晶体的密度为g⋅cm。
-
11、硫酸锌是制造锌钡白和锌盐的主要原料,口服硫酸锌可纠正锌缺乏,恢复酶系统的功能。用锌白矿(主要成分为ZnO,还含有、、等杂质)制备的流程如图:
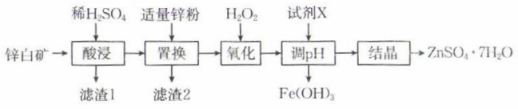
常温下,相关金属离子形成氢氧化物沉淀的pH如表所示(离子浓度小于mol⋅L时视为沉淀完全):
金属离子
开始沉淀的pH
沉淀完全的pH
1.1
3.1
7.6
9.6
6.4
8.0
(1)、基态锌离子的价层电子轨道表示式为。(2)、“酸浸”前通常需要将锌白矿粉碎,其目的是。(3)、滤渣1的主要成分为(填化学式)。(4)、加入“氧化”时发生反应的离子方程式为。(5)、加入试剂X调节溶液的pH在 , 使铁元素转化为沉淀而除去,试剂X可以选用下列中的(填标号)。A.ZnO B. C.
根据题中数据计算常温下的溶度积 .
(6)、pH过大时,锌元素会以形式存在,则中存在的作用力为____(填标号)。A、离子键 B、共价键 C、σ键 D、π键 -
12、某化学兴趣小组用如图装置探究反应的进行程度。
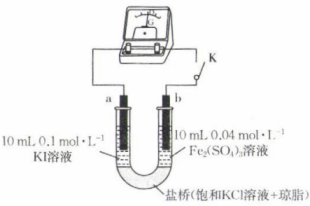
已知:①a、b均为石墨电极;②实验中使用的电流计有电流通过时,指针偏向正极;③空气不影响该实验。
(1)、闭合开关,电流计指针偏向右边,此时电极a为极,电极b的电极反应式为 .(2)、一段时间后,电流计指针回到原点。断开开关,取1 mL a极附近溶液于试管中,加入淀粉溶液,观察到混合溶液颜色变为色;取1 mL b极附近溶液于试管中,滴加几滴溶液,可以观察到。(3)、往U形管右侧溶液中加入0.5 g 粉末,充分溶解后,重新闭合开关,观察到指针偏向左边。闭合开关后,a极的电极反应式为;检验b极附近溶液中是否含有 , 可以选用的试剂是(填化学式)溶液。(4)、结合以上实验现象可知硫酸铁溶液和碘化钾溶液反应的化学方程式为;实验装置盐桥中的电解质溶液不选用饱和溶液的原因可能是 . -
13、某农药由原子序数依次增大的V、W、X、Y、Z五种前四周期元素组成。请根据下列相关信息,回答问题。
元素
相关信息
V
核外电子数与周期序数相等
W
成对电子数与未成对电子数之比为3∶1
X
在火山口附近可发现其淡黄色固体单质
Y
有四个电子层,且最外层电子数与最内层电子数相等
Z
基态Z元素原子的价层电子排布式为
(1)、Y元素在周期表中的位置为第周期第族;基态Z元素原子的最外层电子所占据的原子轨道的电子云轮廓图为形。(2)、V、W、X三种元素的电负性由大到小的顺序是(用元素符号表示);W、X的最简单氢化物的熔、沸点由大到小的顺序是(用化学式表示),原因为。(3)、Y、Z两种元素的最高价氧化物对应的水化物的酸性或碱性最强的是(填化学式)。(4)、W、X可组成空间结构为平面三角形的分子,该分子的化学式为。分子中的大π键可用符号表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为),则该平面三角形分子中的大π键应表示为 . -
14、常温下,向100 mL 0.1 mol·L三元酸溶液中滴加0.1 mol⋅L的NaOH溶液,溶液中含A微粒的物质的量分数(δ)随溶液pH的变化如图所示,下列说法正确的是( )
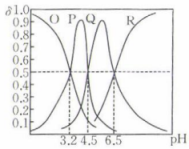 A、P为HA的物质的量分数与溶液pH的关系曲线 B、该三元酸的第一步电离是完全的 C、当加入100 mL NaOH溶液时,溶液显酸性 D、常温下,的水解常数
A、P为HA的物质的量分数与溶液pH的关系曲线 B、该三元酸的第一步电离是完全的 C、当加入100 mL NaOH溶液时,溶液显酸性 D、常温下,的水解常数 -
15、某化合物的晶胞结构示意图如图,晶胞参数为a nm,设为阿伏加德罗常数的值,以晶胞参数建立坐标系,1号原子的坐标为 , 3号原子的坐标为。下列说法错误的是( )
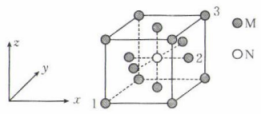 A、晶体中M、N的个数比为4∶1 B、2号原子的坐标为 C、M、N之间的最短距离为nm D、位于面心的M围成正八面体
A、晶体中M、N的个数比为4∶1 B、2号原子的坐标为 C、M、N之间的最短距离为nm D、位于面心的M围成正八面体 -
16、肼()是一种强还原剂,在碱性溶液中能将银、镍等金属离子还原成金属单质,因此可用于镜面镀银,原理为。下列说法正确的是( )A、Ag为d区元素 B、肼分子中心原子的VSEPR模型为四面体形 C、肼分子结构对称,为非极性分子 D、肼与氨气的组成元素相同,性质也完全相同
-
17、超分子因其特殊结构在某些方面有着重要应用。超分子化学已成为今后化学发展的另一个全新的领域。月桂酰丙氨酸形成超分子结构的过程如图。下列说法错误的是( )
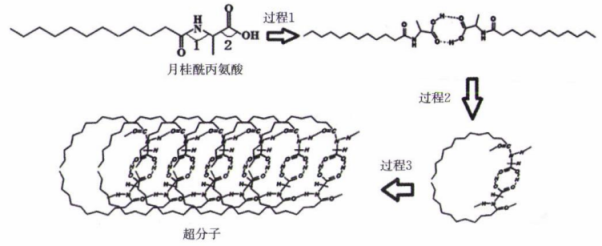 A、该超分子中含有的化学键有极性键、非极性键、氢键 B、月桂酰丙氨酸中键角: C、以上三个过程表现了超分子的自组装特征 D、超分子中形成的空腔能识别某些分子或离子
A、该超分子中含有的化学键有极性键、非极性键、氢键 B、月桂酰丙氨酸中键角: C、以上三个过程表现了超分子的自组装特征 D、超分子中形成的空腔能识别某些分子或离子 -
18、如图所示,A、B、C、D、E、F均为石墨电极,甲池与乙池中溶液的体积均为0.2 L,浓度均为1 mol⋅L , 按图示接通电路,反应一段时间后,检测到电路中通过0.02 mol , 烧杯a中溶液变蓝。下列说法正确的是( )
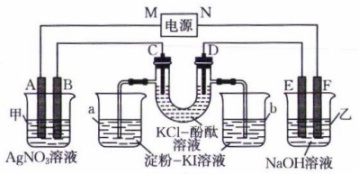 A、M为电源负极 B、C极与E极产生的气体质量差为0.55 g C、烧杯b中溶液颜色变为浅红色 D、忽略体积变化,甲池中溶液的
A、M为电源负极 B、C极与E极产生的气体质量差为0.55 g C、烧杯b中溶液颜色变为浅红色 D、忽略体积变化,甲池中溶液的 -
19、常温下,下列离子组在指定溶液中能大量共存的是( )A、使酚酞变红的溶液中:、、、 B、1 mol⋅L 溶液中:、、、 C、加入石蕊呈红色的溶液中:、、、 D、的溶液中:、、、
-
20、电催化还原的某种催化剂的结构如图,下列说法错误的是( )
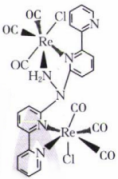 A、Re的配位数为6 B、结构中N的杂化方式均相同 C、Rc提供空轨道 D、CO中C的电负性小,易于提供配位电子对
A、Re的配位数为6 B、结构中N的杂化方式均相同 C、Rc提供空轨道 D、CO中C的电负性小,易于提供配位电子对