-
1、短周期元素X、Y、Z、W、Q原子序数依次增大,X是宇宙中含量最高的元素,Y元素基态原子的2p轨道半充满,W是电负性最大的元素,Q逐级电离能(kJ/mol)依次为578、1817、2745、11575、14830、18376,下列说法正确的是( )A、第一电离能: B、键角: C、Q基态原子核外电子有11种不同的运动状态 D、是非极性分子
-
2、下列反应的离子方程式表示正确的是( )A、向稀溶液中滴加足量氢碘酸: B、向酸性溶液中通入: C、向溶液中加入少量溶液: D、向明矾溶液中滴加溶液,恰好使沉淀:
-
3、下列有关化学反应速率与平衡的说法正确的是( )A、10.0mL2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 B、恒温恒压密闭容器中: , 充入惰性气体,反应速率不变 C、反应达到平衡后,其他条件不变,将反应的体积缩小一半,则达到新平衡时的浓度将变大 D、一定条件下,可逆反应达到平衡后,保持容器温度和容积不变,再通入一定量 , 则再次达到平衡时的百分含量减小
-
4、盐酸与溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热,下列说法正确的是( )A、为防止混合溶液时溅出产生误差,混合时速度要慢 B、玻璃搅拌器材料若用铜代替,则测得的会偏小 C、用相同物质的量的NaOH(s)代替NaOH(aq)进行上述实验,测得的会偏大 D、为了保证盐酸完全被中和,应采用稍过量的NaOH溶液
-
5、为阿伏加德罗常数的值。下列叙述正确的是( )A、室温下1LpH=10的浓氨水中的数目为 B、标准状况下,22.4LHF含有的分子数为 C、10mL12mol/L盐酸与足量加热反应,制得的分子数为 D、0.1mol/L明矾溶液完全水解后生成胶粒数小于
-
6、下列物质结构与性质或物质性质与用途对应关系不正确的是( )A、与均属于非极性分子,可用萃取碘水中的 B、石墨晶体的层状结构间存在分子间作用力,可作为导电电极 C、葡萄糖具有还原性,能发生银镜反应,可用于工业制镜 D、SiC中原子以共价键形成空间网状结构,可作砂轮的磨料
-
7、莫桑钻常作为钻石的替代品,结构与金刚石相似,每个C原子周围都有4个Si原子,每个Si原子周围都有4个C原子。下列关于莫桑钻晶体的说法错误的是( )A、该晶体具有各向异性 B、该晶体中C和Si均为杂化 C、SiC晶体的熔点比金刚石高 D、该晶体中最小的环为六元杂环
-
8、下列过程不能用勒夏特列原理解释的是( )A、在生产可乐时,在加压的条件下通入 B、对、和2HI(g)组成的平衡体系加压后颜色变深 C、用热的溶液清洗带有油污的餐具 D、配制溶液,常将晶体溶于较浓的盐酸中,再稀释至所需浓度
-
9、下列化学用语表示不正确的是( )A、HCl的s-p键电子云图:
 B、氯化钠的分子式:NaCl
C、的VSEPR模型:
B、氯化钠的分子式:NaCl
C、的VSEPR模型: D、氧化钠的电子式:
D、氧化钠的电子式:
-
10、下列仪器名称正确的是( )A、三脚架
 B、圆底烧瓶
B、圆底烧瓶 C、研钵
C、研钵 D、坩埚
D、坩埚
-
11、2023年10月8日第19届亚运会在杭州圆满闭幕,本届亚运会秉持“绿色、智能、节俭、文明”的办会理念。下列说法正确的是( )A、用CO和生产火炬燃料甲醇的反应属于复分解反应 B、吉祥物“江南忆”机器人所采用芯片的主要成分为硅单质 C、亚运会纪念章“琮琮”是由锌合金镀金制成的,锌合金镀金属于合成材料 D、场馆全部使用绿色能源,打造首届“碳中和”亚运会,“碳中和”就是不排放
-
12、某小组以、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X.为测定其组成,进行如下实验.
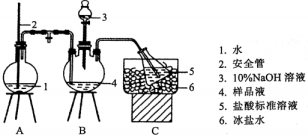
氨的测定装置(已省略加热和夹持装置)
①氨的测定:准确称取 , 加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量溶液,通入水蒸气,将样品液中的氨全部蒸出,用的盐酸标准溶液吸收.蒸氨结束后取下接收瓶,滴加指示剂,用标准溶液滴定过剩的 , 到终点时消耗溶液.
②氯的测定:准确称取 , 配成溶液后移取于锥形瓶中,调 , 滴加指示剂溶液.在不断摇动下,用标准溶液滴定至终点.(为砖红色)
回答下列问题:
(1)、下列说法不正确的是____:A、安全管的作用是:当A中压力过大时,安全管中液面上升,使A瓶中压力稳定 B、氨的测定过程中,滴定终点时仰视读数,氨的测定含量将偏高 C、氨的测定接近终点时的“半滴操作”是:轻轻挤压玻璃珠下方的橡皮管,使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,再用洗瓶以少量蒸馏水吹洗锥形瓶内壁 D、氯的测定过程中,使用棕色滴定管的原因是防止硝酸银见光分解(2)、滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):检漏蒸馏水洗涤开始滴定.
A、烘干
B、装入滴定液至“0”刻度以上处
C、调整滴定液液面至“0”刻度或“0”刻度以下
D、用洗耳球吹出润洗液
E、排除气泡
F、用滴定液润洗2至3次
G、记录起始读数(3)、氯的测定过程中,滴定终点的现象是 . 当溶液中的恰好沉淀完全(浓度等于)时,溶液中为(保留两位有效数字).已知时, .(4)、测定过程中,溶液过低会使浓度降低,不能形成沉淀来指示终点.用相关的离子方程式解释过低使浓度降低的原因 . -
13、盐酸羟胺是一种还原剂和显像剂,其化学性质与类似.(1)、被取代可形成羟胺 , 羟胺水溶液显碱性,用相关离子方程式解释原因 .(2)、已知氮原子上电子云密度越大则碱性越强,实验测得 , 请解释原因: .(3)、采用原电池原理制备盐酸羟胺的装置如下图所示:
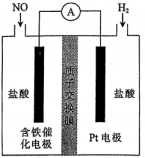
①含铁催化电极发生的电极反应式为 .
②盐酸初始浓度相同,假设两侧溶液体积均为且保持不变,理论上电路中通过电子时,左右两侧浓度相差 .
-
14、合成氨是人类科学技术上的一项重大突破.(1)、已知化学键相关数据如下:
化学健
键能
436
946
391
, 该反应自发进行的条件是 .
(2)、研究表明,合成氨反应在催化剂上可能通过图1机理进行(表示催化剂表面吸附位,表示被吸附于催化剂表面的).判断下述反应机理中,速率控制步骤(即速率最慢步骤)为(填步骤前的标号) , 理由是 .(i) (ii) (iii)
(iv) (v)
图1 反应机理
(3)、为研究温度对合成氨效率的影响,在某温度T下,将一定量和的混合气体置于恒容密闭容器中,在t时刻测得容器中的物质的量.然后分别在不同温度下,保持其它初始实验条件不变,重复上述实验,经过相同时间测得的物质的量.在图2坐标系中,画出随温度变化的曲线示意图. (4)、在不同压强下,以两种不同组成进料,反应达平衡时氨的摩尔分数与温度的计算结果如下图所示.其中一种进料组成为 , 另一种为 . (物质i的摩尔分数:总)
(4)、在不同压强下,以两种不同组成进料,反应达平衡时氨的摩尔分数与温度的计算结果如下图所示.其中一种进料组成为 , 另一种为 . (物质i的摩尔分数:总)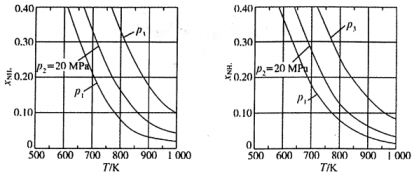
图3 图4
下列说法中不正确的是____:
A、当氨气的体积分数保持不变时可以判断反应已达平衡 B、低温高压有利于提高合成氨的平衡产率 C、压强由大到小的顺序为 D、进料组成中含有惰性气体的是图3(5)、某温度下,进料组成为 , 保持体系压强不变,当反应达到平衡时测得 , 则该温度下反应的 . (表示用平衡分压代替平衡浓度求得的平衡常数,分压总压气体的摩尔分数) -
15、处于同一主族,相关化合物应用广泛.(1)、基态原子的简化电子排布式是 .(2)、下列说法不正确的是____.A、是含有极性键的非极性分子 B、原子由能形成原子发射光谱 C、硼氢化钠中元素电负性大小依次为 D、键的极性:(3)、硼酸为一元弱酸,晶体结构为层状,其二维平面结构如图所示:
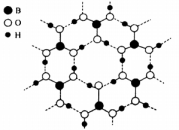
①硼酸晶体中存在氢键.
②硼酸晶体在时溶解度为水,加热至时,溶解度增大至 , 加热时溶解度增大的原因可能是 .
③已知常温下,在水中存在平衡: . 硼砂的化学式为的硼砂溶液中,水解生成等物质的量浓度的和 , 该溶液的 , 中硼原子的杂化轨道类型是 .
-
16、绿矾可作补血剂,其结构如图所示:
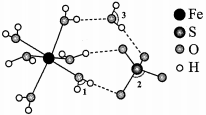
由成键一方单独提供孤电子对给予另外一方,这类“电子对给予—接受”化学键称为配位键.
(1)、按照核外电子排布,可把元素周期表划分成五个区,铁元素位于元素周期表的区.(2)、基态S原子核外电子空间运动状态有种,电子占据最高能级的电子云轮廓图形状为 .(3)、 中由大到小的顺序是 .(4)、二价铁易被氧化为三价铁,结合价层电子排布式解释原因: . -
17、下列方案设计、现象和结论都正确的是( )
实验方案
现象
结论
A
常温下,用计测溶液和溶液的
前者后者
B
将溶液先加热,然后再置于冷水中
加热后溶液颜色变为黄绿色,冷却后变为蓝绿色
的
C
用注射器吸入和的混合气体并密封,然后把注射器的活塞往里推使管内气体容积减小
混合气体的颜色比原来的浅
增大压强使化学平衡右移
D
向溶液中先滴加2滴溶液,再滴加4滴溶液
先产生白色沉淀再产生黄色沉淀
沉淀转化为沉淀表明
A、A B、B C、C D、D -
18、某小组模拟成垢—除垢过程,实验过程如下图所示.已知 . 下列说法正确的是( )A、步骤①中将溶液和溶液等体积混合(忽略体积变化),可以形成沉淀 B、饱和溶液中存在: C、溶液中存在: D、用饱和溶液浸泡固体,生成的反应趋势较大
-
19、室温下,向溶液中逐滴加入溶液,溶液的变化如图所示.下列说法不正确的是( )
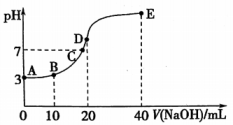 A、的约为 B、B点溶液中: C、点溶液中: D、在的滴定过程中,水的电离程度先增大后减小
A、的约为 B、B点溶液中: C、点溶液中: D、在的滴定过程中,水的电离程度先增大后减小 -
20、在3个容积均为的恒容密闭容器中分别充入和 , 在不同条件下发生反应: . 各容器内气体总压强随时间变化如图所示(反应前后容器的温度保持不变).下列说法不正确的是( )
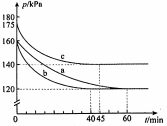 A、与实验a相比,b改变的条件是加入催化剂 B、与实验a相比,c改变的条件是升温 C、实验a中的平衡转化率为 D、
A、与实验a相比,b改变的条件是加入催化剂 B、与实验a相比,c改变的条件是升温 C、实验a中的平衡转化率为 D、