-
1、负载有Pt和Ag的活性炭,可选择性去除实现废酸的纯化,其工作原理如图。下列说法正确的是( )
 A、Ag作原电池正极 B、电子由Ag经活性炭流向Pt C、Pt表面发生的电极反应: D、每消耗标准状况下11.2 L的 , 最多去除1 mol Cl-
A、Ag作原电池正极 B、电子由Ag经活性炭流向Pt C、Pt表面发生的电极反应: D、每消耗标准状况下11.2 L的 , 最多去除1 mol Cl- -
2、0.1 mol/L 溶液的pH随温度的变化如图所示,下列说法正确的是( )
 A、温度高于60℃时,pH变化主要受水的电离平衡移动的影响 B、常温下: C、常温下: D、升高温度,平衡逆向移动
A、温度高于60℃时,pH变化主要受水的电离平衡移动的影响 B、常温下: C、常温下: D、升高温度,平衡逆向移动 -
3、自然界中时刻存在着氮的转化,下图为分子在催化剂作用下发生一系列转化示意图。

下列叙述正确的是( )
A、 , 均属于氮的固定 B、使用催化剂a、b均可以提高单位时间内生成物的产量 C、催化剂a、b表面均发生了极性共价键的断裂 D、在催化剂a作用下,氮原子发生了氧化反应 -
4、室温下,下列各组离子在指定溶液中一定不能大量共存的是( )A、与铝粉反应放出的透明溶液:、 , 、 B、常温下,由水电离的的溶液:、、 , C、使石蕊试液显红色的溶液:、、、 D、含有大量的溶液: , 、、、
-
5、下列说法正确的是( )A、石墨中的碳原子呈杂化,是混合型晶体 B、4.6 g乙醇分子中含有共价键数为(为阿伏加德罗常数) C、和结构相似,但硫化氢晶体中,一个周围有12个紧邻的分子,而冰中一个周围只有4个紧邻的分子 D、臭氧分子是非极性分子
-
6、用如图所示装置进行下列实验(尾气处理装置已省略),装置正确并能达到实验目的的是( )

选项
①中试剂
②中溶液
实验目的
A
浓硫酸、无水乙醇(沸石)
酸性高锰酸钾溶液
检验有乙烯气体生成
B
乙醇、乙酸、浓硫酸
氢氧化钠溶液
制取乙酸乙酯
C
Cu、浓硫酸
溴水
验证的还原性
D
澄清石灰水
验证的热稳定性
A、A B、B C、C D、D -
7、下列反应的离子方程式正确的是( )A、向氢氧化亚铁中加入足量的稀硝酸: B、泡沫灭火器原理: C、浓氨水中滴加少量硫酸铜溶液: D、澄清石灰水与过量反应:
-
8、下列有关有机物的说法中不正确的是( )A、属于取代反应 B、分子式为的有机物属于卤代烃 C、苯的二氯取代物有三种结构 D、分子组成上相差一个或若干个原子团的有机物之间一定互为同系物
-
9、根据元素周期表和元素周期律,判断下列叙述正确的是( )A、氢卤酸的酸性由强到弱的顺序: B、同周期第ⅡA族和第ⅢA族元素原子序数可能相差1、11、25 C、铁元素位于元素周期表中第四周期第ⅧA族 D、主族元素都有最高正价,且都等于该元素原子的最外层电子数
-
10、下列化学用语表示不正确的是( )A、烧碱的化学式: B、中Fe元素的化合价:+6 C、的结构示意图:
 D、氯化钾的电离方程式:
D、氯化钾的电离方程式:
-
11、化学创造美好生活,下列生产活动与对应化学原理没有关联或关联性不正确的是( )
选项
生产活动
化学原理
A
社区服务:用84消毒液清洗公共桌椅
84消毒液中的有强氧化性
B
实践活动:点燃天然气做饭
天然气的燃烧为放热反应
C
自主探究:将铁丝分别放在有水和无水环境中观察较长时间
钢铁在有水存在的条件下更容易生锈
D
家务劳动:白醋除去水壶中的水垢
白醋可以溶解碳酸钙等难溶物
A、A B、B C、C D、D -
12、从深邃的海底到浩瀚的太空,中国科学家探索的脚步从未停止。下列成果所涉及的材料为金属材料的是( )A、“神舟十五号”飞船使用的耐辐照光学窗材料——石英玻璃 B、“长征五号”运载火箭使用的燃料——液氢 C、“福建号”航母使用的高强度甲板材料——合金钢 D、“C919”大飞机使用的机身复合材料——碳纤维和环氧树脂
-
13、某消炎药的中间体有机物F的合成路线如下:
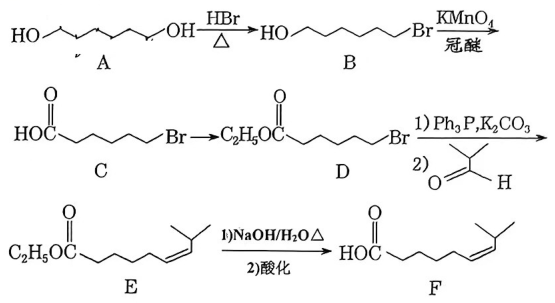
按要求回答下列问题:
(1)、A的分子式为;其中氧原子的杂化方式为。(2)、B的官能团名称为。B在乙醇溶液加热条件下反应的有机产物的结构简式为;欲检验B中含有的溴原子,可在上述反应后的溶液中依次加入的试剂为。
(3)、C→D的反应类型为。(4)、E→F第1步反应的化学方程式为。(5)、G是C的同分异构体,满足下述条件的G有种(不考虑立体异构);①可发生银镜反应
②碳骨架没有支链
③能与溶液反应
写出其中核磁共振氢谱有吸收峰面积比为的结构简式:。
-
14、燃煤废气中主要物质的转化与利用有着重要价值。按要求回答下列问题。(1)、分子的空间结构为;沸点:(填“>”“<”或“=”)。(2)、常温下能与硫的氧化物A反应可生成S,据此推测A具有的化学性质是。(3)、25℃时溶液中、、在含硫粒子总浓度中所占分数随溶液pH的变化如图所示:
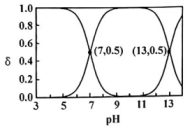
①写出的电离方程式:、。
②的 , 。
(4)、热解制的反应分如下两步:ⅰ.
ⅱ.
①反应ⅰ能自发进行的反应条件是。
②写出热解总反应的热化学方程式:。
③假设在某温度下反应ⅰ达到平衡,测得密闭系统中各组分浓度分别为、、。
该温度下平衡常数;达平衡后,其他条件不变,把容器的容积减小到原来的时,结合数据用Q与K的大小关系解释平衡移动方向及其理由。
(5)、生物转化与利用①先将通入溶液中,产生淡黄色沉淀和浅绿色溶液(已知是黑色难溶物)。写出该反应的离子方程式:。
②再在硫杆菌存在下通入:
在硫杆菌存在下被氧化的速率是无菌时的倍。
ⅰ.硫杆菌的作用是;
ⅱ.由下图1和图2判断使用硫杆菌的最佳条件为;

图1 图2
ⅲ.若反应温度过高,反应速率下降,其原因是。
-
15、氯单质及其化合物在生产生活中有着重要价值。按要求回答下列问题。(1)、基态Cl原子的价电子轨道表示式为;比较原子半径:ClS(填“<”“>”)。(2)、氯碱工业是高耗能产业,若将电解池与燃料电池组合可节能超过30%,此项新工艺设计相关物料的传输与转化关系如下图所示(电极未标出)。
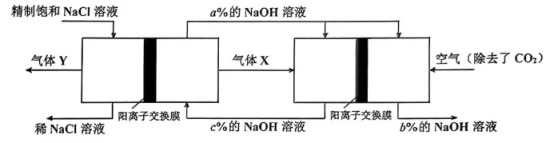
M(电解池) N(燃料电池)
①气体X在N池中反应的电极方程式为。
②图中气体Y的化学式为;M池所用的离子交换膜允许通过的主要离子有。
③图中三处溶液的质量分数由大到小的顺序为。
④写出一项此流程设计的优点:。
(3)、氧化法制是在的催化作用下,氧化。写出该反应的化学方程式:。
(4)、向饱和氯水中加入适量可制溶液。用离子方程式及化学平衡移动原理解释上述变化:。
-
16、碱金属单质及其化合物在生产生活中有着重要价值。按要求回答下列问题。(1)、已知:原子序数小于争(Rb)的碱金属元素X、Y、Z的第一电离能依次为520、496、419(单位:)。
①基态X原子的核外电子排布式为。
②写出一项比较Rb与Z的金属性强弱的方法:。
(2)、钴酸锂常用作锂离子电池的电极材料,它是一种立方晶胞如下图所示(仅表示出Li,未表示出Co和O):
①晶胞中含有的个数为。
②该晶胞密度为(设阿伏加德罗常数的值为 , 用含a的代数式表示)。
(3)、回收废旧电池得到粗品 , 再经如下两步制备成纯晶:ⅰ.将粗品溶于盐酸,作电解槽的阳极液;溶液做阴极液,两者用离子交换膜隔开,用惰性电极电解:
ⅱ.向溶液中加入少量溶液并共热,过滤、洗涤、干燥得纯品。
①写出步骤ⅰ阳极的电极反应式:;离子交换膜宜选用(填“阳离子交换膜”或“阴离子交换膜”)。
②步骤ⅱ加热条件下生成沉淀的离子方程式是。
-
17、向一恒容密闭容器中加入和一定量的 , 发生反应:。的平衡转化率随温度、不同投料比的变化曲线如下图所示。下列说法正确的是( )。
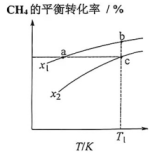 A、投料比: B、该反应为放热反应 C、正反应速率: D、点a、b、c对应的平衡常数:
A、投料比: B、该反应为放热反应 C、正反应速率: D、点a、b、c对应的平衡常数: -
18、某化学小组查阅资料: , 为棕色;易溶于水,形成无色溶液。进行如下实验并观察现象向蒸馏水中加入 , 充分振荡,溶液呈浅棕色。
再加入粒,溶液颜色加深。
振荡,一段时间后,紫黑色晶体消失,且溶液褪色。
下列实验现象对应的解释正确的是( )。
选项
实验步骤及其现象
解释
A
溶液呈浅棕色
和水均为极性分子,二者相似相溶
B
溶液颜色加深
因Zn与反应生成导致
C
紫黑色晶体消失
Zn参与反应,促使体系中平衡向右移动
D
溶液褪色
因全部转化为导致
A、A B、B C、C D、D -
19、向盛有饱和溶液(下层有足量沉淀)的试管中滴加氨水,依次发生
反应①:
反应②:
如图为与的关系图,其中M代表、、或。下列说法正确的是( )。
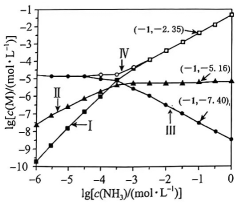 A、的溶度积常数 B、反应①的平衡常数K的值为 C、曲线Ⅰ可视为随变化的曲线 D、时,溶液中
A、的溶度积常数 B、反应①的平衡常数K的值为 C、曲线Ⅰ可视为随变化的曲线 D、时,溶液中 -
20、25℃下,溶液的pH随其浓度的变化关系如图所示。下列说法不正确的是( )。
 A、溶液中 B、在水中的 C、的水解程度随其浓度增大而减小 D、时,溶液中
A、溶液中 B、在水中的 C、的水解程度随其浓度增大而减小 D、时,溶液中