-
1、乐舞杂技彩绘陶俑被称为济南市博物馆镇馆之宝。根据组成元素,下列彩绘颜料主要成分的物质类别与其它三项不同的是( )A、赭石的主要成分Fe2O3 B、白垩的主要成分CaCO3 C、石膏的主要成分CaSO4 D、铜绿的主要成分
-
2、氯是重要的非金属元素,某校化学兴趣小组进行了下列实验。回答下列问题:
实验Ⅰ:利用如图所示装置制取并收集干燥的氯气。
 (1)、仪器a的名称是。装置B、C中的试剂依次是、。(2)、装置E的作用为;写出该反应的化学方程式:。(3)、实验Ⅱ:利用实验Ⅰ制得的氯气按下图所示装置进行氯气的性质探究。
(1)、仪器a的名称是。装置B、C中的试剂依次是、。(2)、装置E的作用为;写出该反应的化学方程式:。(3)、实验Ⅱ:利用实验Ⅰ制得的氯气按下图所示装置进行氯气的性质探究。
已知:G中为干燥的有色布条、H中为紫色石蕊试液、I中为淀粉碘化钾溶液(淀粉遇碘单质变蓝)。
G中干燥的有色布条不褪色,说明。
(4)、H中的现象为。(5)、I中反应的离子方程式为。 -
3、下表列出了A~R9种元素在周期表中的位置:
周期
族
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
2
E
F
3
A
C
D
G
R
4
B
H
回答下列问题:
(1)、D元素的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是。(2)、A、B、C三种元素按原子半径由大到小的顺序排列为(用元素符号表示)。(3)、F元素最简单氢化物的化学式是 , 该氢化物在常温下与B发生反应的化学方程式是 , 所得溶液的pH7。(4)、H元素与A元素形成化合物的化学式是 , 用电子式表示该化合物的形成过程:。 -
4、已知物质A~H之间存在如图所示转化关系:

回答下列问题:
(1)、D溶液为(填化学式)溶液。(2)、检验G溶液中是否含有B溶液中金属阳离子可以用酸性高锰酸钾溶液,写出溶液B中金属阳离子与酸性高锰酸钾溶液反应的离子方程式:(已知:酸性条件下高锰酸钾被还原为)。(3)、G溶液能否用铜制容器盛放,理由是。(4)、白色沉淀E变为红褐色沉淀F时反应的化学方程式为。(5)、下列物质不可以通过化合反应制得的是(填字母)。a.物质B b.物质C c.物质F d.物质G
(6)、制备溶液B时一般会加入稍过量的A,其目的是。 -
5、研究物质时会涉及物质的组成、分类、性质和用途等方面。回答下列问题:(1)、属于(填物质的类别),其中阳离子的结构示意图为 , 检验其组成中所含阳离子的方法是。(2)、将包有少量色固体的棉花放入坩埚,用滴管向棉花上滴几滴水,棉花立刻燃烧起来。由该实验你能得出的结论是。(3)、在潜水艇和消防员的呼吸面具中,所发生反应的化学方程式为 , 从氧化剂和还原剂的角度分析,在这个反应中的作用是。
-
6、从酸性含铬废水(主要阴离子为)中回收铬元素()的部分工艺流程如图所示。

下列有关说法正确的是( )
A、“过滤”时需用玻璃棒搅拌 B、“煅烧”过程中发生了氧化还原反应 C、若分别用、还原等量的 , 消耗与的物质的量之比为1:3 D、“还原1”时反应的离子方程式为 -
7、W、X、Y、Z是原子序数依次增大的短周期主族元素,W与X、Y、Z不同周期,W为地壳中含量最多的元素,Y与W同主族,X的原子最外层只有1个电子。下列说法不正确的是( )A、反应条件不同,W、X形成的常见单质反应生成物不同 B、W与X形成的化合物中阴阳离子个数比为1:1 C、Y与W形成的化合物属于酸性氧化物 D、Z形成的单质可用于自来水消毒
-
8、下列四组实验中,操作正确且能达到预期目的的是( )A、配制稀硫酸
 B、加热固体
B、加热固体 C、制备纯净的
C、制备纯净的 D、收集氢气
D、收集氢气
-
9、在探究新制氯水成分及其性质的实验中,根据下列实验操作和现象,得出的结论正确的是( )
选项
实验操作
现象
结论
A
观察新制氯水颜色
新制氯水呈浅黄绿色
新制氯水中含
B
向饱和溶液中加入新制氯水
有无色气体产生
新制氯水中含有HClO
C
在红色纸条上滴加新制氯水
红色纸条褪色
新制氯水具有漂白性
D
向浅绿色溶液中滴加新制氯水
溶液变成棕黄色
新制氯水具有还原性
A、A B、B C、C D、D -
10、用表示阿伏加德罗常数的值,下列叙述正确的是( )A、16g由与组成的混合气体中含有的原子数为 B、发生反应,转移电子数一定为 C、标准状况下,含有分子数为 D、的NaCl溶液中含数为
-
11、如右图所示,在A处通入未经干燥的氯气。当关闭B处的弹簧夹时,C处的红布条看不到明显现象;当打开B处的弹簧夹后,C处的红布条逐渐褪色。则D瓶中盛放的溶液可能是( )
①饱和NaCl溶液 ②NaOH溶液 ③ ④浓硫酸
 A、①② B、①③ C、②④ D、③④
A、①② B、①③ C、②④ D、③④ -
12、将绿矾()溶于水配制成溶液喷施在叶面上,可解决植物叶面变黄问题,因此绿矾又被誉为“铁肥”。下列有关“铁肥”说法错误的是( )A、“铁肥”易被空气氧化变质 B、可用溶液检验“铁肥”是否发生变质 C、为保证“铁肥”的效果,可向配制后的溶液中加入少量铁粉 D、的摩尔质量为
-
13、下列关于物质性质的比较,不正确的是( )A、热稳定性强弱:HI>HBr>HCl B、离子半径大小: C、碱性强弱:KOH>NaOH>LiOH D、金属性强弱:Na>Mg>Al
-
14、下列离子方程式中,正确的是( )A、将稀硫酸滴在铁片上: B、将碳酸氢钠溶液与稀盐酸混合: C、将硫酸铜溶液与氢氧化钠溶液混合: D、将硝酸银溶液与氯化钠溶液混合:
-
15、下列各组中的离子,能在溶液中大量共存的是( )A、、、、 B、、、、 C、、、、 D、、、、
-
16、根据物质的组成和性质,以及物质之间的转化关系,我们可以确定制取某类物质的可能方法。下列物质间的转化通过一步反应不能实现的是( )A、 B、 C、 D、
-
17、化学与生产、生活息息相关。下列叙述不正确的是( )A、绚丽多彩的烟花是源于金属元素的焰色 B、早上透过云层看到的“金光万缕”是因为丁达尔效应 C、《神农本草经》中提到:“白青得铁化为铜”。其中白青属于碱 D、工业上一般采用电解饱和食盐水的方法制取NaOH,主要考虑原料便宜易得
-
18、某小组同学将过量的AgNO3 溶液滴加到饱和氯水中,发现氯水的漂白性出现异常,于是对相关的反应进行了探究。(1)、I.发现问题
①氯气与水反应的化学方程式为。小组同学猜测加入AgNO3溶液后,生成沉淀,使c(Cl-)降低,c(HClO)增大,氯水漂白性增强,于是进行如下实验。
②与过量AgNO3溶液反应后,氯水漂白性减弱的实验证据是。
Ⅱ.查阅资料:AgClO为白色晶体,常温下难溶于水
提出猜想:反应中除生成AgCl外,还有AgClO生成
III.实验探究

已知:AgI + I- AgI2-
编号
实验操作
实验现象
i
向a1试管中加入2 mL浓盐酸,并用湿润的淀粉KI试纸靠近试管口
产生刺激气味的气体,试纸变蓝
ii
向a2试管中加入2 mL饱和KI溶液,振荡,再滴入2滴淀粉溶液
加入饱和KI溶液,白色沉淀变为黄色,振荡后沉淀溶解,滴加淀粉溶液,溶液变蓝。
iii
向另一支试管a3中只加入2 mL饱和KI溶液,振荡,再滴入2滴淀粉溶液,与实验ii放置相同时间
滴入淀粉溶液,无明显变化
(2)、操作a的名称是。(3)、实验i中产生刺激气味的气体,可能的反应方程式是。(4)、实验ii表明,固体b中含有AgClO,且AgClO的溶解度大于AgI,请结合实验现象进行解释。(5)、实验iii的作用是。(6)、综上,过量的AgNO3 溶液滴加到饱和氯水后,氯水漂白性减弱的可能原因是。 -
19、五水合硫代硫酸钠(Na2S2O3 • 5H2O)俗称“海波”,常用作棉织物漂白后的脱氧剂、定量分析中的还原剂。
资料:① Na2S2O3 • 5H2O无色、易溶于水,难溶于乙醇;
② Na2S2O3在酸性溶液中反应有S和SO2产生
(一)制备
工业上可用SO2、Na2S和 Na2CO3制备Na2S2O3 • 5H2O,其工艺流程示意图如下:
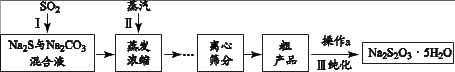 (1)、实验室可用浓硫酸与Cu反应制备SO2气体,该反应的化学方程式是。(2)、 ① 配平I中反应的化学方程式: Na2S + SO2 + Na2CO3 = Na2S2O3 + CO2
(1)、实验室可用浓硫酸与Cu反应制备SO2气体,该反应的化学方程式是。(2)、 ① 配平I中反应的化学方程式: Na2S + SO2 + Na2CO3 = Na2S2O3 + CO2② 当I中溶液的pH约为7时应停止通入SO2 , 否则Na2S2O3的产率下降,结合离子方程式说明其原因。
(3)、II.粗产品提纯已知粗产品中可能会含有少量Na2SO3和Na2SO4 , Na2S2O3在水中的溶解度随温度的升高而显著增大。
① 检验粗产品中含有Na2SO4的方法是:取少量固体溶解, 先加足量的溶液,静置、过滤, , 有白色沉淀生成。
② 粗产品的提纯过程III中,操作a的步骤为:加热溶解、趁热过滤、、过滤、(填洗涤试剂名称)洗涤、干燥。
(4)、III.纯度测定准确称取a g产品于锥形瓶中,加入一定量蒸馏水完全溶解后,加入适量甲醛溶液预处理(防止Na2SO3与I2反应),以淀粉作指示剂,用c mol/L I2的标准溶液滴定,发生如下反应:I2 + 2S2O32- = 2I-+ , 三次平行实验,平均消耗v mL I2溶液。
(已知:Na2S2O3 • 5H2O的摩尔质量为248 g/mol )
① 产品中Na2S2O3•5H2O的纯度为 (写出质量分数的表达式即可)。
② 下列操作可能造成实验结果偏高的是。
A.滴定管未用I2标准溶液润洗
B.滴定终点时仰视读数
C.滴定过程中锥形瓶内有少量液体溅出瓶外
-
20、化合物G是用于治疗慢性便秘药品普卡必利的中间体,其合成路线如下:

已知:

回答下列问题。
(1)、有机物A中的官能团为羟基、羧基和。(2)、反应A→B的化学方程式为。(3)、M + C→D为可逆反应,推测K2CO3的作用:。(4)、E的结构简式为。(5)、写出符合下列条件的B的一种同分异构体的结构简式。① 属于α-氨基酸(氨基连接在与羧基相连的碳原子上)
② 遇FeCl3溶液显紫色
(6)、请根据流程中的信息,设计以苯酚和CH2 = CH-CH2Br为原料合成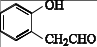 的合成路线。
的合成路线。