-
1、将V1mL 1.0mol/L HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是( )
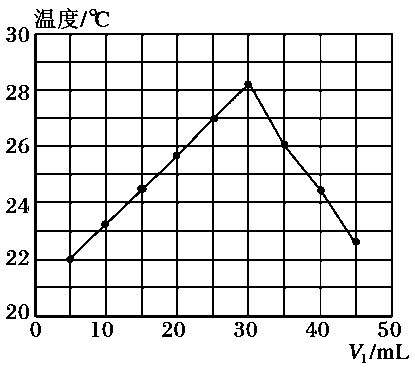 A、做该实验时环境温度为22℃ B、该实验表明有水生成的反应都是放热反应 C、NaOH溶液的浓度约为1.0mol/L D、该实验表明化学能可能转化为热能
A、做该实验时环境温度为22℃ B、该实验表明有水生成的反应都是放热反应 C、NaOH溶液的浓度约为1.0mol/L D、该实验表明化学能可能转化为热能 -
2、在不同温度下的水溶液中离子浓度曲线如图所示,下列说法不正确的是 ( )
 A、向b点对应的醋酸溶液中滴加NaOH溶液至a点,此时c(Na+)=c(CH3COO-) B、25 ℃时,加入CH3COONa可能引起由b向a的变化,升温可能引起由a向c的变化 C、T℃时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液呈中性 D、b点对应的溶液中大量存在:K+、Ba2+、NO3-、I-
A、向b点对应的醋酸溶液中滴加NaOH溶液至a点,此时c(Na+)=c(CH3COO-) B、25 ℃时,加入CH3COONa可能引起由b向a的变化,升温可能引起由a向c的变化 C、T℃时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液呈中性 D、b点对应的溶液中大量存在:K+、Ba2+、NO3-、I- -
3、常温下1mol化学键分解成气态原子所需要的能量用E表示,结合表中信息下列说法不正确的是( )
共价键
H-H
F-F
H-F
H-Cl
H-I
E(kJ/mol)
436
157
568
432
298
A、表中最稳定的共价键是H-F B、1mol H2(g)与1 mol F2(g)生成2 mol HF(g)放出25 kJ的能量 C、432kJ/mol> E(H-Br)> 298kJ/mol D、1mol H2(g)分解成2 mol H(g)需放出436 kJ的能量 -
4、下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是 ( )
选项
A
B
C
D
强电解质
HNO3
NaCl
BaSO4
盐酸
弱电解质
CH3COOH
NH3
H3PO4
Fe(OH)3
非电解质
C6H12O6(葡萄糖)
CO2
C2H5OH
H2O
A、A B、B C、C D、D -
5、下列反应中,反应速率最大的是( )A、25 ℃时,镁条与0.1 mol·L-1盐酸反应 B、25 ℃时,镁条与0.2 mol·L-1盐酸反应 C、35 ℃时,镁条与0.2 mol·L-1盐酸反应 D、35 ℃时,镁条与0.3 mol·L-1盐酸反应
-
6、一定温度下,将2 mol A和2 mol B两种气体混合放入体积为2 L的密闭刚性容器中,发生反应3A(g)+B(g) = xC(g)+2D(g),2 min 末反应达到平衡,生成0.8 mol D,并测得C的物质的量浓度为0.4 mol/L,下列说法正确的是 ( )A、此温度下该反应的平衡常数K等于0.5 B、A的平衡转化率为40% C、x的值为1 D、A和B的平衡转化率相等
-
7、如图所示是298K时,A2与B2反应过程中能量变化的曲线图,下列叙述正确的是 ( )
 A、每生成2 molAB吸收b kJ热量 B、加入催化剂,反应的活化能和反应热都改变 C、该反应的热化学方程式为A2(g)+B2(g)=2AB(g) △H= + (a-b) kJ/mol D、断裂1 mol A-A和1 mol B-B键,放出a kJ能量
A、每生成2 molAB吸收b kJ热量 B、加入催化剂,反应的活化能和反应热都改变 C、该反应的热化学方程式为A2(g)+B2(g)=2AB(g) △H= + (a-b) kJ/mol D、断裂1 mol A-A和1 mol B-B键,放出a kJ能量 -
8、反应2NO2(g)N2O4(g) △H=-57 kJ/mor, 在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 ( )
 A、T1>T2 B、X、Y两点的反应速率:X>Y C、X、Z两点气体的颜色:X深,Z浅 D、X、Z两点气体的平均相对分子质量:X>Z
A、T1>T2 B、X、Y两点的反应速率:X>Y C、X、Z两点气体的颜色:X深,Z浅 D、X、Z两点气体的平均相对分子质量:X>Z -
9、如图是向100 mL pH=1的盐酸中逐渐加入NaOH溶液时,溶液pH的变化图像,根据如图所得结论正确的是( )
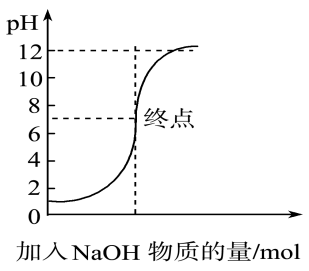 A、原来盐酸的物质的量浓度为0.1 mol·L-1 B、NaOH溶液的物质的量浓度为0.1 mol·L-1 C、原来盐酸的物质的量浓度为1 mol·L-1 D、NaOH溶液的物质的量浓度为0.01 mol·L-1
A、原来盐酸的物质的量浓度为0.1 mol·L-1 B、NaOH溶液的物质的量浓度为0.1 mol·L-1 C、原来盐酸的物质的量浓度为1 mol·L-1 D、NaOH溶液的物质的量浓度为0.01 mol·L-1 -
10、下列有关化学平衡常数的描述中正确的是 ( )A、化学平衡常数的大小取决于化学反应本身,与其他外界条件无关 B、相同温度下,反应与反应的化学平衡常数相同 C、反应的化学平衡常数随温度升高而增大 D、反应的平衡常数达式为
-
11、反应4A(s)+3B(g)2C(g)+D(g),经2 min 后B的浓度减少0.6 mol·L-1。下列说法正确的是 ( )A、用A表示的反应速率是0.4 mol·L-1·min-1 B、在2 min末的反应速率,用B表示是0.3 mol·L-1·min-1 C、分别用B、C、D表示的反应速率,其比值是3∶2∶1 D、在这2 min内B和C两物质浓度是逐渐减小的
-
12、在一密闭容器中发生反应:2A(g)+2B(g)C(s)+3D(g)ΔH<0,达到平衡时采取下列措施,可以使正反应速率v正增大、D的物质的量浓度c(D)增大的是 ( )A、移走少量C B、选择良好的催化剂 C、缩小容积,增大压强 D、容积不变,充入1molN2(N2不参加反应)
-
13、在反应2HIH2+I2中,有关反应条件改变使反应速率增大的原因分析中,不正确的是 ( )A、加入适宜的催化剂,可降低反应的活化能 B、增大 , 单位体积内活化分子数增大 C、升高温度,单位时间内有效碰撞次数增加 D、增大压强,活化分子的百分数增大
-
14、下列离子方程式表示的是盐类的水解且正确的是 ( )A、 B、 C、 D、
-
15、下列热化学方程式中,正确的是( )A、甲烷的燃烧热 , 则甲烷燃烧热的热化学方程式可表示为: B、在时,完全燃烧生成液态水,放出热量,燃烧的热化学方程式表示为 C、HCl和NaOH反应的中和热 , 则和反应的中和热 D、、下,已知热化学方程式: , 将和置于密闭容器中充分反应生成 , 放热
-
16、某天然氨基酸M是人体必需的氨基酸之一,其合成路线如下:

已知:①


②

 (1)、A→B的反应条件和试剂是;化合物F的名称为;(2)、I→J的反应类型是;(3)、写出D→E反应的化学方程式;(4)、I与乙二醇反应可生成能降解的高分子化合物N,写出该反应的化学方程式;(5)、符合下列条件的化合物M的同分异构体共有种(不考虑立体异构);
(1)、A→B的反应条件和试剂是;化合物F的名称为;(2)、I→J的反应类型是;(3)、写出D→E反应的化学方程式;(4)、I与乙二醇反应可生成能降解的高分子化合物N,写出该反应的化学方程式;(5)、符合下列条件的化合物M的同分异构体共有种(不考虑立体异构);①含有苯甲酸结构 ②含有一个甲基 ③苯环上只有两个取代基
其中核磁共振氢谱峰面积比为1:1:2:2:2:3的分子的结构简式(任写一种);
(6)、请结合以上合成路线,写出以丙酸和上述流程中出现的物质为原料经三步合成丙氨酸( )的路线。
)的路线。 -
17、A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子的2p能级有3个电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2。回答下列问题:(1)、写出基态E+的价电子排布式:。基态A原子的第一电离能比B的大,其原因是。(2)、A5+由美国空军研究实验室推进科学与先进概念部Karl .O.Christed 于1999年成功合成,其结构呈‘V'形且该离子中各原子均达到8电子稳定结构,则A5+的结构式为。(3)、B3分子的空间构型为 , 其中B原子的杂化类型是 , 与B3分子互为等电子体的微粒有(写一种离子)。(4)、向E的硫酸盐溶液中通入A的气态氢化物至过量,产生蓝色沉淀,随后沉淀溶解得到深蓝色溶液,向溶液中加入适量乙醇,析出蓝色晶体。加入乙醇的目的。 写出该配合物中配离子的结构简式。(5)、由长周期元素组成的镧镍合金、铜钙合金有相同类型的晶体结构XYn , 它们有很强的储氢能力,其中铜钙合金的晶体的部分结构如图所示。

已知镧镍合金(LaNin)晶体中的重复结构单元如图一所示,该结构单元的体积为9.0×10-23cm3 , 储氢后形成LaNinH4.5的合金(氢进入晶体空隙,体积不变),则LaNin中n=(填数值);氢在合金中的密度为g/L。
-
18、二氧化碳的综合利用是实现碳达峰、碳中和的关键。
I.利用和合成甲醇,涉及的主要反应如下:
已知:a.
b.
c.
(1)、计算。(2)、一定条件下,向密闭容器中充入物质的量之比为1:3的和发生上述反应,使用不同催化剂经相同反应时间,的转化率和甲醇的选择性随温度的变化如图所示:
甲醇的选择性
①210-270℃间,在甲醇的选择性上,催化效果较好的是。
②210-270℃间,催化剂2条件下的转化率随温度的升高而增大,可能原因为。
(3)、II.工业上用和通过如下反应合成尿素:。t℃时,向容积恒定为的密闭容器中充入和发生反应。下列能说明反应达到化学平衡状态的是(填字母)。
a.相同时间内,键断裂,同时有键形成
b.容器内气体总压强不再变化
c.
d.容器内气体的密度不再改变
(4)、的物质的量随时间的变化如下表所示:时间/min
0
30
70
80
100
1.6
l.0
0.8
0.8
0.8
的平衡转化率为;t℃时,该反应的平衡常数K=。
-
19、实现变废为宝和资源的回收利用是实现“碳中和”的重要途径。一种利用碲化亚铜废渣制备二氧化碲和单质银的工业流程如图所示:

已知:①碲化亚铜废渣的主要成分为 , 还含有少量;
②二氧化碲是两性氧化物,微溶于水;
③本流程条件下,。
回答下列问题:
(1)、碲是52号元素,其在元素周期表中的位置为。(2)、“酸浸氧化”后元素以形式存在,由生成的化学方程式为 , 双氧水实际消耗量为理论消耗量的倍,原因为。(3)、“碱转化除铜”时应调节溶液的为13,此时溶液中的为。(4)、“中和沉碲”时需控制溶液的为 , 温度为 , 若溶液的过低,将导致。(5)、酸浸渣的主要成分为(填化学式),“还原”工序中发生的反应中氧化剂与还原剂的物质的量之比为。(6)、以上述流程制得的为原料制备高纯碲单质的方法如下:将溶于溶液生成 , 电解溶液即可在阴极获得单质碲。若溶液中过低,在阴极会产生 , 生成该离子的电极反应式为。 -
20、某浅绿色晶体X[x(NH4)2SO4·yFeSO4·zH2O]在分析化学中常用作还原剂.为确定其组成,某小组同学进行如下实验.
I.的测定
采用蒸馏法,蒸馏装置如图所示。

相关的实验步骤如下:
①准确称取58.80g晶体X,加水溶解后,将溶液注入三颈烧瓶中;
②准确量取50.00mL 3.0300mol•L-1H2SO4溶液于锥形瓶中;
③向三颈烧瓶中加入足量NaOH溶液,通入氮气,加热,蒸氨结束后取下锥形瓶;
④用0.120mo l•L-1 NaOH标准溶液滴定锥形瓶中过量的硫酸,滴定终点时消耗25.00mL NaOH标准溶液.
(1)、仪器M的名称为。(2)、步骤③中,发生的氧化还原反应的化学方程式为。蒸氨结束后,为了减少实验误差,还需要对直形冷凝管进行“处理”,“处理”的操作方法是。(3)、步骤④中,若振荡时锥形瓶中有液体溅出,则所测得的n(NH4+)的值将(填“偏大”“偏小”或“不变”)。(4)、II.SO42-含量的测定采用重量分析法,实验步骤如下:
①另准确称取58.80g晶体X于烧杯中,加水溶解,边搅拌边加入过量的BaCl2溶液;
②将得到的溶液用无灰滤纸(灰分质量很小,可忽略)过滤,洗涤沉淀3~4次;
③用滤纸包裹好沉淀取出,灼烧滤纸包至滤纸完全灰化;
④继续灼烧沉淀至恒重、称量,得沉淀质量为69.90g。
步骤①中,判断BaCl2溶液已过量的实验操作和现象是。
(5)、步骤②中,采用冷水洗涤沉淀,其主要目的是。(6)、结合实验Ⅰ、Ⅱ通过计算得出晶体X的化学式为。