-
1、按要求用序号填空:(1)、现有下列几种物质:①H2O ②空气 ③Mg ④CaO ⑤H2SO4 ⑥Ca(OH)2⑦CuSO4 ⑧碘酒 ⑨葡萄糖 ⑩NaHCO3。
其中属于混合物的是(填序号,下同);属于单质的是;属于酸的是;属于盐的是 ;属于有机物的是 。
(2)、现有以下几种物质:①NaHCO3晶体 ②液态HCl ③铁 ④蔗糖⑤酒精 ⑥熔融的K2SO4 ⑦干冰 ⑧石墨
其中能导电的是;(填序号,下同)
属于非电解质的是;属于电解质的是。
-
2、写出下列物质在水溶液中电离的电离方程式(1)、写出KOH 的电离方程式:(2)、写出(NH4)2CO3的电离方程式:(3)、写出K2SO4 的电离方程式:
-
3、写出下列物质的化学式:(1)、硝酸钡;(2)、硫酸铝;(3)、硫酸钠;(4)、氢氧化铜 ;(5)、碳酸钙;(6)、氯化铵。
-
4、火药的爆炸反应为 , 其中被还原的元素是( )A、N B、C C、N和S D、N和C
-
5、有关右边的基本化学反应类型与氧化还原反应关系图,解读错误的是( )
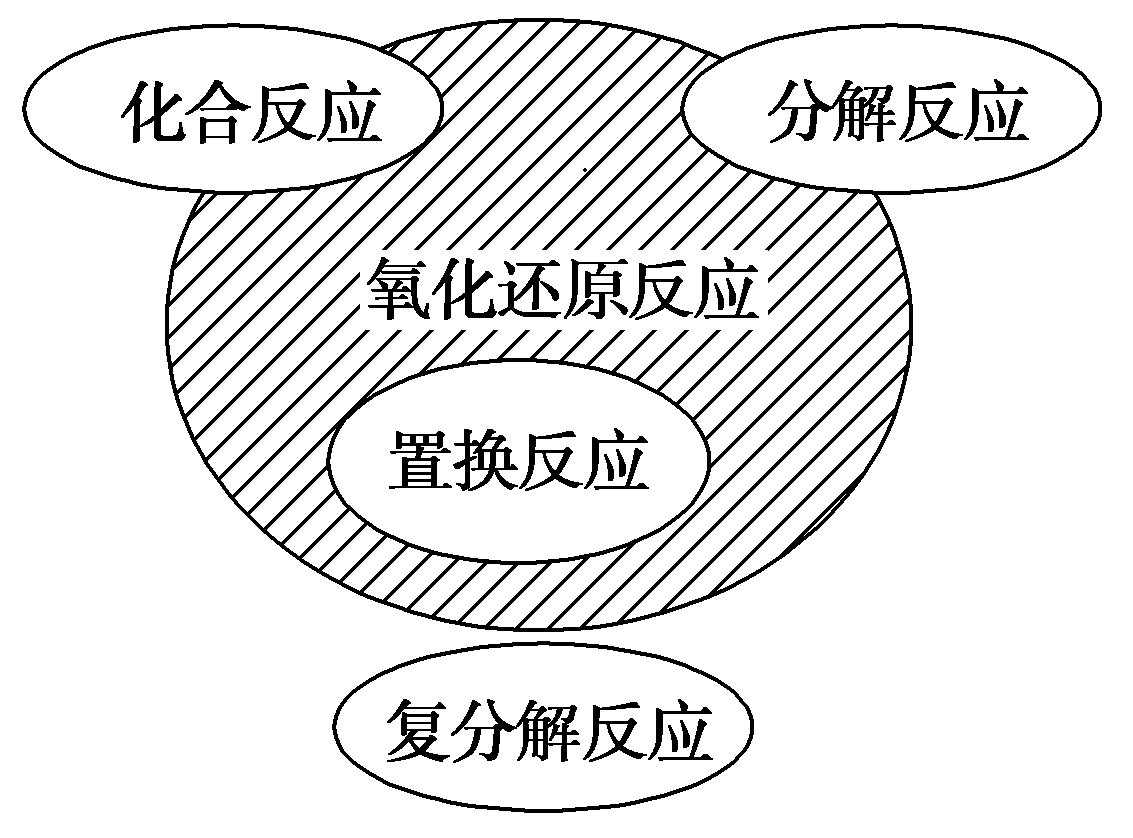 A、置换反应一定是氧化还原反应 B、复分解反应可能是氧化还原反应 C、分解反应不一定是氧化还原反应 D、有单质参加的化合反应一定是氧化还原反应
A、置换反应一定是氧化还原反应 B、复分解反应可能是氧化还原反应 C、分解反应不一定是氧化还原反应 D、有单质参加的化合反应一定是氧化还原反应 -
6、下列电离方程式正确的是( )A、H2SO4=H2++SO42- B、Ca(OH)2=Ca2++(OH)2- C、AlCl3=Al+3+3Cl-1 D、Al2(SO4)3=2Al3++3SO42-
-
7、化学兴趣小组在家中进行化学实验,按左图连接好线路发现灯泡不亮,按照右图连接好线路发现灯泡亮,由此得出的结论正确的是( )
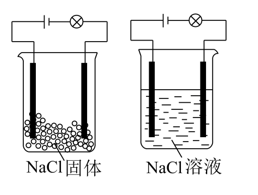 A、NaCl是非电解质 B、NaCl溶液是电解质 C、NaCl在水溶液中电离出了可以自由移动的离子 D、NaCl固体能导电
A、NaCl是非电解质 B、NaCl溶液是电解质 C、NaCl在水溶液中电离出了可以自由移动的离子 D、NaCl固体能导电 -
8、下列物质属于电解质的是( )A、熔融的NaOH B、铁丝 C、CO2 D、KCl溶液
-
9、下列说法正确的是( )A、不能导电物质就是非电解质 B、其水溶液能导电的化合物就是电解质 C、电解质任何状态下都能导电 D、酸、碱、盐都是电解质
-
10、下列分散系不能发生丁达尔现象的是( )A、稀豆浆 B、硫酸铜溶液 C、血液 D、雾
-
11、科学家发现了一种纯碳新材料“碳纳米泡沫”,每个碳纳米泡沫含有约4000个碳原子,直径约6~9nm,则这种“碳纳米泡沫”分散到空气中属于( )A、溶液 B、悬浊液 C、乳浊液 D、胶体
-
12、下列有关概念说法正确的是( )A、盐酸、冰水混合物、空气都属于混合物 B、金属氧化物均为碱性氧化物 C、只由一种元素组成的物质一定是单质 D、CuSO4∙5H2O属于纯净物
-
13、下列各组物质不互为同素异形体的是( )A、H2O和H2O2 B、O2和O3 C、金刚石和石墨 D、红磷和白磷
-
14、1942年,我国化工专家侯德榜以NaCl、NH3(氨气)、CO2等为原料先制得NaHCO3 , 进而生产出纯碱,他的“侯氏制碱法”为世界制碱工业做出了突出贡献。
某同学模拟工艺流程,制备碳酸氢钠,实验装置如图所示(图中夹持、固定用的仪器未画出)。
已知:NH3极易溶于水,溶液呈碱性。

请回答:
(1)、写出甲中发生反应的离子方程式。(2)、乙装置中的试剂是。(3)、实验结束后,分离出NaHCO3晶体的操作是(填分离操作的名称)。(4)、装置丙中析出NaHCO3的原因是a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(5)、请写出从NaHCO3晶体获得纯碱的化学方程式。(6)、检验产品碳酸钠中含有氯化钠,请你把以下实验方案补充完整:操作:取少量试样溶于水中,再滴加。
现象:。
-
15、“化学我们的生活,我们的未来”,学习化学应该明白“从生活中来,到生活中去”道理。请填空:(1)、工业上可以利用氯气制漂白粉,其化学方程式为:。(2)、研究小组用下图装置制取:

仪器A的名称为;A中反应的离子方程式为;
(3)、下列收集的正确装置是 。A、 B、
B、 C、
C、 D、
D、 (4)、某同学设计了如图实验装置进一步研究氯气的漂白性,已知通入的氯气中还含有空气和水蒸气。回答下列问题:
(4)、某同学设计了如图实验装置进一步研究氯气的漂白性,已知通入的氯气中还含有空气和水蒸气。回答下列问题:
①浓的作用是;
②与研究目的直接相关的实验现象是 , 并解释产生上述现象的原因;
③该实验设计存在事故隐患,应在D处增加一装置,该装置的作用是。
-
16、填空:(1)、某金属氯化物 , 含有 , 则该化合物的摩尔质量为;(2)、含有个水分子;(用表示,代表阿伏加德罗常数的值)(3)、(标况)约含mol氢原子;(4)、个含有电子的物质的量为;(5)、含 , R的相对原子质量为。
-
17、回答下列问题:(1)、下列物质能导电的是 , 属于电解质的是 , 属于非电解质的是。
①NaCl晶体,②液态 , ③液态醋酸,④铜,⑤固体,⑥蔗糖(),⑦氨水
(2)、和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,其变化可表述为:①请配平上述化学方程式:;
②浓盐酸在反应中显示出来的性质是(填编号)
A.还原性 B.酸性 C.氧化性
③氧化剂是 , 氧化产物是;
④每产生 , 则转移的电子的物质的量为mol。
-
18、已知:NaClO能与水缓慢反应生成NaOH、HClO。某小组探究“84消毒液”的性质,请你参与他们的探究活动。
[观察]“84消毒液”是一种透明的液体。
[预测]NaClO中Cl显+1价,可能具有漂白性;它是弱酸盐,能与较强酸反应。
[实验]在相同条件下进行实验,测得“84消毒液”的漂白效率与温度的关系如图所示。
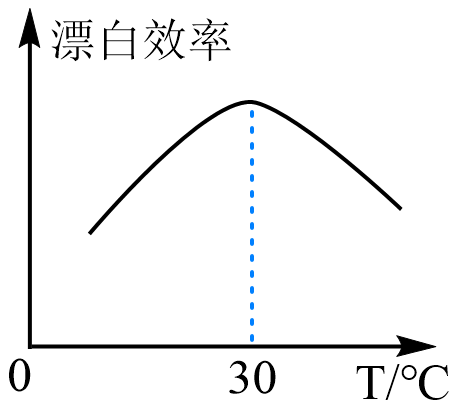
下列判断正确的是( )
A、上述探究活动中只用到了观察法、实验法 B、可用pH试纸测定“84消毒液”的pH值 C、“84消毒液”需密封保存,使用时可用沸水稀释 D、温度大于30℃时,漂白效率降低的原因可能是HClO分解加快 -
19、一定温度下,向饱和的烧碱溶液中加入一定量的金属钠,充分反应后恢复到原温度,下列叙述正确的是( )A、溶液中数目减少,有放出 B、溶液中溶质的质量分数增大,有放出 C、溶液中溶质的质量分数不变,有放出 D、溶液中数目增大,有放出
-
20、某兴趣小组的同学向一定体积的Ba(OH)2溶液中逐滴加入稀硫酸,并测得溶液的导电能力随时间的变化曲线如图所示。下列说法错误的是(不考虑水的电离)( )
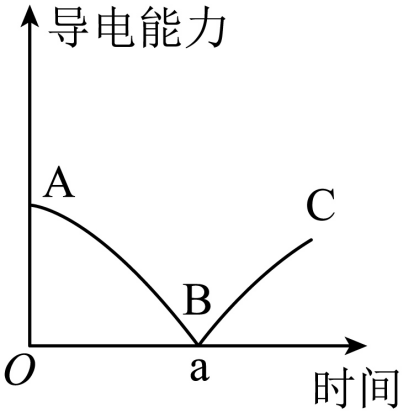 A、A点溶液中的微粒只有Ba2+和OH- B、B点表示Ba(OH)2溶液与稀硫酸恰好完全中和 C、B—C的过程中。溶液的导电能力逐渐增强的原因之一是溶液中能够自由移动的离子数目增多(单位体积内) D、A—C的过程中。仅发生一种属于基本反应类型的反应
A、A点溶液中的微粒只有Ba2+和OH- B、B点表示Ba(OH)2溶液与稀硫酸恰好完全中和 C、B—C的过程中。溶液的导电能力逐渐增强的原因之一是溶液中能够自由移动的离子数目增多(单位体积内) D、A—C的过程中。仅发生一种属于基本反应类型的反应