-
1、由硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、Al2O3和SiO2)得到绿矾(FeSO4•7H2O),然后制取透明氧化铁颜料的流程如图:

已知:
Ⅰ.透明氧化铁又称纳米氧化铁,粒子直径很微小(10~90nm),包括氧化铁黄(FeOOH)2O3),难溶于水,在碱性条件下非常稳定;
Ⅱ.Fe3+能将FeS2中的硫元素氧化为+6价。
(1)、FeS2的电子式是 。(2)、“滤渣”中的主要成分是 (填名称)。(3)、流程中“ ”环节的目的是 。 (4)、“还原”过程中涉及的离子方程式为 。(5)、“沉淀”采用分批加入KOH溶液,并不断搅拌,这样操作不但可以得到均匀、色泽纯正的氢氧化铁。(6)、可用分光光度法测定制得的透明氧化铁中氧化铁黄和氧化铁红的含量。已知Fe(SCN)3的吸光度A(对特定波长光的吸收程度)与Fe3+标准溶液浓度的关系如图所示。
”环节的目的是 。 (4)、“还原”过程中涉及的离子方程式为 。(5)、“沉淀”采用分批加入KOH溶液,并不断搅拌,这样操作不但可以得到均匀、色泽纯正的氢氧化铁。(6)、可用分光光度法测定制得的透明氧化铁中氧化铁黄和氧化铁红的含量。已知Fe(SCN)3的吸光度A(对特定波长光的吸收程度)与Fe3+标准溶液浓度的关系如图所示。
称取3.47g透明氧化铁,用稀硫酸溶解并定容至1L,准确移取该溶液10.00mL,再用蒸馏水定容至100mL,测得溶液吸光度A=0.8,则透明氧化铁中氧化铁红(Fe2O3)的质量分数为。
-
2、如表是元素周期表的一部分,表中所列的数字分别代表某一种元素。针对表中①﹣⑩号元素回答下列问题。
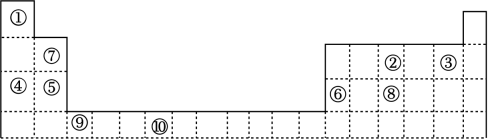 (1)、⑩元素的名称是 , ⑨元素的原子结构示意图为 。(2)、②、③、④、⑤、⑥五种元素中,原子半径由小到大的顺序是 (填元素符号);这五种元素分别形成的简单离子中离子半径最小的是 (填离子符号)。(3)、某些不同族元素的性质也有一定的相似性,如表中元素⑦与元素⑥的氢氧化物有相似的性质,请写出元素⑦的氢氧化物与NaOH溶液反应的化学方程式:。(4)、元素①和④的单质化合形成的化合物能与水反应生成氢气,向反应后的溶液中滴入酚酞,溶液变红。(5)、元素④和⑥相比,金属性较强的是 (填元素符号),下列能证明这一事实的有 (填序号)。
(1)、⑩元素的名称是 , ⑨元素的原子结构示意图为 。(2)、②、③、④、⑤、⑥五种元素中,原子半径由小到大的顺序是 (填元素符号);这五种元素分别形成的简单离子中离子半径最小的是 (填离子符号)。(3)、某些不同族元素的性质也有一定的相似性,如表中元素⑦与元素⑥的氢氧化物有相似的性质,请写出元素⑦的氢氧化物与NaOH溶液反应的化学方程式:。(4)、元素①和④的单质化合形成的化合物能与水反应生成氢气,向反应后的溶液中滴入酚酞,溶液变红。(5)、元素④和⑥相比,金属性较强的是 (填元素符号),下列能证明这一事实的有 (填序号)。A.在化合物中④的化合价比⑥的低
B.④的单质能与冷水剧烈反应而⑥的单质不能
C.④的最高价氧化物对应水化物的碱性比⑥强
D.④单质的熔点比⑥单质的低
(6)、⑧号元素有多种化合物,次磷酸(H3PO2)和次磷酸钠(NaH2PO2)常为化工生产的还原剂。Ⅰ、已知H3PO2是一种一元弱酸,向Ba(H2PO2)2 溶液中加入H2SO4制备H3PO2 , 写出该反应的离子方程式 ;
Ⅱ、NaH2PO2可在酸性条件下与Ni2+作用进行“化学镀镍”(如在木材表面生成一层Ni﹣P合金),反应中磷元素化合价发生的变化是 (选填编号)。
a.升高
b.降低
c.既升高又降低
-
3、向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸1L,固体物质完全反应,得到标准状况下8.96LNO和NO2的混合气体及Cu(NO3)2。在所得溶液中加入1.0mol•L﹣1的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀, 沉淀质量为39.2g。下列有关说法正确的是 ( )
①Cu与Cu2O的物质的量之比为1:2
②硝酸的物质的量浓度为2.8mol•L-1
③Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
④产生的NO标准状况下体积为2.24L
⑤原混合物中Cu的质量分数为52.9%
A、①⑤ B、②④ C、③④ D、②③ -
4、下列实验操作、现象和对应结论一致且正确的是( )
选项
操作
现象
解释(或结论)
A
向补铁口服液中滴加几滴酸性KMnO4溶液
紫色褪去
补铁口服液中一定含有Fe2+
B
向I2水中先加足量浓NaOH溶液,再加适量CCl4 , 振荡后静置
液体分层,上层无色,下层紫红色
CCl4能萃取碘水中的碘,而NaOH溶液不能
C
激光笔照射微蓝色透明的硫的酒精溶液
激光笔照射时产生光亮的通道
微蓝色透明的硫的酒精溶液属于胶体
D
向装有某未知溶液的试管中滴加少量稀NaOH溶液,将湿润的红色石蕊试纸置于试管口
湿润的红色石蕊试纸未变蓝
证明溶液中无NH4+
A、A B、B C、C D、D -
5、下列物质(或物质的饱和溶液)之间通过一步反应能实现如图所示转化关系,且与表中条件也匹配的是( )
选项
X
Y
Z
箭头上为反应条件或试剂
A
Fe
FeCl2
FeCl3
①通入少量Cl2
B
Na2CO3
NaCl
NaHCO3
③先通NH3、再通CO2
C
Na
NaOH
NaCl
②电解饱和食盐水
D
Si
Na2SiO3
H2SiO3
②加热
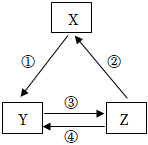 A、A B、B C、C D、D
A、A B、B C、C D、D -
6、下列离子方程式的书写正确的是( )A、向Na2SO3溶液中加入稀HNO3:SO32-+2H+=SO2↑+H2O B、向水垢中滴加足量醋酸:CaCO3+2H+=Ca2++CO2↑+H2O C、用Na2SO3溶液吸收少量Cl2:3SO32-+Cl2+H2O=2HSO3-+2Cl﹣+SO42- D、少量Fe与足量稀HNO3:3Fe+2NO3-+8H+=2NO↑+2Fe2++4H2O
-
7、40mLX溶液中可能含有下列离子中的若干种:Na+、NH4+、Mg2+、Fe3+、Al3+、Cl﹣、SO42-现对X溶液进行如图所示实验,其现象和结果如图。下列说法正确的是( )
 A、X溶液中一定含有Mg2+、Al3+、Cl﹣ , 不含有Na+和NH4+ B、X溶液中一定含有Na+、Mg2+、Cl﹣ , 可能含有Al3+ C、X溶液中一定含有Na+ , 且c(Na+)为1.50mol/L D、X溶液中c(Mg2+)为0.50mol/L、c(Al3+)为0.250mol/L
A、X溶液中一定含有Mg2+、Al3+、Cl﹣ , 不含有Na+和NH4+ B、X溶液中一定含有Na+、Mg2+、Cl﹣ , 可能含有Al3+ C、X溶液中一定含有Na+ , 且c(Na+)为1.50mol/L D、X溶液中c(Mg2+)为0.50mol/L、c(Al3+)为0.250mol/L -
8、利用如图所示装置进行相关实验,能达到实验目的的是( )
A
B
C
D




探究氧化性:KMnO4>Cl2>I2
加热熔融的纯碱固体
实验室里接收用自来水制取的蒸馏水
除CO2中的HCl杂质
A、A B、B C、C D、D -
9、海水“晒盐”得到的粗盐中常含有难溶性杂质和氯化镁、氯化钙等可溶性杂质。为除去可溶性杂质,进行如图所示实验操作。下列说法正确的是( )
 A、步骤①和②的顺序不能颠倒 B、加入过量氢氧化钠溶液的目的是除尽Ca2+ C、步骤③中所得沉淀的成分是氢氧化镁和碳酸钙 D、步骤④中只发生了中和反应
A、步骤①和②的顺序不能颠倒 B、加入过量氢氧化钠溶液的目的是除尽Ca2+ C、步骤③中所得沉淀的成分是氢氧化镁和碳酸钙 D、步骤④中只发生了中和反应 -
10、A、B、C、D、E是原子序数依次增大的五种常见短周期主族元素,其中A、B、C、D四种元素的原子序数之和为E元素原子序数的2倍。E是短周期中原子半径最大的元素。A、B、C、D四种元素形成的化合物[CA4]+[BD4]﹣有多种用途可用来合成纳米管,还可作杀虫剂、催化剂、阻燃剂等,其结构如图所示。下列说法正确的是( )
 A、元素A、C能形成含有非极性键的18电子化合物 B、最简单氢化物的稳定性:C>D C、元素D、E形成的化合物为共价化合物 D、化合物[CA4]+[BD4]﹣中各原子均满足8电子稳定结构
A、元素A、C能形成含有非极性键的18电子化合物 B、最简单氢化物的稳定性:C>D C、元素D、E形成的化合物为共价化合物 D、化合物[CA4]+[BD4]﹣中各原子均满足8电子稳定结构 -
11、下列说法中正确的是( )A、根据是否具有丁达尔效应,可将分散系分为溶液、浊液和胶体 B、Fe2O3、Na2O2、CaO既属于碱性氧化物,又属于离子化合物 C、某电解质水饮料配料表中注明“含有钠、钾、维生素、碳水化合物等”,其均属于电解质 D、有单质参加的化合反应一定是氧化还原反应,没有单质参加的化合反应也可能是氧化还原反应
-
12、设NA为阿伏加德罗常数的值。下列说法正确的是( )A、120g由NaHSO4和MgSO4组成的混合固体中SO42-数目为NA B、标准状况下,22.4LCCl4中C﹣Cl键的数目为4NA C、12.8gCu与足量S完全反应,转移的电子数为0.2NA D、1molI2(g)和1molH2在密闭容器中充分反应,所得混合气体的分子数小于2NA
-
13、宏观辨识与微观探析是化学学科核心素养之一。下列操作或现象,对应化学方程式能正确解释且书写正确的是( )A、金属锂保存在石蜡中:2Li+O2=Li2O2、2Li+2H2O=2LiOH+H2↑ B、向硫代硫酸钠溶液中滴加稀硫酸,产生淡黄色沉淀和刺激性气味气体:Na2S2O3+H2SO4=S↓+SO2↑+H2O+Na2SO4 C、向滴有酚酞的Ba(OH)2 溶液中加入NaHSO4溶液,至溶液恰好变为无色:Ba(OH)2+NaHSO4=BaSO4↓+H2O+NaOH D、NaAlO2溶液中通入过量CO2产生白色沉淀:2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3
-
14、常温下,下列各组离子在指定溶液中一定能大量共存的是( )A、pH=1 的溶液中:Na+、K+、NO3-、 B、透明溶液中:Fe3+、Na+、NO3-、Cl﹣ C、0.1mol•L﹣1KI溶液中:NH4+、Fe3+、Cl﹣、SO42- D、能使甲基橙变红的溶液中:Mg2+、Ba2+、NO3-、HCO3-
-
15、下列有关化学用语正确的是( )A、次氯酸的结构式:H﹣Cl﹣O B、中子数为10的氧原子:10O C、NH4Cl的电子式
 D、铝离子的结构示意图:
D、铝离子的结构示意图:
-
16、实验兴趣小组为探究电解质的导电性做了如下实验。根据所学知识回答下列问题:
实验操作
实验一:向三个烧杯中分别加入硝KNO3固体、NaCl固体和蒸馏水。按照右图所示连接装置,将石墨电极伸入到烧杯中,观察并记录现象
实验二:将少量KNO3固体和NaCl固体加入盛有水的烧杯中,搅拌使其完全溶解转化为相应的溶液,重复上述的实验,观察并记录现象

实验现象
实验一:灯泡;(填“发光”或“不发光”)
实验二:灯泡。(填“发光”或“不发光”)
实验结论
干燥的KNO3固体、NaCl固体、蒸馏水都 ;(填“导电”或“不导电”)但是KNO3溶液、NaCl溶液却能够 。(填“导电”或“不导电”)
-
17、Fe(OH)3胶体的制备实验原理及操作如下:
 (1)、方法:在小烧杯中加入40 mL蒸馏水,加热至沸腾,向沸水中。继续煮沸至液体 , 停止加热,即可得到Fe(OH)3胶体。(2)、原理:FeCl3+ 3H2O + 3HCl(3)、利用 可以鉴别Fe(OH)3胶体和FeCl3溶液。
(1)、方法:在小烧杯中加入40 mL蒸馏水,加热至沸腾,向沸水中。继续煮沸至液体 , 停止加热,即可得到Fe(OH)3胶体。(2)、原理:FeCl3+ 3H2O + 3HCl(3)、利用 可以鉴别Fe(OH)3胶体和FeCl3溶液。 -
18、指出下列氧化还原反应中的氧化剂和还原剂:(1)、在Fe2O3+3CO2Fe+3CO2反应中 , 氧化剂是 ;还原剂是(2)、在Zn+H2SO4= ZnSO4+H2↑ 反应中 , 氧化剂是 ;还原剂是(3)、在4Na+O2= 2Na2O反应中 , 氧化剂是 ;还原剂是(4)、在CuO+H2Cu+H2O 反应中 , 氧化剂是 ;还原剂是
-
19、认识氧化还原反应,根据所学知识填空:(1)、氧化还原反应的特征是;氧化还原反应的本质是; 对于反应MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O (2)、MnO2中的Mn元素化合价(填“升高”或“降低”),在反应中电子(填“得到”或“失去”),发生反应(填“氧化”或“还原”)。(3)、HCl中的Cl元素化合价(填“升高”或“降低”),在反应中电子(填“得到”或“失去”),发生反应(填“氧化”或“还原”)。
MnCl2+Cl2↑+2H2O (2)、MnO2中的Mn元素化合价(填“升高”或“降低”),在反应中电子(填“得到”或“失去”),发生反应(填“氧化”或“还原”)。(3)、HCl中的Cl元素化合价(填“升高”或“降低”),在反应中电子(填“得到”或“失去”),发生反应(填“氧化”或“还原”)。 -
20、写出下列反应的离子反应方程式:(1)、NaOH溶液和HCl溶液:;(2)、NaCl溶液和AgNO3溶液:;(3)、Ba(OH)2溶液和H2SO4溶液:;(4)、Fe与CuSO4溶液反应:;