-
1、已知由二氧化碳和氧气组成的混合气体,其平均相对分子质量为38,则该混合气体中二氧化碳和氧气的质量比为( )A、1∶1 B、1∶2 C、11∶8 D、8∶11
-
2、电视剧中《三生三世十里桃花》中的仙境美轮美奂,其中所需的烟雾是在放于温热石棉网上的和Zn粉的混合物中滴几滴水后产生的白烟: , 下列说法中正确的是( )A、该反应中仅是还原产物 B、常温下每消耗1.3gZn粉,即可产生 C、该反应中作氧化剂,Zn作还原剂 D、每生成1molZnO共转移5mol电子
-
3、对于相同质量的二氧化硫和三氧化硫来说,下列关系正确的是( )A、气体分子数之比为1:1 B、原子个数之比为3:4 C、气体体积之比为5:4 D、含硫原子的个数比为5:4
-
4、下列对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断均正确的是( )
选项
陈述Ⅰ
陈述Ⅱ
判断
A
氯气能使湿润的红色布条褪色
氯气具有漂白性
Ⅰ对;Ⅱ对;有
B
可作潜水艇的供氧剂
能和、反应生成
Ⅰ对;Ⅱ对;有关系
C
金属钠在空气中很容易变质
金属钠具有强还原性
Ⅰ错;Ⅱ对;有关系
C
中
 少量杂质可将气体通入饱和溶液除去
少量杂质可将气体通入饱和溶液除去可与反应
Ⅰ对,Ⅱ对,有去
A、A B、B C、C D、D -
5、下列溶液中,能大量共存的离子组是( )A、含大量的溶液:、、、 B、含大量溶液:、、、 C、某强碱性溶液:、、、 D、含大量的溶液:、、、
-
6、有两个无标签的试剂瓶,分别盛有Na2CO3、NaHCO3固体,有四位同学为鉴别它们采用了以下不同方法,其中不可行的是( )A、分别将它们配制成溶液,再加入澄清石灰水 B、分别将它们配制成溶液,再加入CaCl2溶液 C、分别将它们配制成溶液,再逐滴滴加稀盐酸 D、分别加热,再用澄清石灰水检验是否有气体产生
-
7、下列说法正确的是( )A、的摩尔质量是 B、标准状况下,水中约含个分子 C、常温常压下,中所含氧原子数约为 D、常温常压下,的体积是
-
8、下列物质不可由对应的两种单质直接化合制备的是( )A、 B、HCl C、 D、
-
9、英国化学家汉弗里·戴维在十九世纪初通过电解的方式获得金属钠的单质,下列有关金属钠的性质描述,错误的是( )A、金属钠性质活泼,一般保存在煤油中 B、Na的金属性强,可从硫酸铜溶液中置换出铜 C、金属钠可用刀切割,说明其硬度较小 D、使用后多余的金属钠应放回试剂瓶中
-
10、下列反应中,属于氧化还原反应,但水既不作氧化剂又不作还原剂的是( )A、2Na+2H2O=2NaOH+H2↑ B、Cl2+H2O=HCl+HClO C、SO2+H2O=H2SO3 D、C+H2OCO↑+H2↑
-
11、下列生活中的化学现象与氧化还原知识无关的是( )A、菜刀洗过后如果没擦干,放置一段时间就会出现斑点 B、用盐酸可以除去铁锈 C、用天然气做饭烧菜 D、月饼盒中放置硫酸亚铁粉末包
-
12、下列反应的离子方程式书写正确的是( )A、大理石与盐酸反应: B、铜与硝酸银溶液反应: C、稀硝酸与氢氧化钾溶液反应: D、二氧化碳与氢氧化钠溶液反应:
-
13、下列属于非电解质的是( )A、酒精溶液 B、Cu C、熔融 D、
-
14、溶液和胶体这两种分散系的根本区别是( )A、是否能通过半透膜 B、分散质粒子直径的大小 C、是否存在丁达尔效应 D、是否均一、透明、稳定
-
15、某自热火锅发热包的成分为生石灰、苛性钠、铝粉、活性炭、还原铁粉、纯碱。下列关于发热包成分的物质分类正确的是( )
选项
A
B
C
D
物质
苛性钠、纯碱
铝粉、铁粉
生石灰
活性炭、纯碱
类别
碱
单质
酸性氧化物
含碳化合物
A、A B、B C、C D、D -
16、某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL容量瓶中配制250 mL烧碱溶液
B.用移液管(或碱式滴定管)量取25.00 mL烧碱溶液于锥形瓶中并加几滴甲基橙指示剂
C.在天平上准确称取烧碱样品w g,在烧杯中加蒸馏水溶解
D.将物质的量浓度为m mol/L的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度V1 mL
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2 mL
请完成下列问题:
 (1)、正确的操作步骤是(填写字母)→→→D→;(2)、 若用标准浓度的H2SO4溶液测定NaOH溶液的浓度,参看图示从下表中选出正确选项( )
(1)、正确的操作步骤是(填写字母)→→→D→;(2)、 若用标准浓度的H2SO4溶液测定NaOH溶液的浓度,参看图示从下表中选出正确选项( )锥形瓶中溶液
滴定管中溶液
选用指示剂
选用滴定管
A
碱
酸
石蕊
乙
B
酸
碱
酚酞
甲
C
碱
酸
甲基橙
甲
D
酸
碱
石蕊
乙
(3)、 操作D中液面应调整到 , 尖嘴部分应;(4)、 滴定终点时的颜色变化是;(5)、若酸式滴定管没用标准H2SO4润洗,会对测定结果有何影响(填“偏高”、“偏低”或“无影响”,其他操作均正确);(6)、该烧碱样品的纯度计算式是。 -
17、已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表所示:
酸
电离平衡常数
醋酸
碳酸
亚硫酸
(1)、根据上表可知,试比较同浓度Na2CO3、Na2SO3溶液的pH:Na2CO3Na2SO3。(填“>” “<”或 “=”,下同)(2)、向0.1 mol∙L−1的CH3COONa溶液中加入少量下列物质,其水解程度增大的是____。A、NaCl溶液 B、Na2CO3固体 C、NH4Cl溶液 D、CH3COONa固体(3)、已知常温下NH3∙H2O的电离常数 ,则常温下CH3COONH4溶液的pH7。(4)、将pH=4的溶液稀释100倍后溶液的pH范围是 , 图中的纵坐标可以是。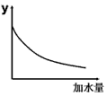
a.溶液的pH b.醋酸的电离平衡常数
c.溶液的导电能力 d.醋酸的电离程度
(5)、NaHSO3是中学化学常见的物质。在水溶液中存在如下两个平衡Ka2
Kh2(水解平衡常数,表示水解程度)
已知25 ℃时,Ka2 > Kh2 , 则0.1 mol∙L−1 NaHSO3溶液呈(填“酸性”“碱性”或“中性”);其中c(Na+)c()(填“>”“<”或“=”);其电荷守恒表达式可写为。
-
18、(1)、一定温度下,有a.盐酸;b.硫酸;c.醋酸三种酸,用字母填写下列空格:
①当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是。
②若三者c(H+)相同时,物质的量浓度由大到小的顺序是。
(2)、常温下,0.1 mol·L-1的HCl溶液中,由水电离出来的H+浓度为mol·L-1。(3)、在一元强碱MOH溶液中加入一元酸HA溶液,充分反应后,溶液呈中性。甲同学认为溶液中c(A-)=c(M+),而乙同学认为c(A-)和c(M+)是否相等,要看一元酸HA是强酸还是弱酸。你认为同学(填“甲”或“乙”)的说法正确,理由为。(4)、明矾[KAl(SO4)2·12H2O]常用作净水剂,其原理是(用离子方程式表示)。(5)、将FeCl3溶液蒸干并灼烧,最终得到的固体物质是(填写化学式)。 -
19、Ⅰ.以下是关于合成氨的有关问题,请回答:(1)、若在容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2在--定条件下发生反应:N2+3H22NH3 △H<0,若5min反应达到平衡,此时测得NH3的物质的量为0.2mol。则0-5min内,用H2表示的化学反应速率为。(2)、平衡后,若提高H2的转化率,可以采取的措施有____。A、加催化剂 B、增大容器体积 C、降低反应体系的温度 D、加入一定量N2(3)、若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g)2NH3(g) △H<0,其化学平衡常数K与温度t的关系如表所示:
t℃
200
300
400
K
K1
K2
0.5
请完成下列问题:
①试比较K1、K2的大小,K1K2(填">”、“<”或“=”);
②400℃时,反应2NH3(g)N2(g)+ 3H2(g)的化学平衡常数为。当测得NH3、N2和H2物质的量分别为3mol、2mol和2mol时,则该反应的v(N2)正 v(N2)逆(填“>” “<”或“=”)。
(4)、Ⅱ.肼(N2H4)是一种良好的火箭推进剂,其与适当的氧化剂(如过氧化氢、氧气等)配合,可组成比冲最高的可贮存液体推进剂。已知:N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-544kJ/mol,键能数据如下表:
化学键
N-N
N-H
O=O
O-H
键能/(kJ/mol)
193
391
497
463
则氮氮三键的键能为kJ/mol。
(5)、已知:N2(g)+2O2(g)=2NO2(g) △H= + 68kJ/mol,则肼和二氧化氮反应生成氮气和水蒸气的热化学方程式为。 -
20、25 ℃时,将一定浓度的盐酸和一定浓度的氨水按2∶1的体积比混合,若混合溶液中c()=c(Cl-),则溶液的pH ( )A、大于7 B、小于7 C、等于7 D、无法确定