-
1、下列事实能用平衡移动原理解释的是( )A、生铁比高纯度的铁在空气中更容易发生电化学腐蚀 B、用分解制取氧气时加入少量固体可加速的分解 C、密闭烧瓶内存在平衡体系: , 缩小容器的容积,混合气体颜色加深 D、漂白粉水溶液中滴入少量醋酸,漂白效果增强
-
2、一种新型溴流电池,可作储能设备(如图所示).充电时,电极a的反应为: . 下列说法正确的是( )
 A、充电时,锂元素被还原 B、放电时,溶液的浓度不变 C、充电时,总反应式为 D、每生成 , 电极a的质量理论上增加
A、充电时,锂元素被还原 B、放电时,溶液的浓度不变 C、充电时,总反应式为 D、每生成 , 电极a的质量理论上增加 -
3、已知由
 制备
制备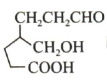 的合成路线如图所示(代表苯基).
的合成路线如图所示(代表苯基).
下列说法中错误的是( )
A、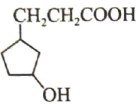 的分子式为
B、反应③和反应⑤均为取代反应
C、
的分子式为
B、反应③和反应⑤均为取代反应
C、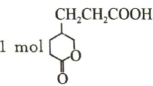 最多可与反应
D、
最多可与反应
D、 含有两种官能团
含有两种官能团
-
4、由下列实验操作及现象所得结论或解释正确的是( )
选项
实验操作
现象
结论或解释
A
向溶液中加入溶液,充分反应后滴加溶液
溶液变红
与的反应是可逆反应
B
常温下,测定等浓度的溶液和溶液的
前者大于后者
非金属性:
C
将某溶液滴在淀粉试纸上
试纸变蓝
原溶液中一定含有
D
向蛋白质溶液中加入醋酸铅溶液
产生白色沉淀
蛋白质发生了盐析
A、A B、B C、C D、D -
5、现有部分短周期元素的性质或原子结构如下表.
元素代号
元素的性质或原子结构
Q
有一种原子不含中子
W
M层上的电子数为4
X
常温下单质为双原子分子,其简单氢化物的水溶液显碱性
Y
L层的电子数为次外层电子数的3倍
Z
元素的最高化合价是价
下列叙述中错误的是( )
A、原子半径大小: B、W、X、Z三种元素的最高价氧化物对应水化物的酸性: C、由X、Y和Q三种元素形成的化合物一定为共价化合物 D、物质在高温下可与反应生成W单质 -
6、设为阿伏加德罗常数的值.下列说法正确的是( )A、中含有的离子总数为 B、常温下,的溶液中含有的总数约为 C、含的和的混合物中所含质子数为 D、若反应中生成 , 则转移电子数一定为
-
7、下列反应的离子方程式表示正确的是( )A、向溶液中加入足量粉,溶液颜色逐渐消失: B、向溶液中通入 C、与稀硝酸反应: D、碳酸氢钠溶液与少量石灰水反应:
-
8、下列玻璃仪器在相应实验中选用不合理的是( )
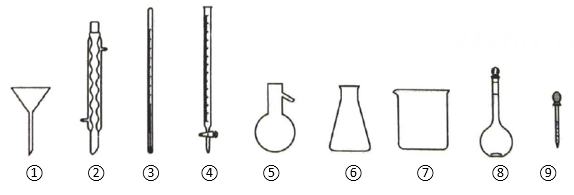 A、蒸馏法分离乙醇和乙醚:③⑤⑥ B、重结晶法提纯(含少量):①②③ C、可用硫酸溶液配制硫酸溶液:④⑦⑧⑨ D、用溶液滴定水中游离氯:④⑥
A、蒸馏法分离乙醇和乙醚:③⑤⑥ B、重结晶法提纯(含少量):①②③ C、可用硫酸溶液配制硫酸溶液:④⑦⑧⑨ D、用溶液滴定水中游离氯:④⑥ -
9、下列分子属于极性分子的是( )A、 B、 C、 D、
-
10、化学与材料科学密切相关.下列说法中错误的是( )A、二氧化硅透明、折射率合适、能够发生全反射,常用于制造光导纤维 B、镁铝合金的密度小、强度高,是一种用途广泛的无机非金属材料 C、利用合成淀粉实现了无机小分子向有机高分子的转变 D、高压钠灯发出的黄光射程远、透雾能力强,可用于道路照明
-
11、化合物C是一种医药中间体,可通过以下方法合成:

①A中含氧官能团的名称为和(每空1分)。
②B的结构简式为 , A→B的反应类型为。(1分)
③写出B→C的化学反应方程式。
④C分子中有种不同化学环境的氢原子。
⑤D是A的一种同分异构体。D的苯环上的一氯代物有2种,D能发生水解反应且能发生银镜反应,写出符合条件的D的结构简式:。
-
12、湿法炼锌净化钴渣中含有Zn、Co、Cu、Fe的单质及Zn(OH)2 , 可利用过硫酸钠氧化水解法实现钴的富集,同时分别回收锌、铜和铁元素,工艺流程如下:

回答下列问题:
(1)、“酸浸”时,将钴渣研细的目的是。(2)、浸渣的主要成分为 (填化学式)。(3)、“除铁”工艺中H2O2的作用是;由流程可知:Co2+的还原性 (填“强于”或“弱于”)Fe2+。(4)、氨水可代替沉钴工序中的NaOH生成滤渣Ⅱ,发生反应的离子方程式为。(5)、上述流程中____ (填标号)可返回湿法炼锌系统,提高锌的利用率。A、浸渣 B、滤渣Ⅰ C、滤液Ⅱ D、滤渣Ⅱ -
13、已知SO3(g)O2(g)+SO2(g)反应过程的能量变化如图所示:
 (1)、由图可知SO3(g)O2(g)+SO2(g)为(填“吸热”或“放热”)反应(1分)。(2)、E所代表的能量是;E的大小对该反应的反应热(填“有”或“无”)影响(1分)。(3)、请求出反应2SO2(g)+O2(g)2SO3(g) △H=kJ/mol。(4)、又知2NO(g)+O2(g)2NO2(g) △H=-113.0kJ/mol,请根据题给条件求出反应NO2(g)+SO2(g)SO3(g)+NO(g)的焓变△H=kJ/mol。(5)、25℃、101kPa时,11g丙烷(C3H8)完全燃烧生成CO2和液态水时放出的热量是555.0kJ,则表示丙烷燃烧热的热化学方程式是。(6)、已知:
(1)、由图可知SO3(g)O2(g)+SO2(g)为(填“吸热”或“放热”)反应(1分)。(2)、E所代表的能量是;E的大小对该反应的反应热(填“有”或“无”)影响(1分)。(3)、请求出反应2SO2(g)+O2(g)2SO3(g) △H=kJ/mol。(4)、又知2NO(g)+O2(g)2NO2(g) △H=-113.0kJ/mol,请根据题给条件求出反应NO2(g)+SO2(g)SO3(g)+NO(g)的焓变△H=kJ/mol。(5)、25℃、101kPa时,11g丙烷(C3H8)完全燃烧生成CO2和液态水时放出的热量是555.0kJ,则表示丙烷燃烧热的热化学方程式是。(6)、已知:2N2O5(g)=2N2O4(g)+O2(g) △H1=-4.4kJ·mol-1①
2NO2(g)=N2O4(g) △H2=-55.3kJ/mol②
则反应N2O5(g)=2NO2(g)+O2(g)的△H=kJ/mol。
-
14、我国的“天宫”空间站的核心舱“天和”选择了高效柔性砷化镓(GaAs)薄膜太阳能电池来供电。(1)、镓的原子结构示意图为
 , 镓元素在元素周期表中的位置是。 (2)、GaAs的熔点为1238℃且熔融状态不导电,据此判断它是 (填“共价”或“离子”)化合物。(3)、镓与氨气在1100℃下反应生成氮化镓和氢气,该反应的化学方程式是。(4)、下列说法错误的是。
, 镓元素在元素周期表中的位置是。 (2)、GaAs的熔点为1238℃且熔融状态不导电,据此判断它是 (填“共价”或“离子”)化合物。(3)、镓与氨气在1100℃下反应生成氮化镓和氢气,该反应的化学方程式是。(4)、下列说法错误的是。a.氢氧化镓可能具有两性 b.砷化镓具有半导体性质
c.As与H2在低温时可剧烈化合为AsH3 d.酸性:H2SO4>H3PO3>H3AsO4
-
15、Ⅰ.某无色透明溶液中可能存在大量Ag+、Mg2+、Fe3+、Cu2+中的一种或几种,请填写下列空白。(1)、不用做任何实验就可以肯定溶液中不存在的离子是。(2)、取少量原溶液,加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,沉淀不消失,有关反应的离子方程式为。(3)、取(2)的滤液加过量的NaOH溶液,出现白色沉淀,则出现白色沉淀的离子方程式为。(4)、原溶液中可能大量存在的阴离子是____ (填序号)。A、Cl- B、 C、 D、OH-(5)、Ⅱ.有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl而成,为检验它们做了如下实验:①固体混合物溶于水,搅拌后得到无色透明溶液:②往此溶液中滴加硝酸钡溶液,有白色沉淀生成:③过滤,洗涤,将沉淀物置于稀硝酸中,发现沉淀全部溶解。请回答下列问题:
固体混合物中肯定有 , 可能含有的是。
-
16、下列实验操作及现象或结论不正确的是( )
实验操作及现象
结论
A
向滴有酚酞的NaOH溶液中通入SO2 , 溶液红色褪去
SO2是酸性氧化物,溶于水显酸性
B
常温下,铁片放入稀硝酸、稀硫酸中,均有气泡产生
Fe与两种酸均发生置换反应
C
将水滴入盛有Na2O2固体的试管中,立即把带火星的木条放在试管口,可观察到有气泡产生,木条复燃
Na2O2固体遇水产生O2
D
向某待测液溶液中滴加少量KSCN溶液,振荡,无明显现象,再加入几滴新制氯水,溶液变成红色
待测液中一定含有Fe2+
A、A B、B C、C D、D -
17、氢氧化锂是制取锂和锂的化合物的原料,用电解法制备氢氧化锂的工作原理如图所示:

下列叙述不正确的是( )
A、b极附近溶液的pH增大 B、a极发生的反应为2H2O-4e-=O2↑+4H+ C、该法制备LiOH还可得到硫酸和氢气等产品 D、b极是电解池的阳极 -
18、下列离子方程式正确的是( )A、硫化钠溶液与硝酸混合:S2-+2H+=H2S↑ B、Fe(OH)3溶于过量HI溶液:Fe(OH)3+3H+=Fe3++3H2O C、过量的氨水与少量氯化铝溶液混合:Al3++4NH3﹒H2O=+4+2H2O D、Ba(OH)2溶液与少量NaHCO3溶液混合:+Ba2++OH-=BaCO3↓+H2O
-
19、化合物M(结构如图所示)是常用的还原剂之一,其中X、Y、Z是原子序数递减的不同周期短周期元素,X与W、Z与W均能形成原子个数比为1:1和2:1的化合物,W的最外层电子数是电子层数的3倍。下列叙述正确的是( )
 A、Y的最高价氧化物对应的水化物是一种弱酸 B、Z位于第三周期第ⅦA族 C、X和Z形成的化合物的水溶液呈酸性 D、化合物M不能与Z2W2反应
A、Y的最高价氧化物对应的水化物是一种弱酸 B、Z位于第三周期第ⅦA族 C、X和Z形成的化合物的水溶液呈酸性 D、化合物M不能与Z2W2反应 -
20、有机物G(
 )能添加在牙膏、口香糖中以增强香气。下列关于G的说法错误的是( ) A、分子式为C11H14O B、一氯代物有8种(不考虑立体异构) C、所有碳原子可能在同一平面上 D、能发生取代、加成、氧化反应
)能添加在牙膏、口香糖中以增强香气。下列关于G的说法错误的是( ) A、分子式为C11H14O B、一氯代物有8种(不考虑立体异构) C、所有碳原子可能在同一平面上 D、能发生取代、加成、氧化反应