-
1、某无色溶液中可能含有物质的量浓度均相同的以下离子中的若干种:、 , 为了确定该溶液的组成,进行如下实验:
①取上述溶液,加入过量溶液,反应后将沉淀过滤。洗涤、干燥,得白色沉淀。
②向沉淀中加入过量的盐酸,白色沉淀部分溶解并有气体生成,反应后过滤、洗涤、干燥,得白色沉淀。
下列说法错误的是( )
A、②中产生的气体一定是 B、溶液中一定不存在和 C、 D、该溶液的组成 -
2、将和的固体混合物溶于水得到500mL溶液,所得溶液用100mL1.5mol/L稀硫酸恰好完全中和。下列说法正确的是( )A、混合物与水反应在标准状况生成2.24L气体 B、混合物中有 C、混合物与水反应后所得溶液的物质的量浓度为0.6mol/L D、混合物中有
-
3、用下列装置或操作进行相应实验,能达到实验目的的是( )
选项
A
B
C
D
目的
等质量固体与足量盐酸反应,乙产生气泡快,反应后甲气球大
比较、的稳定性
探究氧化性:
用铁丝蘸取碳酸钾溶液进行焰色试验
装置或操作



 A、A B、B C、C D、D
A、A B、B C、C D、D -
4、城市污水中含有一定量的、 , 向污水中加入菌体和溶液,在菌体的作用下依次发生过程I、过程II,从而实现、的脱除,过程如图。下列说法正确的是( )
 A、“过程I”中为催化剂 B、的氧化性强于 C、“过程I”中和物质的量之比为1:1,则氧化剂与还原剂物质的量之比为1:4 D、“过程II”中发生反应的离子方程式为:
A、“过程I”中为催化剂 B、的氧化性强于 C、“过程I”中和物质的量之比为1:1,则氧化剂与还原剂物质的量之比为1:4 D、“过程II”中发生反应的离子方程式为: -
5、下列说法中不正确的有( )
①纳米材料的颗粒直径范围为1~100nm,所以纳米材料能产生丁达尔效应
②碳酸钠能与酸反应,因而可用它作膨松剂
③两种物质的物质的量相同,则它们在标准状况下的体积也相同
④强电解质的导电能力一定比弱电解质强
⑤根据O元素的非金属性强于S元素,可以判断的沸点高于
⑥镁铝合金密度小,强度高,可用于制造飞机和宇宙飞船
⑦金属铝遇到冷的浓硝酸发生钝化现象属于物理变化
A、4个 B、5个 C、6个 D、全部 -
6、用代表阿伏加德罗常数的数值。下列说法正确的是( )A、与反应转移电子数为 B、常温常压下,和混合气体中含有的原子总数为 C、500mL2mol/LHCl溶液中含有的HCl分子数为 D、中极性共价键数目为
-
7、下列离子方程式正确的是( )A、磁性氧化铁溶于稀硫酸: B、金属钠加入硫酸铜溶液中: C、溶液与少量溶液混合: D、将溶液与过量氨水混合:
-
8、下列有关元素周期表的说法中正确的是( )A、可在元素周期表中金属与非金属分界线处寻找耐高温、耐腐蚀的合金材料 B、第IIIB族元素种类最多,第IVA族元素形成化合物种类最多 C、第三周期非金属元素含氧酸的酸性从左到右依次增强 D、元素周期表中,VIIIB族包括第8、9、10三个纵列
-
9、下列各组物质的转化关系不能均由一步反应实现的是( )A、 B、 C、 D、
-
10、日本将福岛核污水排海引起了全世界强烈谴责,核污水中含有放射性氚、碘-131、铯-134、铯-137、碳-14等伤害性物质。下列叙述正确的是( )A、铯-134和铯-137核外电子数之差为3 B、碘-131核素所含中子数与质子数之差为25 C、氕、氘、氚三种核素都含有中子 D、碳-14和碳-12互为同素异形体
-
11、下列化学用语正确的是( )A、HClO的结构式:H-Cl-O B、分子结构模型:
 C、核外有a个电子,b个中子,M的原子符号为
D、熔融状态下的电离方程式:
C、核外有a个电子,b个中子,M的原子符号为
D、熔融状态下的电离方程式:
-
12、中国传统文化中蕴含着许多化学知识,下列说法错误的是( )A、“火树银花合,星桥铁锁开”,诗词中所涉及的焰色试验属于化学变化 B、“烟笼寒水月笼沙,夜泊秦淮近酒家”,雾属于气溶胶 C、《淮南万毕术》中记载,“曾青得铁则化为铜”,这种湿法炼铜属于置换反应 D、“古人以剂钢为刃,柔铁为茎干,不尔则多断折”里的“剂钢”的硬度比纯铁的大
-
13、乙烯的用途广泛,被誉为有机合成之母.以下是以乙烯为原料制备某化工原料中间体I的合成路线.

回答下列问题.
(1)、的反应类型为 .(2)、在D的同分异构体中,同时满足下列条件的共有种;①能与金属钠反应产生氢气;②在铜催化氧化的条件下,氧化产物能发生银镜反应.其中,核磁共振氢谱显示为3组峰,且峰面积比为的同分异构体的结构简式为 .
(3)、已知: , E与足量酸性溶液反应生成的有机物的结构简式为 . (4)、G的结构简式为 , 用系统命名法命名为 .(5)、在碱性条件下,反应的化学方程式为 .
, E与足量酸性溶液反应生成的有机物的结构简式为 . (4)、G的结构简式为 , 用系统命名法命名为 .(5)、在碱性条件下,反应的化学方程式为 . -
14、一种废镍催化剂回收镍、钴元素的工艺流程图如下,流程图中水浸液中含有 .

已知: .
回答下列问题.
(1)、球磨粉碎的作用是 .(2)、“氧化”中,混合气在金属离子的催化作用下,生成具有强氧化性的过一硫酸 , 其反应的化学方程式为 .(3)、“氧化”中,被过一硫酸氧化为沉淀,过一硫酸被还原为硫酸根离子,写出该反应的离子方程式:(已知的电离第一步完全,第二步微弱);用溶液调节 , 还有(写离子符号)也会形成沉淀而除去.(4)、“氧化”中保持空气通入速率不变,的氧化率与的体积分数的关系如图所示.的体积分数为9.0%时,的氧化率最大;当的体积分数大于9.0%时,继续增大的体积分数,的氧化率减小的原因可能是 . (5)、“沉钴镍”过程中为了将沉淀完全,需控制溶液的不低于(说明:当溶液中的浓度均小于时,认为已沉淀完全).(6)、铬、钴、镍都属于副族金属元素,其中铬与氮气在一定条件下可以合成氨化铬,且氮化铬的晶体结构及类型与氯化钠的相似,其晶胞结构如图所示.A点的分数坐标为 , 则B点的分数坐标为 . 已知氮化铬的晶胞参数为为阿伏加德罗常数,则该晶胞的密度为 .
(5)、“沉钴镍”过程中为了将沉淀完全,需控制溶液的不低于(说明:当溶液中的浓度均小于时,认为已沉淀完全).(6)、铬、钴、镍都属于副族金属元素,其中铬与氮气在一定条件下可以合成氨化铬,且氮化铬的晶体结构及类型与氯化钠的相似,其晶胞结构如图所示.A点的分数坐标为 , 则B点的分数坐标为 . 已知氮化铬的晶胞参数为为阿伏加德罗常数,则该晶胞的密度为 .
-
15、在催化下,加氢合成甲酸发生反应Ⅰ,同时还伴有反应Ⅱ发生.
Ⅰ.
Ⅱ.
回答下列问题.
(1)、已知:时,部分物质的相对能量如表所示,则的相对能量为 .物质
相对能量/
(2)、为了提高二氧化碳转化为甲酸的转化率,工业上常采用以下方法:步骤1 步骤2 步骤3
①写出步骤1反应的离子方程式: .
②其他条件不变,步骤1中转化为的转化率与温度的关系如图所示.

步骤1的转化率开始迅速上升,主要原因是 , 后又下降的可能原因是 .
③流程图步骤2中,加入乙醚的作用是 , 步骤3的分离方法是 .
(3)、保持、恒压,和的投料物质的量之比为的初始分压为 , 测得的转化率与时间t的关系如图所示.
已知平衡后,测得 , 则反应Ⅰ的(用含的式子表示).
-
16、环己酮是无色油状液体,时在水中的溶解度为 . 实验室由环己醇制备环己酮.
【实验原理】
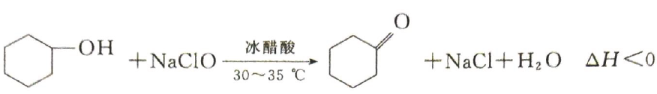 .
. 【装置示意图】

【实验步骤】Ⅰ.烧瓶中依次加入环已醇和冰醋酸,开动磁力搅拌器.在冰水浴冷却下,逐滴加入次氯酸钠溶液至稍过量.
Ⅱ.在室温下继续搅拌 , 然后加入饱和亚硫酸氢钠溶液.
Ⅲ.在反应混合物中加入水、氯化铝,去掉仪器X,换成蒸馏装置,加热蒸馏,至馏出液无油珠滴出为止.
Ⅳ.在搅拌情况下向馏出液中加入无水碳酸钠至中性,然后再加入精制食盐使之饱和,将此液体倒入分液漏斗,分出有机层.
Ⅴ.向有机层中加入无水 , 静置,过滤,对滤液进行蒸馏,得到产品 .
回答下列问题.
(1)、仪器X的名称为 .(2)、步骤Ⅰ中,加入冰醋酸除作为溶剂外,还有的作用是 .用淀粉碘化钾试纸可检验反应后的液体,如果试纸变色,说明次氯酸钠过量.
(3)、步骤Ⅰ中,次氯酸钠溶液要在冰水浴冷却下逐滴加入,勿使氧化反应进行得过于猛烈而升温过高,否则产物环己酮将进一步被氧化而发生碳链断裂.在次氯酸钠的不同滴加速度下,在冰水浴存在的情况下,溶液温度随滴加时间变化曲线如右图,为了控制好反应温度,应选择的滴速为滴/ .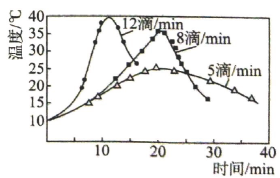 (4)、在步骤Ⅱ中,加入适量亚硫酸氢钠溶液的目的是(用离子方程式表示) .(5)、在步骤Ⅳ中,加入精制食盐的目的是 .(6)、在步骤Ⅴ中,加入无水的作用为 .(7)、产品的产率为(精确至0.1%).
(4)、在步骤Ⅱ中,加入适量亚硫酸氢钠溶液的目的是(用离子方程式表示) .(5)、在步骤Ⅳ中,加入精制食盐的目的是 .(6)、在步骤Ⅴ中,加入无水的作用为 .(7)、产品的产率为(精确至0.1%). -
17、是一种强还原性的高能物质,在航天、能源等领域有广泛应用.我国科学家合成的某催化剂(用表示)能高效电催化氧化合成 , 其反应机理如图所示.下列说法正确的是( )
 A、催化剂降低该反应的活化能,大大缩短达到化学平衡所需的时间 B、中氮原子上有孤电子对 C、该过程的总反应式为 D、由于中存在非极性共价键,所以易溶于水
A、催化剂降低该反应的活化能,大大缩短达到化学平衡所需的时间 B、中氮原子上有孤电子对 C、该过程的总反应式为 D、由于中存在非极性共价键,所以易溶于水 -
18、催化氧化法将转化为的反应为 . 下列关于催化氧化法制的说法中错误的是( )A、该反应的 B、该反应的平衡常数 C、使用合适的催化剂可提高化学反应速率,但不影响的平衡转化率 D、该反应在高温下可自发进行
-
19、室温下,某实验兴趣小组用溶液标定某盐酸浓度,用甲基橙作指示剂,滴定曲线如图丁所示.下列说法正确的是( )
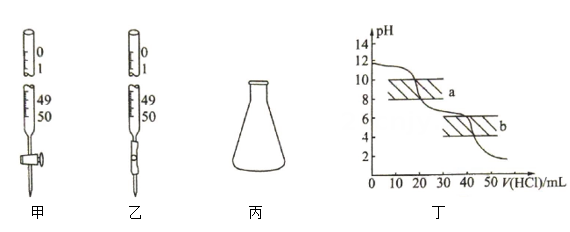 A、滴定中溶液应该盛放在乙仪器中 B、读数时,应双手一上一下持滴定管 C、标准溶液吸收了空气中的 , 会使测得的盐酸浓度偏大 D、滴定终点在b区域
A、滴定中溶液应该盛放在乙仪器中 B、读数时,应双手一上一下持滴定管 C、标准溶液吸收了空气中的 , 会使测得的盐酸浓度偏大 D、滴定终点在b区域 -
20、价层电子对互斥理论可以预测某些微粒的空间结构.下列说法正确的是( )A、和的空间结构相同 B、的键角小于的键角 C、和均为非极性分子 D、与的中心原子的杂化方式不同