-
1、已知三氯化六氨合钴[Co(NH3)6]Cl3为橙黄色晶体,易溶于热水,在冷水中微溶,可在氯化铵和氨水的混合溶液中活性炭做催化剂条件下,利用双氧水氧化CoCl2制备。

I.制备产品,步骤如下:
①称取2.0gNH4Cl固体,用5mL水溶解,加到锥形瓶中。
②分批加入3.0 g CoCl2·6H2O后,将溶液温度降至10℃以下,加入1g活性炭、7mL浓氨水,搅拌下逐滴加入10mL6%的双氧水。
③加热至55-60℃反应20min,冷却,过滤。
④将滤得的黑黄固体转入含有少量盐酸的25mL沸水中,趁热过滤。
⑤滤液转入烧杯,加入4mL浓盐酸,冷却、过滤、干燥,得到橙黄色晶体。
回答下列问题:
(1)、写出制备[Co(NH3)6]Cl3的化学方程式。(2)、步骤②中,将温度降至10℃以下的原因是。(3)、步骤③中反应装置部分仪器如上图(其中加持仪器路去),不包括过滤还需要的玻璃仪器名称为 , 仪器A的名称为 , 仪器B的作用是。(4)、步骤④中趁热过滤的目的是。(5)、Ⅱ.测定产品纯度,实验如下:①称取ag产品溶于足量稀硝酸中,并用蒸馏水稀释,置于锥形瓶中,加入过量V1mLc1mol·L-1AgNO3溶液,并加3mL的硝基苯用力振荡。
②向锥形瓶中滴入3滴Fe(NO3)3溶液为指示剂,用c2 mol·L-1 KSCN溶液滴定过量的AgNO3溶液,达到滴定终点时用去V2mL溶液。(已知: , )
回答下列问题:
产品的质量分数为。(列出计算式)
(6)、加入硝基苯的目的是。 -
2、溶洞水体中的H2CO3与空气中的CO2保持平衡。现测得溶洞水体中lgc(X)X为H2CO3、HCO3-、CO32-或Ca2+)与pH的关系如图所示,。下列说法错误的是( )
 A、曲线Ⅱ代表lgc()与pH的关系 B、溶洞水体中存在关系式: C、a点溶液中,c(Ca2+)=0.28molL-1 D、
A、曲线Ⅱ代表lgc()与pH的关系 B、溶洞水体中存在关系式: C、a点溶液中,c(Ca2+)=0.28molL-1 D、 -
3、电解苯酚的乙腈(CH3CN)水溶液可在电极上直接合成扑热息痛(
 ),电极材料均为石墨。下列说法错误的是( )
),电极材料均为石墨。下列说法错误的是( ) A、电极d为阴极 B、装置工作时,乙室溶液pH增大 C、电极c的电极反应式为
A、电极d为阴极 B、装置工作时,乙室溶液pH增大 C、电极c的电极反应式为
 +2H+
D、合成1mol扑热息痛,理论上甲室质量增重96g
+2H+
D、合成1mol扑热息痛,理论上甲室质量增重96g
-
4、T0时,向容积为5L的恒容密闭容器中充入一定量的A(g)和B(g),发生反应:△H<0。反应过程中的部分数据如下表,下列说法错误的是( )
t/min
n(A)/mol
n(B)/mol
0
4.0
2.0
5
2.0
1.0
10
2.0
1.0
A、其他条件不变,温度变为T1时,平衡时测得C的浓度为0.8mol/L,则T1>T0 B、8min时,该反应的(正)=(逆) C、平衡时,D的体积分数约为14.3% D、5min时,向该容器中再充入4.0molA和2.0molB,达新平衡后,B的百分含量变大 -
5、2022年诺贝尔化学奖授予了三位研究点击化学的科学家。Cu+催化的叠氮化物-炔烃环加成和催化剂CuCl的晶体结构如图所示。下列说法正确的是( )
 A、晶胞结构中,Cu+的配位数为8 B、基态Cu的价层电子排布式为3d94s2 C、叠氮化物-炔烃环加成反应只有σ键的断裂与形成 D、若晶体的密度为dg/cm3 , 则晶胞参数
A、晶胞结构中,Cu+的配位数为8 B、基态Cu的价层电子排布式为3d94s2 C、叠氮化物-炔烃环加成反应只有σ键的断裂与形成 D、若晶体的密度为dg/cm3 , 则晶胞参数 -
6、白硼钙石的主要成分是Ca4B10O19·7H2O(含有少量Fe2O3、FeO、CaCO3和SiO2等杂质),利用白硼钙石制取强还原剂NaBH4的工艺流程如下:

已知H3BO3微溶于水,易溶于乙醇:偏硼酸钠(NaBO2)易溶于水,溶解度随温度升高而增大,难溶于乙醇,碱性条件下稳定。下列说法错误的是( )
A、“滤渣1”的主要成分是SiO2 B、“气体”的主要成分是NO2 C、“操作X”涉及到蒸发浓缩、降温结晶 D、“反应Y”的化学方程式是 -
7、下列方案或操作能达到实验目的是( )
A
B
C
D
实验室制氯气
证明非金属性:Cl>C
验证Ksp(AgCl)>Ksp(AgI)
检验淀粉是否完全水解
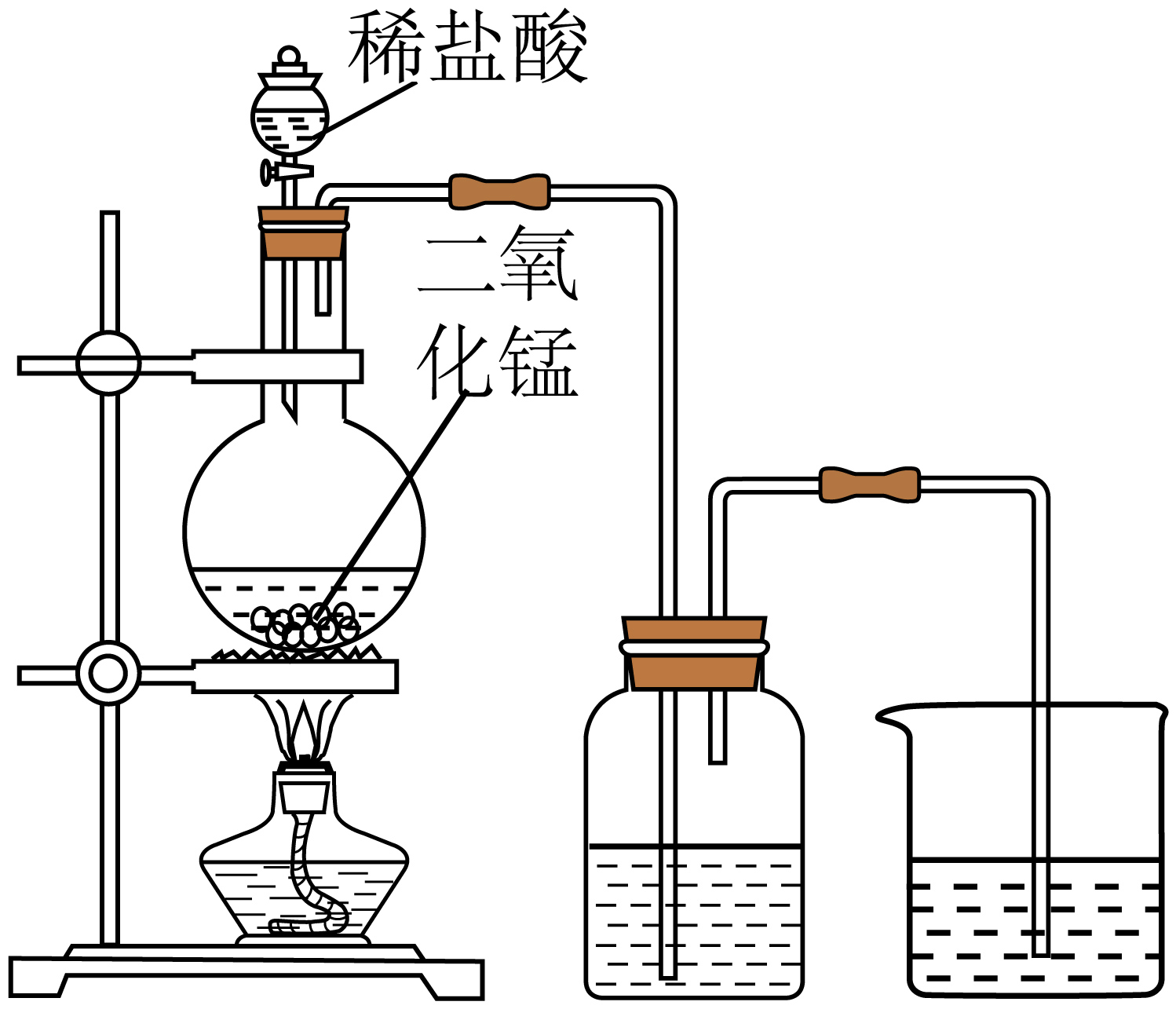
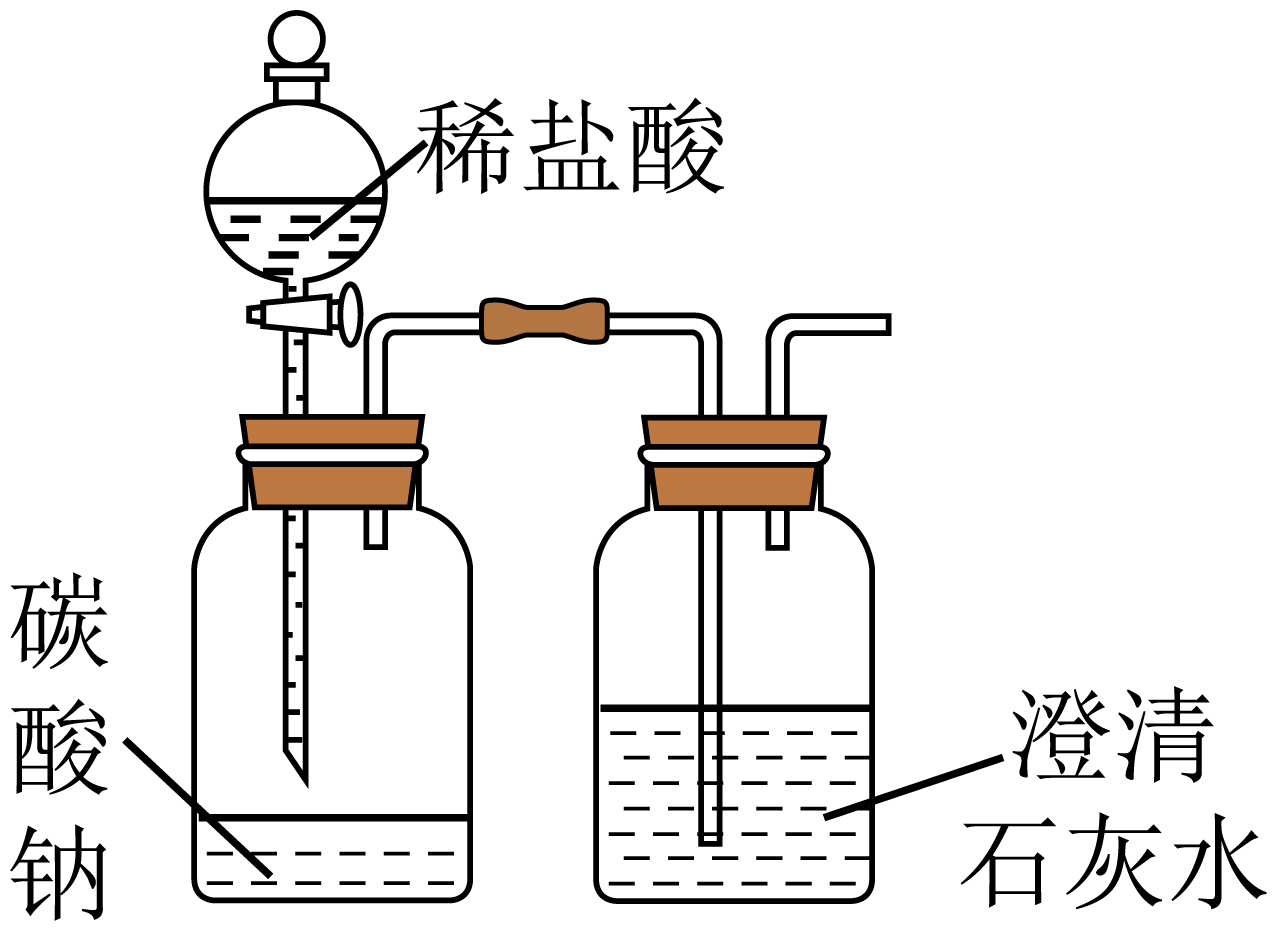
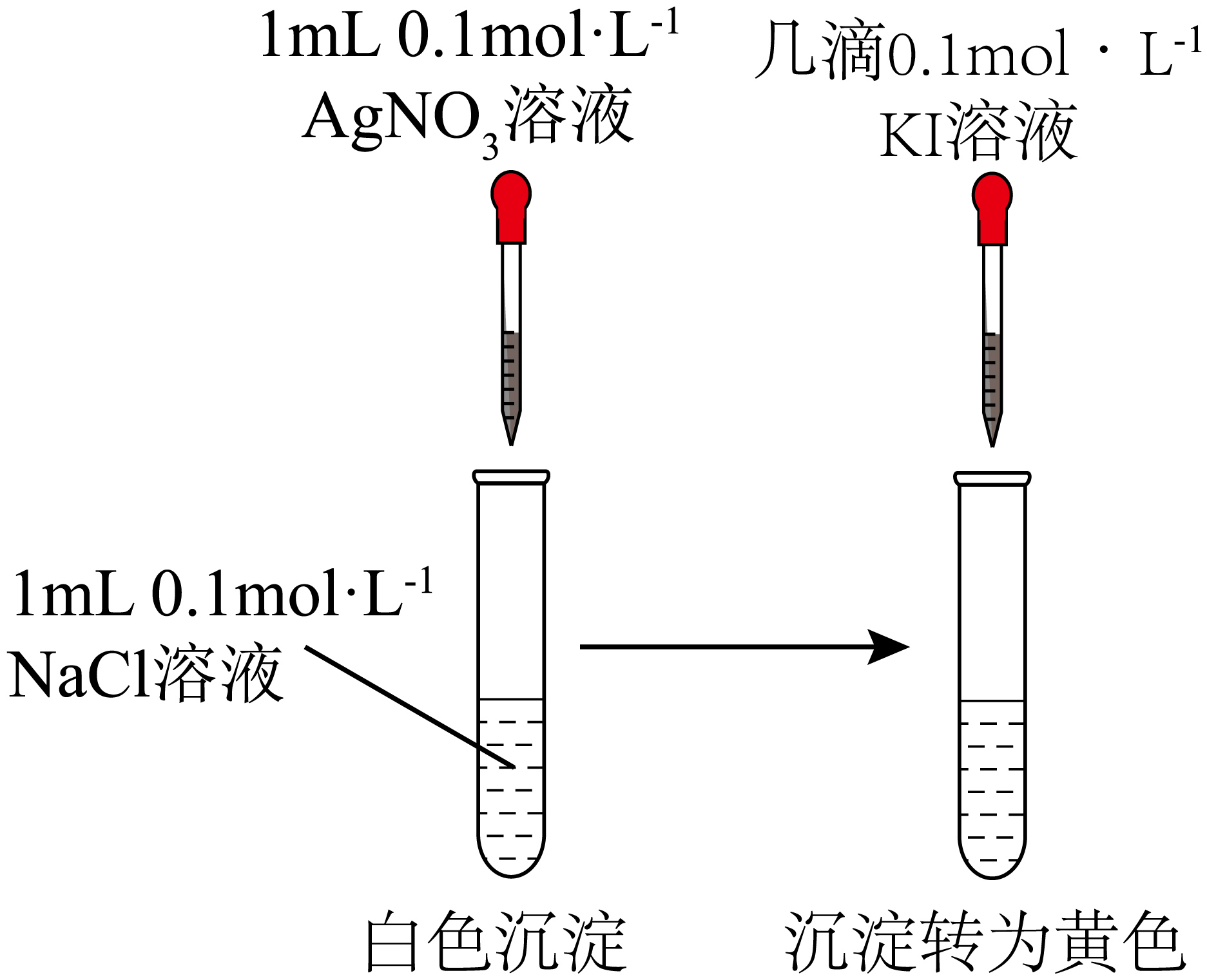
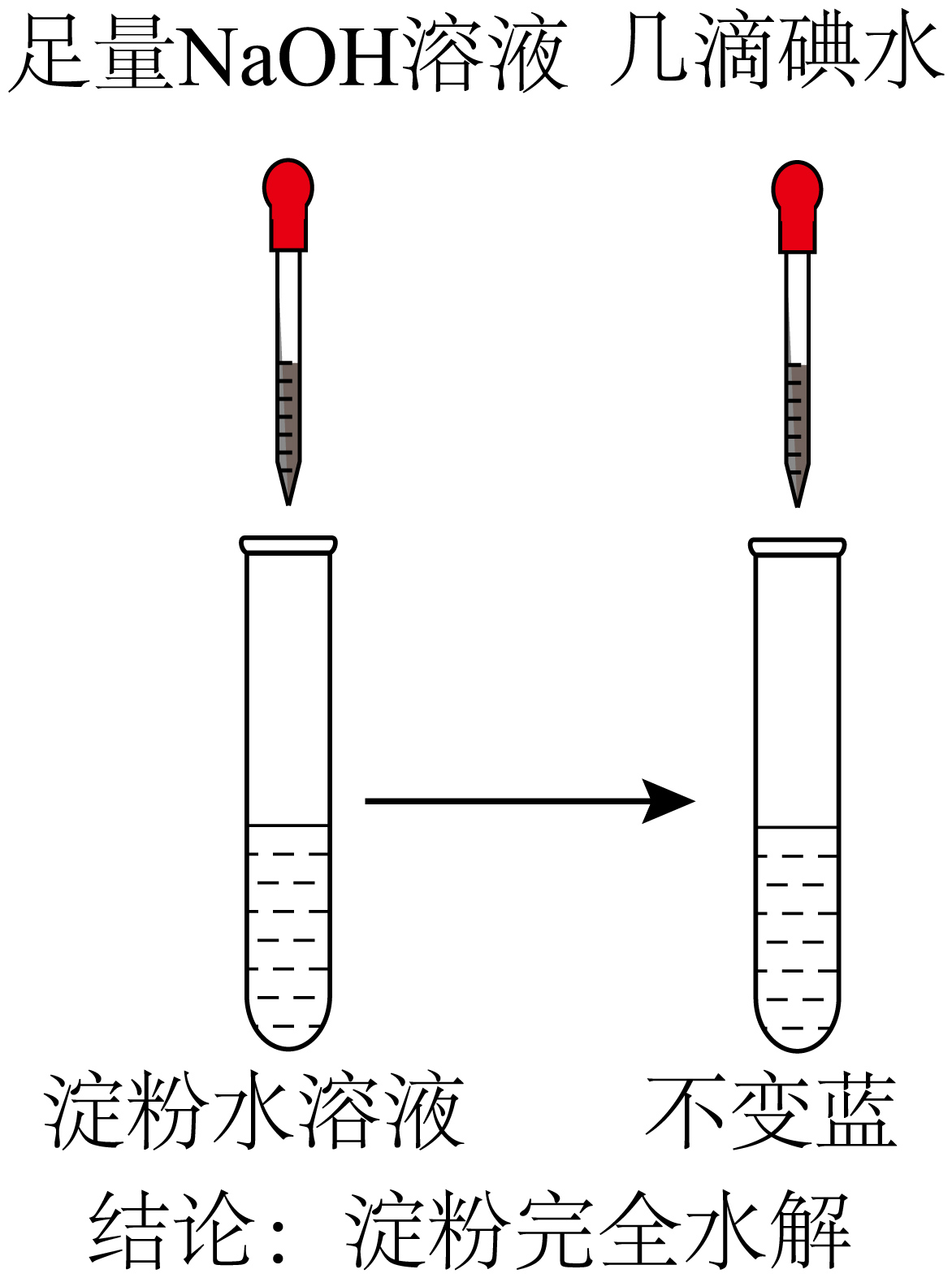 A、A B、B C、C D、D
A、A B、B C、C D、D -
8、M、X、Y、Z、W均为短周期元素,原子序数依次减小,能形成如下图所示化合物,下列说法正确的是( )
 A、第一电离能:M>Y>X>Z B、简单氢化物的稳定性:X>Y C、X与W形成的化合物不能使酸性KMnO4溶液褪色 D、由M、X、Z、W四种元素组成的化合物其水溶液显碱性
A、第一电离能:M>Y>X>Z B、简单氢化物的稳定性:X>Y C、X与W形成的化合物不能使酸性KMnO4溶液褪色 D、由M、X、Z、W四种元素组成的化合物其水溶液显碱性 -
9、物质结构决定物质性质。下列性质差异与结构因素匹配错误的是( )
选项
性质差异
结构因素
A
沸点:乙醇(78.3℃)高于二甲醚(-29.5℃)
氢键作用
B
熔点:AlF3(1040℃)远高于AlCl3(178℃升华)
晶体类型
C
键角:PF3(94°)小于PCl3(109.5°)
电负性差异
D
分解温度:HBr(500℃)高于HI(300℃)
范德华力作用
A、A B、B C、C D、D -
10、下列说法错误的是( )A、SO2和CO2的价层电子对互斥模型相同 B、NH3和CH4的中心原子杂化方式相同 C、C2H6和C2H4的化学键类型不同,可用溴水除去C2H6中混有的C2H4 D、水和苯分子极性不同,可用分液法分离
-
11、克拉维酸钾是一种β-内酰胺类抗生素,下列说法错误的是( )
 A、克拉维酸钾存在顺反异构 B、克拉维酸分子含有5种官能团 C、上述转化中的二者均能使酸性KMnO4溶液褪色 D、实现上述转化可加入KOH溶液
A、克拉维酸钾存在顺反异构 B、克拉维酸分子含有5种官能团 C、上述转化中的二者均能使酸性KMnO4溶液褪色 D、实现上述转化可加入KOH溶液 -
12、NA是阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,11.2L氯仿含有氯原子1.5NA B、31g白磷中共价键数目为3NA C、0.1mol.L-1K2Cr2O7酸性溶液中含0.1NA的Cr2O D、4.4gC2H4O中含有σ键最多为0.7NA
-
13、下列试剂的保存方法错误的是( )A、氢氟酸通常保存在塑料瓶中 B、液溴应水封保存,并用橡胶塞塞紧瓶口 C、双氧水可以保存在棕色细口瓶中 D、FeCl2溶液保存时需加入少量铁粉
-
14、高分子化合物在人类生产生活中有着重要用途。下列说法正确的是( )A、酚醛树脂通常由苯酚和甲醛通过缩聚反应合成 B、淀粉和纤维素均表示为(C6H10O5)n,二者互为同分异构体 C、塑料、橡胶、合成纤维均为合成高分子材料 D、医用口罩主要原料是聚丙烯,与聚乙烯互为同系物
-
15、化学与科学、技术、社会、环境密切相关,下列说法错误的是( )A、神舟系列飞船返回舱使用氮化硅耐高温材料,Si3N4属于共价晶体 B、月壤中的“嫦娥石[(Ca8Y)Fe(PO4)7]”,该成分是无机盐 C、利用CO2合成了脂肪酸,实现了无机小分子向有机高分子的转变 D、《本草纲目》中“以芒硝于风日中消尽水气”得到的是Na2SO4
-
16、化合物
 是合成药物Tazverik的中间体,在医药工业中的一种合成方法如下:
是合成药物Tazverik的中间体,在医药工业中的一种合成方法如下:
回答下列问题:
(1)、A为苯的同系物,其化学名称为。(2)、B中的官能团名称是。(3)、反应①、④的反应类型分别为、。(4)、反应②的化学方程式为。(5)、在 的同分异构体中,同时满足下列条件的化合物共有种(不考虑立体异构),其中苯环上仅有两种不同化学环境的氢原子的结构简式为。
的同分异构体中,同时满足下列条件的化合物共有种(不考虑立体异构),其中苯环上仅有两种不同化学环境的氢原子的结构简式为。①属于芳香族化合物;
②苯环上连有两个取代基,其中一个取代基为;
③能发生水解反应和银镜反应。
(6)、化合物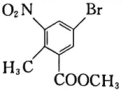 中,溴原子与碳原子形成键(填写轨道重叠方式)。 (7)、已知:苯环上连有羟基时再引入其他基团,其他基团主要进人它的邻位或对位;苯环上连有羧基时再引入其他基团,其他基团主要进入它的间位。设计由甲苯和制备
中,溴原子与碳原子形成键(填写轨道重叠方式)。 (7)、已知:苯环上连有羟基时再引入其他基团,其他基团主要进人它的邻位或对位;苯环上连有羧基时再引入其他基团,其他基团主要进入它的间位。设计由甲苯和制备 的合成路线:(其他试剂任选)。
的合成路线:(其他试剂任选)。 -
17、是典型的温室气体,Sabatier反应可实现转化为甲烷,实现的资源化利用。合成过程中涉及如下反应:
甲烷化反应(主反应):
逆变换反应(副反应):
回答下列问题:
(1)、Sabatier反应所需的可从工业尾气中捕获,下列不能作为捕获剂的是____(填标号)。A、氯化钙溶液 B、小苏打溶液 C、硫酸铵溶液 D、纯碱溶液(2)、已知:的燃烧热分别为转化为吸收的热量。甲烷化反应的。(3)、已知:的选择性。科研小组按进行投料,从以下三个角度探究影响选择性的因素。
①若在恒温恒压容器中进行反应,反应达到平衡,二氧化碳的平衡转化率为 , 甲烷的选择性为 , 则逆变换反应的(保留两位小数)。从反应开始到平衡用的压强变化表示的平均反应速率为 (写出计算式)。
②若在恒容容器中进行反应(初始压强为),平衡时各气体的物质的量分数随温度变化的曲线如图所示。图中表示的物质的量分数随温度变化的曲线是(填“曲线1”“曲线2”或“曲线3”)。曲线1和曲线3交叉点处的平衡分压为(计算该空时忽略逆变换反应)。

③积碳会使催化剂的活性降低,从而影响甲烷的选择性,各积碳反应的平衡常数与温度关系如下表所示:
温度
800
21.60
0.136
0.133
850
33.94
0.058
0.067
900
51.38
0.027
0.036
由表中数据可知,积碳反应主要由反应引起(填化学方程式),该反应的0(填“>”或“<”)。
-
18、氯化亚铜是常用的催化剂,为白色晶体,不溶于乙醇,微溶于水,在潮湿的空气中迅速被氧化成碱式盐。工业上用含铜化工原料铜矿砂(主要成分为及少量铁的硫化物等)来生产氯化亚铜(如图所示)。回答下列问题:
 (1)、铜矿砂在焙烧前,要进行粉碎处理,目的是。(2)、向焙烧后所得固体中加入硫酸溶液进行酸浸,然后氧化、调除杂、过滤,得到纯净的硫酸铜溶液。其中氧化、调除杂的试剂分别可以是、(均填化学式)。(3)、取一定量硫酸铜溶液于烧杯中,向其中加入晶体,并将其放在磁力搅拌器上。然后用仪器A称量和 , 并向仪器A中加入蒸馏水,搅拌,使其溶解,将溶液转移至仪器B中,边搅拌边滴加和的混合溶液(如图所示)。仪器A、仪器B的名称分别为、。加入的作用是。
(1)、铜矿砂在焙烧前,要进行粉碎处理,目的是。(2)、向焙烧后所得固体中加入硫酸溶液进行酸浸,然后氧化、调除杂、过滤,得到纯净的硫酸铜溶液。其中氧化、调除杂的试剂分别可以是、(均填化学式)。(3)、取一定量硫酸铜溶液于烧杯中,向其中加入晶体,并将其放在磁力搅拌器上。然后用仪器A称量和 , 并向仪器A中加入蒸馏水,搅拌,使其溶解,将溶液转移至仪器B中,边搅拌边滴加和的混合溶液(如图所示)。仪器A、仪器B的名称分别为、。加入的作用是。 (4)、配制和的混合溶液时,加入的作用是。反应环境尽可能维持在弱碱性或中性条件,否则会发生副反应生成 , 发生副反应的离子方程式为。(5)、滴加完成后,继续搅拌 , 减压过滤分离,用无水乙醇洗涤沉淀,干燥,称量。
(4)、配制和的混合溶液时,加入的作用是。反应环境尽可能维持在弱碱性或中性条件,否则会发生副反应生成 , 发生副反应的离子方程式为。(5)、滴加完成后,继续搅拌 , 减压过滤分离,用无水乙醇洗涤沉淀,干燥,称量。①检验沉淀已洗涤干净的方法是。
②干燥需要在真空干燥箱中进行,不能在潮湿的空气中进行,原因是。
③称取产品和过量的溶液于锥形瓶中,不断摇动,待固体完全溶解后,用的标准溶液滴定至终点,平行滴定三次,消耗标准溶液分别为。相关反应如下:。则产品中的纯度为(保留三位有效数字)。
-
19、稀土元素被誉为“现代工业的维生素”和“21世纪新材料宝库”,广泛应用于新材料、冶金化工、电子信息、节能环保等领域,由普通级氯化镧料液制备高纯氧化铜的新工艺流程如图所示。

已知:淋洗液太高,EDTA和会结晶沉淀。
回答下列问题:
(1)、普通级氯化镧料液中通过树脂时,在树脂吸附柱上发生反应生成被吸附在树脂内部,反应的离子方程式为。(2)、经氨水处理过的淋洗液,再经淋洗,发生反应 , 淋洗液的对分离效率的影响如图所示。则淋洗时,淋洗液的应调到。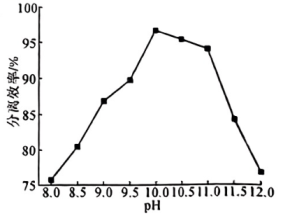 (3)、淋洗液的时,分离效率就迅速下降,原因是。(4)、用草酸溶液将中的沉淀出来,最后进行高温焙烧。在空气中高温焙烧 , 若空气中氧气的体积分数为 , 测消耗的空气与高温焙烧生成的的物质的量之比为。(5)、锶镧铜氧化物超导体的晶胞结构(底面是正方形的长方体)如图所示,晶胞中锶原子与镧原子的个数比为 , 体心与顶点的原子有着相同的化学环境,原子1的分数坐标为。则该超导体的化学式为 , 原子2的分数坐标为 , 体心原子与原子之间的最近距离为(列出含a、c的计算式)。
(3)、淋洗液的时,分离效率就迅速下降,原因是。(4)、用草酸溶液将中的沉淀出来,最后进行高温焙烧。在空气中高温焙烧 , 若空气中氧气的体积分数为 , 测消耗的空气与高温焙烧生成的的物质的量之比为。(5)、锶镧铜氧化物超导体的晶胞结构(底面是正方形的长方体)如图所示,晶胞中锶原子与镧原子的个数比为 , 体心与顶点的原子有着相同的化学环境,原子1的分数坐标为。则该超导体的化学式为 , 原子2的分数坐标为 , 体心原子与原子之间的最近距离为(列出含a、c的计算式)。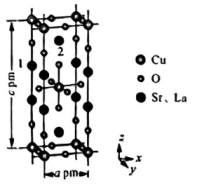
-
20、室温下,向和的混合溶液中逐滴加入溶液或溶液,溶液中或与的变化关系如图所示。

已知:①
②
下列说法正确的是( )
A、曲线N代表与的变化关系 B、a、b点溶液的相等,c、d点溶液中的之比为 C、b点溶液(为溶液中滴入的金属离子)中, D、a点点、b点点的变化过程中,溶液中均逐渐减小