-
1、苯胺(有机碱,常温下为无色油状液体,易被氧化)在染料、医药、农药、香料等领域有广泛的应用。实验室以硝基苯为原料制备苯胺,反应原理如下:

相关信息列表如下:
物质
相对分子质量
沸点/℃
密度g/mL
溶解性
硝基苯
123
210.9
123
不溶于水,易溶于乙醇、乙醚
苯胺
93
184.4
1.02
微溶于水,易溶于乙醇、乙醚
甲苯
92
110.6
0.872
略
实验步骤为:
①组装好实验装置(如图,部分夹持仪器已略去),并检查装置气密性。
②向三颈烧瓶中依次加入沸石及10mL硝基苯。
③打开活塞K,先通入H2一段时间。
④使三颈烧瓶内溶液保持140℃恒温,充分反应。
⑤反应结束后,关闭活塞K,向三颈烧瓶中加入干燥剂。
⑥继续加热,收集182~186℃馏分,将所得馏分进行二次纯化,最终得到较纯苯胺5.6g。
回答下列问题:
 (1)、仪器a的名称是。(2)、长颈漏斗内的试剂最好选用。
(1)、仪器a的名称是。(2)、长颈漏斗内的试剂最好选用。a.稀盐酸 b.稀硝酸 c.稀硫酸
(3)、A装置是一个简易启普发生器,其优点是 , 若实验中未先通入H2一段时间,则可能产生的不良后果是。(4)、步骤⑤中干燥剂可选用。a.浓硫酸 b.碱石灰 c.无水硫酸镁 d.五氧化二磷
(5)、二次纯化并测定产率:蒸馏所得苯胺中混有少量硝基苯杂质,可以采用如下方案除杂提纯:

加入试剂X后发生反应的离子方程式为 , “液相”是(填“水层”或“有机层”)。
(6)、苯胺与甲苯相对分子质量相近,但沸点相差较大,试从物质结构的角度说明原因。(7)、本实验的产率为(保留一位小数)。 -
2、是一种难溶于水、可溶于酸的盐,工业上常用固体除去工业废水中的。常温下,向一定体积的工业废水中加入固体,溶液中 , 表示或与的关系如图所示的电离常数 , 下列说法错误的是( )
 A、曲线II表示与变化关系 B、的溶度积常数 C、时,溶液中 D、反应的平衡常数的值为
A、曲线II表示与变化关系 B、的溶度积常数 C、时,溶液中 D、反应的平衡常数的值为 -
3、我国科学家在嫦娥五号月壤样品中发现一种新矿物“嫦娥石”,其中含有原子序数依次增大的短周期主族元素X、Y、Z、R。X在地壳中含量最多,Y的电子层数是其最外层电子数的3倍,基态Z原子无未成对电子,基态R原子的p轨道半充满。下列说法错误的是( )A、Y的简单离子半径比Z的简单离子半径大 B、R的简单氢化物的VSEPR模型为三角锥形 C、Z的第一电离能大于同周期相邻元素 D、X、R的简单氢化物的稳定性前者强于后者
-
4、钛被称为21世纪金属,是卫星、火箭、宇宙飞船等高科技领域的重要材料,目前制备纯钛的新型工艺是“熔盐直接电解脱氧法”,其工作原理如下图所示,下列说法正确的是( )
 A、石墨作阳极,电极反应为 B、产生22.4LCO2(标准状况)气体时理论上可以制得2mol金属Ti C、Cr-Al电热棒上的电势高于石墨电极上的电势 D、若用铅蓄电池作该装置的电源,a为Pb电极
A、石墨作阳极,电极反应为 B、产生22.4LCO2(标准状况)气体时理论上可以制得2mol金属Ti C、Cr-Al电热棒上的电势高于石墨电极上的电势 D、若用铅蓄电池作该装置的电源,a为Pb电极 -
5、下列实验操作、现象及得出的结论均正确的是( )
选项
实验
现象
结论
A
向两份等体积等浓度的新制氯水中,分别滴加AgNO3溶液和淀粉KI溶液
前者产生白色沉淀,后者溶液变为蓝色
氯气与水的反应存在限度
B
将苯与液溴在催化剂作用下产生的气体通入硝酸银溶液中
产生淡黄色沉淀
苯和液溴发生取代反应
C
向1mL0.01mol·L-1MgCl2溶液中滴入2滴0.01mol·L-1NaOH溶液,产生白色沉淀,再滴入2滴0.01mol·L-1CuSO4溶液
白色沉淀逐渐变为蓝色沉淀
Ksp[Cu(OH)2]<Ksp[Mg(OH)2]
D
向溶有SO2的CaCl2溶液中通入气体X
产生白色沉淀
X一定具有强氧化性
A、A B、B C、C D、D -
6、降解聚碳酸酯(PC)回收双酚A(BPA)的工艺过程,存在如下反应:
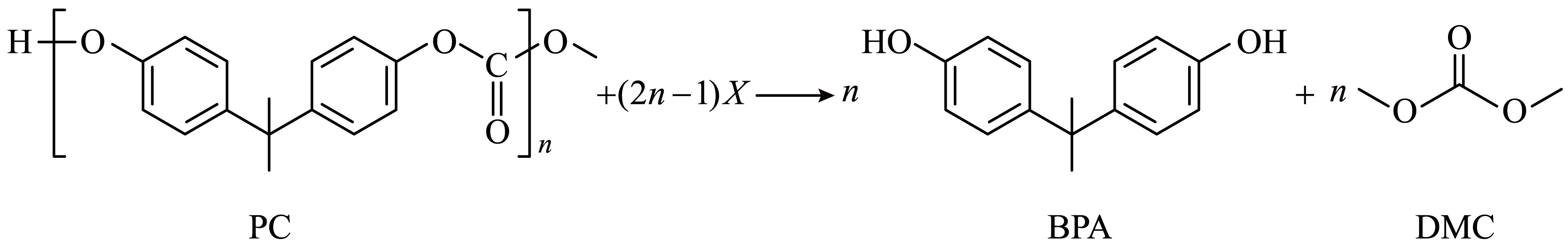
下列说法错误的是( )
A、PC可以发生水解反应和氧化反应 B、反应物X为CH3OH C、BPA中不可能所有碳原子共面 D、DMC分子中碳、氧原子杂化类型均为sp3 -
7、设NA为阿伏加德罗常数的值。下列说法正确的是( )
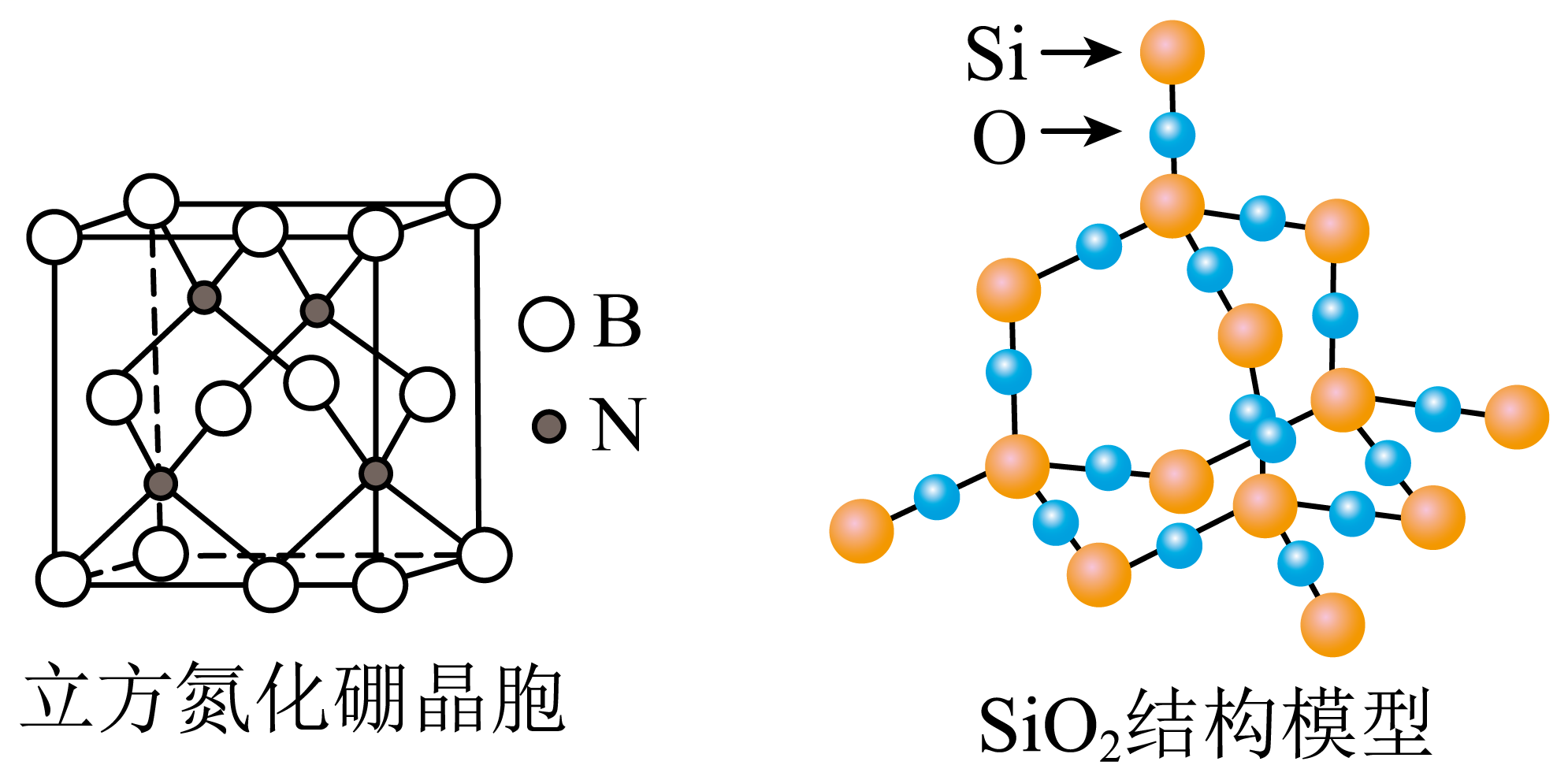 A、10g立方氮化硼晶体所含原子数目为0.8NA B、常温下,pH=12的Na2S溶液中OH-数目为0.01NA C、含4molSi-O键的SiO2晶体中氧原子数目为NA D、标准状况下,22.4LNO2的分子数目为NA
A、10g立方氮化硼晶体所含原子数目为0.8NA B、常温下,pH=12的Na2S溶液中OH-数目为0.01NA C、含4molSi-O键的SiO2晶体中氧原子数目为NA D、标准状况下,22.4LNO2的分子数目为NA -
8、化学与社会和生活密切相关。下列说法错误的是( )A、红色油漆中所用铁红的成分为Fe2O3 B、干冰可用在影视剧及戏剧舞台上制造“云雾” C、“墨子号”量子通信的载体-光纤的主要成分为单晶硅 D、2023年杭州亚运会主火炬燃料零增碳甲醇属于可再生能源
-
9、化合物H是一种抗艾滋病药物,某课题组设计的合成路线如下:

请回答下列问题:
(1)、写出有机物A的名称。(2)、过程A→B的作用是。(3)、写出在一定条件下,B与足量NaOH溶液反应的化学方程式。(4)、化合物D的结构简式是。(5)、下列说法错误的是(填标号)。a.E分子中碳原子的杂化方式有3种
b.合成H过程中涉及的反应类型均为取代反应
c.F与足量H2加成后,产物分子中含有4个手性碳原子
d.化合物G可以与水形成分子间氢键,易溶于水
(6)、化合物N( )是另一种合成路线的中间体,化合物N符合下列条件的同分异构体有种,写出其中一种结构简式。
)是另一种合成路线的中间体,化合物N符合下列条件的同分异构体有种,写出其中一种结构简式。①含有苯环;②H-NMR谱显示有6种不同化学环境的氢原子;③能发生水解反应,产物之一是甘氨酸。
-
10、甲醇用途广泛,可用作溶剂、防冻剂、燃料,也可用于生产生物柴油,利用合成气(主要成分为CO、CO2和H2)可以合成甲醇,涉及的反应如下,回答下列问题:
反应ⅰ:CO(g)+2H2(g)CH3OH(g) △H1=−91.5kJ∙mol−1
反应ii:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H2=−49.9kJ∙mol−1
反应iii:CO2(g)+H2(g)CO(g)+H2O(g) △H3=+41.6kJ∙mol−1
(1)、在某催化剂作用下,反应ⅰ的反应历程如图所示(图中数据表示微粒数目以及微粒的相对总能量,*表示吸附在催化剂上):
①CO2的电子式为。
②结合反应历程,写出反应ⅰ中生成甲醇的决速步骤的反应方程式。
③m=(计算结果保留两位有效数字,已知1eV=1.6×10−22kJ)。
(2)、反应ⅰ的Arrhenius经验公式Rlnk=−+C(Ea为活化能,k为速率常数,R和C均为常数,T为温度),实验数据如图中曲线M所示。当改变外界条件时,实验数据如图中曲线N所示,则实验可能改变的外界条件是。 (3)、将一定量的CO2(g)和H2(g)充入密闭容器中并加入合适的催化剂,只发生反应ii和iii.在相同温度不同压强下测得CO2的平衡转化率、CH3OH(g)的选择性和CO的选择性随压强变化曲线如图所示。
(3)、将一定量的CO2(g)和H2(g)充入密闭容器中并加入合适的催化剂,只发生反应ii和iii.在相同温度不同压强下测得CO2的平衡转化率、CH3OH(g)的选择性和CO的选择性随压强变化曲线如图所示。
①图中表示CH3OH的选择性的曲线是(填“m”“n”或“p”),简述判断方法。

②反应体系中组分CO2(g)、CO(g)的浓度随时间变化情况如图所示。0~15s时间段内,CH3OH的平均反应速率为mol·L−1·s−1(保留两位有效数字)。
-
11、黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的铝硅酸盐,以及SiO2、Fe3O4.黏土钒矿采用以下工艺流程可制备偏钒酸铵(NH4VO3)。

已知:①该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示;
金属离子
Fe3+
Al3+
Mn2+
Mg2+
开始沉淀pH
1.9
3.0
8.1
8.9
完全沉淀pH
3.0
4.7
10.1
10.9
②钒元素的存在形态较多,部分四价钒和五价钒物种的分布分数δ与pH的关系如图所示,

回答下列问题:
(1)、NH4+的VSEPR模型是形。(2)、“酸浸氧化”时,VO+、VO2+被氧化为VO2+ , 增大“酸浸氧化”速率的措施是(任写一种)。(3)、“中和沉淀”时,滤饼②含有的沉淀有V2O5·xH2O以及。(4)、“沉淀转溶”时,V2O5·xH2O转化为钒酸盐溶解。滤液③中含有的阴离子有OH−以及。(5)、①“沉钒”时pH最好约为7且NH4Cl应过量,原因为。②温度高于80℃时,沉钒率下降的原因是(任写一种)。
(6)、加热偏钒酸铵制备V2O5的化学方程式为。 -
12、四碘化锡(SnI4)为橙红色晶体,广泛应用于黑磷烯材料的制备。实验室常以锡粒为原料通过反应制备SnI4 , 实验装置如图(加热及夹持装置略,物质部分性质如下表)。
物质
熔点/℃
沸点/℃
溶解性
性质
SnI4
145.8
364.5
易溶于乙醚、可溶于CS2、CCl4等非极性有机溶剂
在空气中易吸潮而水解
CS2
−112.0
46.2
难溶于水
有毒,易挥发
 (1)、SnI4粗品的制备:将10.0g锡粒、25.4g碘单质、35.00mLCS2加入装置A中,组装好装置后,快速打开冷却水,加热,控制反应温度400℃左右,直至反应完成。停止加热,趁热过滤除去固体杂质,用CS2多次洗涤装置A及残渣,合并滤液和洗涤液,浓缩溶液,经一系列操作得到SnI4粗品。
(1)、SnI4粗品的制备:将10.0g锡粒、25.4g碘单质、35.00mLCS2加入装置A中,组装好装置后,快速打开冷却水,加热,控制反应温度400℃左右,直至反应完成。停止加热,趁热过滤除去固体杂质,用CS2多次洗涤装置A及残渣,合并滤液和洗涤液,浓缩溶液,经一系列操作得到SnI4粗品。①装置C的名称为 , 装置C的作用是。
②装置D中盛放的药品可以是(填标号)。
a.无水硫酸铜 b.碱石灰 c.无水氯化钙
③检查装置气密性后向A中加入少量无水乙醚,加热A至乙醚完全挥发,其目的是。
④用CS2多次洗涤装置A及残渣,合并滤液和洗涤液后,“浓缩溶液”所采用的实验操作名称是。
(2)、SnI4质量分数测定:称取10.0g粗品,加入足量的水,使粗品充分水解。将上层清液全部定容于250mL容量瓶中,移取25.00mL于锥形瓶中,加入少量CCl4和几滴KSCN溶液,用0.20mol·L−1的FeCl3标准溶液滴定至终点时,消耗FeCl3标准溶液28.80mL。(已知:2Fe3++2I-2Fe2++I2)①写出SnI4水解生成SnO2·xH2O的化学方程式。
②根据实验数据计算,样品中SnI4的质量分数为(保留三位有效数字)
-
13、二氧化锗常用作有机反应的催化剂以及制备半导体的原料。某大型化工厂提纯二氧化锗废料(主要含GeO2、AS2O3)的工艺如图,下列有关说法正确的是( )

已知:①GeO2与碱反应生成Na2GeO3;AS2O3与碱反应生成NaASO2;
②GeCl4的熔点−49.5℃,沸点为85℃,极易发生水解
A、Ge在周期表中位于第四周期第ⅥA族 B、“氧化”时,离子反应为ASO+H2O2+2OH-=ASO+2H2O C、“操作1”是蒸馏,“操作2”所用仪器主要为玻璃棒、漏斗、烧杯 D、“操作1”加入的盐酸为7mol/L,若改成1mol/L可节省原料同时不影响产率 -
14、常温下,将少量MSO4粉末缓慢加入20mL0.1mol·L−1H2A溶液中(已知MA难溶,忽略溶液体积变化),溶液中c(M2+)与c(H+)变化如图所示。已知:Ka1(H2A)=1.0×10-9 , Ka2(H2A)=1.0×10-13 , 下列有关说法正确的是( )
 A、a点处,由水电离产生的c(H+)≈1.0×10-5mol/L B、溶液pH=7时,2c(M2+)=2c(A2-)+c(HA-) C、c点处,MA的溶度积Ksp(MA)=1.0×10-24 D、a、b、c三点对应的溶液中,水的电离程度大小关系:c>b>a
A、a点处,由水电离产生的c(H+)≈1.0×10-5mol/L B、溶液pH=7时,2c(M2+)=2c(A2-)+c(HA-) C、c点处,MA的溶度积Ksp(MA)=1.0×10-24 D、a、b、c三点对应的溶液中,水的电离程度大小关系:c>b>a -
15、由Li、Al、Si构成的某三元化合物固态晶胞结构如图所示:

下列说法错误的是( )
A、晶体中Li、Al、Si三种微粒的比例为1:1:1 B、图中所指Si原子的坐标为( , , ) C、晶体中与每个Al紧邻的Li为6个,与每个Si紧邻的Si为12个 D、晶体中Al和Li构成CsCl型晶体结构,晶体中Al和Si构成金刚石型晶体结构 -
16、环氧乙烷(
 , 简称EO)是一种重要的工业原料和消毒剂。由乙烯经电解制备EO的原理示意图如图,一定条件下,反应物按一定流速通过该装置。
, 简称EO)是一种重要的工业原料和消毒剂。由乙烯经电解制备EO的原理示意图如图,一定条件下,反应物按一定流速通过该装置。

已知:电解效率η(B)=×100%;
下列说法正确的是( )
A、电极1应与电源正极相连,离子交换膜应为阴离子交换膜 B、若η(EO)=100%,则溶液c的溶质为KCl C、不考虑各项损失,理论上生成2g气体A,可得到产品EO88g D、每生成1molEO,理论上电路中转移电子数为NA -
17、一定条件下,反应H2(g)+Br2(g)2HBr(g)的速率方程为v=kcα(H2)·cβ(Br2)·cγc(HBr),某温度下,该反应在不同浓度下的反应速率如下:
c(H2)/mol·L−1
c(Br2)/mol·L−1
c(HBr)/mol·L−1
反应速率
0.1
0.1
2
v
0.1
0.4
2
8v
0.2
0.4
2
16v
0.4
0.1
4
2v
0.2
0.1
c
4v
根据表中的测定结果,下列结论错误的是( )
A、α的值为1 B、表中c的值为2 C、反应体系的三种物质中,Br2(g)的浓度对反应速率影响最大 D、在反应体系中保持其他物质浓度不变,增大HBr(g)浓度,会使反应速率降低 -
18、空气中的灰尘、硫酸、硝酸等颗粒物组成的气溶胶系统造成视觉障碍的叫霾。科研人员提出了雾霾微颗粒中硫酸盐(含SO
 、HSO)生成的三个阶段的转化机理,其主要过程示意图如图,下列说法错误的是( )
、HSO)生成的三个阶段的转化机理,其主要过程示意图如图,下列说法错误的是( ) A、SO和NO的中心原子的杂化轨道类型分别是:sp3、sp2 B、整个过程中有H2O参加反应,而且包含了硫氧键的断裂与形成 C、1molSO3-在第Ⅱ、Ⅲ两个阶段共失去电子数目为NA D、硫酸盐转化过程中发生的总反应方程式为:SO+2NO2+H2O=HSO+NO+HNO2
A、SO和NO的中心原子的杂化轨道类型分别是:sp3、sp2 B、整个过程中有H2O参加反应,而且包含了硫氧键的断裂与形成 C、1molSO3-在第Ⅱ、Ⅲ两个阶段共失去电子数目为NA D、硫酸盐转化过程中发生的总反应方程式为:SO+2NO2+H2O=HSO+NO+HNO2 -
19、由下列实验装置及现象一定能得出相应结论的是( )
选项
A
B
C
D
装置
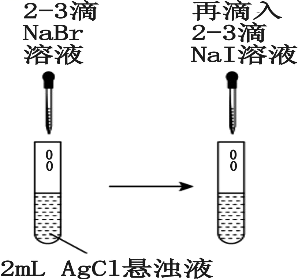
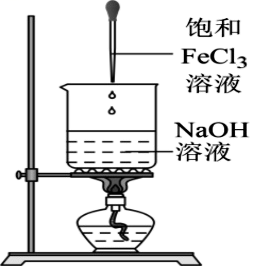
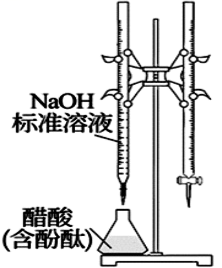
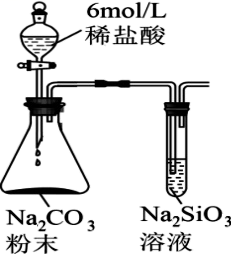
现象
试管中先出现淡黄色固体,后出现黄色固体
产生红褐色沉淀
锥形瓶中溶液由无色变粉红色,半分钟不褪色
试管中液体变浑浊
目的
溶解度:
AgCl>AgBr>AgI
制备Fe(OH)3胶体
测定醋酸浓度
非金属性:
Cl>C>Si
A、A B、B C、C D、D -
20、吡啶(
 )是类似于苯的芳香化合物。2-乙烯基吡啶(VPy)是合成治疗矽肺病药物的原料,可由如下路线合成。下列叙述错误的是( )
)是类似于苯的芳香化合物。2-乙烯基吡啶(VPy)是合成治疗矽肺病药物的原料,可由如下路线合成。下列叙述错误的是( ) A、反应①的原子利用率为100% B、EPy中所有碳原子可以处于同一平面 C、
A、反应①的原子利用率为100% B、EPy中所有碳原子可以处于同一平面 C、 、
、 、
、 的碱性随氮原子电子云密度增大而增强,其中碱性最弱的是
的碱性随氮原子电子云密度增大而增强,其中碱性最弱的是 D、反应②的条件是NaOH醇溶液、加热
D、反应②的条件是NaOH醇溶液、加热