-
1、A、B、C、D、E是五种原子序数依次递增的短周期元素。已知:A的一种同位素可以用于测定文物的年代;基态C原子含3对成对电子;D在同周期金属元素中第一电离能最大;基态E原子的3p轨道中含有自旋方向不同且数目之比为3:1的电子。下列说法正确的是( )A、简单离子的离子半径:B<C<D<E B、简单氢化物的沸点:A<B<C<E C、D的单质可以在A和C形成的某种化合物中燃烧 D、Xe(氙)是目前最易形成化合物的稀有气体,XeC3为非极性分子
-
2、冠醚因分子结构形如皇冠而得名,某冠醚分子c可识别K+ , 其合成方法如下。下列说法错误的是( )
 A、(a)能与浓溴水发生取代反应 B、(b)中各元素电负性大小关系为:O>Cl>C>H C、(c)的一氯代物有3种 D、(c)可增加KI在苯中的溶解度
A、(a)能与浓溴水发生取代反应 B、(b)中各元素电负性大小关系为:O>Cl>C>H C、(c)的一氯代物有3种 D、(c)可增加KI在苯中的溶解度 -
3、设NA为阿伏加德罗常数的值。下列叙述中正确的是( )A、28gC5H10的烃分子中含有C-C σ键的数目一定为1.6NA B、在标准状况下,22.4L由SO2和SO3组成的混合物中含有硫原子的数目为NA C、有2.00L0.5mol·L−1的稀硫酸和足量金属钠反应,消耗钠原子的数目为2NA D、在2CuH+2HCl=Cu+CuCl2+2H2↑反应中,每生成4.48L(标准状况)H2 , 反应转移的电子数目为0.3NA
-
4、化学在生活中有重要价值,下列有关物质应用与反应关联正确的是( )A、海水提镁工业中将MgCl2溶液转化为Mg(OH)2:MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2 B、NaHCO3受热易分解,可用作泡沫灭火剂:2NaHCO3Na2CO3+CO2↑+H2O C、酸性锌锰电池的正极反应:MnO2+H2O+e-=MnO(OH)+OH- D、葡萄糖的氧化反应,普遍用于检验尿糖:CH2OH(CHOH)4CHO+2[Ag(NH3)2]OHCH2OH(CHOH)4COONH4+2Ag↓+3NH3+H2O
-
5、下列化学用语表示正确的是( )A、基态铜原子价电子的轨道表示式:
 B、顺式聚2-甲基-1,3-丁二烯的结构简式:
B、顺式聚2-甲基-1,3-丁二烯的结构简式: C、NaH的形成过程:
C、NaH的形成过程: D、邻羟基苯甲醛的分子内氢键:
D、邻羟基苯甲醛的分子内氢键:
-
6、下列关于物质转化过程的分析,正确的是( )A、半导体行业有一句话:“从沙滩到用户”,其第一步反应:C+SiO2Si+CO2↑ B、漂白粉久置于空气中会失去漂白性,其变质过程中仅发生了非氧化还原反应 C、SO2和SO3混合气体通入Ba(NO3)2溶液,得到的沉淀仅有BaSO4 D、利用电热水器中的阳极镁块可防止金属内胆腐蚀,牺牲阳极法是一种基于电解池原理的金属防护法
-
7、党的二十大报告指出“我们要推进生态优先、节约集约、绿色低碳发展”。下列做法合理的是( )A、通过燃煤脱硫技术减少煤燃烧造成的污染,是实现“碳中和”的有效手段 B、污水处理厂可以利用微生物降解污水中的有机污染物,以减少水污染 C、利用微生物可以将CO2合成油脂,从而实现由无机小分子向有机高分子的转变 D、在制备有机物时,应尽量采用取代反应等理想的“原子经济性”反应
-
8、二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。

 (1)、实验室用图1装置测定SO2催化氧化为SO3的转化率。(已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响。)
(1)、实验室用图1装置测定SO2催化氧化为SO3的转化率。(已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响。)①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作:。
②实验过程中,需要通入氧气。试写出一个用如图2所示装置制取氧气的化学方程式:。
③当停止通入SO2熄灭酒精灯后,需要继续通一段时间的氧气,其目的是:。
④实验结束后,若装置D增加的质量为mg,装置E中产生白色沉淀的质量为ng,则此条件下二氧化硫的转化率是(用含字母的代数式表示,不用化简)。
(2)、某学习小组设计用如图3装置验证二氧化硫的化学性质。
①能说明二氧化硫具有氧化性的实验现象为: 。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分三份,分别进行如下实验。
方案I:向第一份溶液中加入AgNO3溶液,有白色沉
淀生成。
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去。
方案Ⅲ:向第三份溶液中加入BaCl2溶液,产生白色沉淀
上述方案中合理的是 (填“I”、“Ⅱ”、或“Ⅲ”);
试管b发生反应的离子方程式:。
③当通入二氧化硫至试管c中溶液显中性时,该溶液中
c(Na+)=用含硫微粒浓度的代数式表示)。
-
9、硫元素的单质及其化合物在科学研究、工农业生产、农药的制备与使用等方面具有广泛用途。请根据以下应用回答有关问题:(1)、已知单质硫有S2、S4、S6、S8、Sn等多种形式,在Sn分子内S原子以S—S单键形成“锯齿形”的n
元环。试画出S8的八元环结构式。
(2)、绿色农药“石硫合剂”的有效成分为五硫化钙(CaS5)和硫代硫酸钙(CaS2O3),可由单质硫和熟石灰在加热条件下制得,该反应的化学方程式为(反应中单质硫要求用S4表示);。已知多硫化钙为离子化合物,其中S原子以S—S单键连接成多硫链而形成—2价的原子团,试画出五硫化钙的电子式。
(3)、科学家探测出火星大气中含有一种称为硫化羰的物成,其化学式为COS,结构与二氧化碳分子相似。硫化羰可作为一种熏蒸剂,能防止某些昆虫、线虫的危害。请你利用下表中相关共价键的键能数据:共价键
C=O
C=S
H—O
H—S
键能/kJ.mol-1
745
536
464
339
根据有关反应原理写出硫化羰气体与水蒸气反应生成CO2和H2S的热化学方程式:.
(4)、S4广泛用于杀菌剂和抗真菌剂中,可由H2S2的燃料电池获得,其装置如下图所示。
①H2S2的名称是。
②电极b为(选填“正极”、 “负极”)。
③电极a上发生的电极反应为:。
(5)、一氧化二硫(S2O)常温下是一种无色、不稳定的气体,实验室可由S8和氧化铜共热制得,同时生成硫化铜和SO2(注:生成物中气体产物等物质的量:升价与降价的硫也是等物质的量)。该制备反应的化学方程式为;
已知S2O常温时分解生成两种含硫的常见物质,请依据S2O中硫元素的价态分析并写出该分解反应的化学方程式。
-
10、钼(Mo)是VIB族金属元素,原子序数42。熔点为2610℃,沸点为5560℃。 钼硬而坚韧,熔点高,热传导率也比较高。被广泛应用于钢铁、石油、化工、电气和电子技术、医药和农业等领域。某化学兴趣小组利用废钼催化剂(主要成分为MoS2 , 含少量Cu2S,FeS2)回收Mo并制备钼酸钠晶体,其主要流程图如图所示:

回答下列问题:
(1)、操作1为。(2)、空气焙烧的过程中采用如图1所示的“多层逆流焙烧”。
①多层逆流焙烧的优点是(任答一点)。
②固体1的成分有、CuO和Fe2O3。
(3)、固体1加碳酸钠溶液后发生的主要化学方程式为。(4)、钼酸钠是一种新型水处理剂,可以和重金属盐沉淀,则与硫酸铜反应的离子方程式。(5)、还原法制备钼,若利用H2、CO和Al分别还原等量的MoO3 , 所消耗还原剂的物质的量之比为。(6)、已知Na2MoO4溶液中c(MoO)=0.48mol/L,c(CO)=0.040mol/L,由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO , 当BaMoO4开始沉淀时,CO的去除率为95.0%,则Ksp(BaMoO4)=。(已知Ksp(BaCO3)=1.0×10-10 , 过程中溶液体积变化忽略不计)(7)、钼酸盐的氧化性很弱,只有用强还原剂剂才能还原,如:在浓盐酸溶液中,用锌做还原剂和钼酸盐溶液反应,最后生成棕色难溶物MoCl3 , 写出该反应的离子方程式。 -
11、25 ℃时,用0.1 mol·L-1 NaOH溶液滴定同浓度的H2A溶液,H2A被滴定分数、pH及微粒分布分数 , X表示H2A、HA-或A2-]的关系如图所示:

下列说法正确的是( )
A、25 ℃时,H2A第一步电离平衡常数Ka1 ≈10-7 B、c点溶液中: c(Na+)=2c(HA-)+ c(A2-) C、b点溶液中: c(Na+ )>c(HA- )> c(A2-)>c(H+ )> c(H2A)>c(OH- ) D、a、b、c、d四点溶液中水的电离程度: c>d>b>a -
12、根据下列实验或实验操作和现象,所得结论正确的是 ( )
实验或实验操作
现象
实验结论
A
用大理石和盐酸反应制取CO2气体,立即通入一定浓度的Na2SiO3溶液中
出现白色沉淀
H2CO3的酸性比H2SiO3的酸性强
B
向某溶液先滴加硝酸酸化,再滴加BaCl2溶液
有白色沉淀生成
原溶液中含有SO42-、SO32-、HSO3-中的一种或几种
C
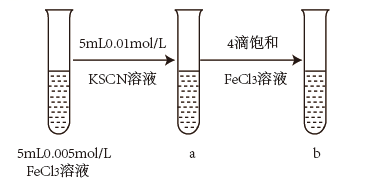
试管b比试管a中溶液的红色深
增大反应物浓度,平衡向正反应方向移动
D

左边棉球变为橙色,右边棉球变为蓝色
氧化性:Cl2>Br2>I2
A、A B、B C、C D、D -
13、现有一混合物的水溶液,可能含有以下离子中的几种:、、、、、、现取三份各100mL溶液进行如下实验: 第一份加入溶液有沉淀产生;第二份加足量NaOH溶液加热后,收集到气体;第三份加足量溶液后,得到干燥沉淀 , 经足量盐酸洗涤、干燥后,沉淀质量为。你认为以下结论正确的是( )A、该混合液中一定含有:、、、 , 可能含 , 且 B、该混合液中一定含有:、、 , 可能含、 C、该混合液中一定含有:、、 , 可能含、、 D、该混合液中一定含有:、 , 可能含、、Cl-
-
14、化合物Ⅳ(
 )是合成中药的一种中间体,以邻二甲苯为原料制备化合物Ⅳ的一种合成路线如图所示。下列说法错误的是 ( )
)是合成中药的一种中间体,以邻二甲苯为原料制备化合物Ⅳ的一种合成路线如图所示。下列说法错误的是 ( ) A、由Ⅱ生成Ⅲ的反应类型为取代反应 B、Ⅱ和Ⅳ均能使酸性高锰酸钾溶液褪色 C、能与发生加成反应 D、I能从碘水中萃取碘,有机相在上层
A、由Ⅱ生成Ⅲ的反应类型为取代反应 B、Ⅱ和Ⅳ均能使酸性高锰酸钾溶液褪色 C、能与发生加成反应 D、I能从碘水中萃取碘,有机相在上层 -
15、下列说法正确的是( )A、标准状态下560mL的氢气和氯气混合充分反应后共价键数目为0.05NA B、标准状态下,将50mL0.01mol/L的NH4Cl溶液与等体积等浓度的NaOH溶液混合,产生气体的分子数为5×10-4NA C、常温常压下,1.5 mol HCHO和C2H2O3的混合物完全充分燃烧,消耗的O2分子数目为1.5NA D、0.1 mol/L的NH4Cl溶液中通入适量氨气呈中性,此时溶液中NH4+数目为NA
-
16、下列离子方程式书写正确的是( )A、向澄清石灰水中滴加少量Ca(HCO3)2溶液:Ca2++OH-+=CaCO3↓+H2O B、Na2O2与稀硫酸反应:2+4H+=O2↑+2H2O C、向饱和食盐水中先通足量NH3 , 再通过量CO2:CO2+OH-= D、Cl2溶于水:Cl2+H2O⇌2H++Cl-+ClO-
-
17、如图所示的实验装置有多种用途,下列说法错误的是( )
 A、该装置可用于收集NO2 B、当试管中盛装浓硫酸时,可用于干燥NH3 C、当试管中盛装氢氧化钠溶液时,可用于除去尾气中的SO2 D、当试管中盛装饱和食盐水时,可用于除去Cl2中的HCl
A、该装置可用于收集NO2 B、当试管中盛装浓硫酸时,可用于干燥NH3 C、当试管中盛装氢氧化钠溶液时,可用于除去尾气中的SO2 D、当试管中盛装饱和食盐水时,可用于除去Cl2中的HCl -
18、下列描述不正确的是( )A、1869年俄国化学家门捷列夫根据相对原子质量从小到大的顺序制作了第一张元素周期表 B、1922年德国化学家施陶丁格提出了“聚合反应是大量小分子以化学键相互结合形成大分子的过程”假说,为建立高分子科学奠定了基础 C、葡萄糖在水溶液中存在链状和环状结构之间的平衡,从链状到环状发生了加成反应 D、核酸检测是诊断新冠肺炎的重要依据,核酸是生物体遗传信息的载体,通过红外光谱仪可检测其结构中存在单键、双键、氢键等化学键
-
19、鲁米诺因能快速鉴定衣物等表面是否存在血迹而被称为“血迹检测小王子”,其一种合成路线如下图所示。下列说法正确的是( )
 A、鲁米诺的分子式为 B、鲁米诺中最多12个原子位于同一平面 C、甲可以与溶液反应生成 D、反应(1)是取代反应,反应(2)是氧化反应
A、鲁米诺的分子式为 B、鲁米诺中最多12个原子位于同一平面 C、甲可以与溶液反应生成 D、反应(1)是取代反应,反应(2)是氧化反应 -
20、2022年北京冬奥会是碳中和的试验场,这其中从清洁能源到环保材料,化学高科技所起到的作用功不可没。下列说法错误的是( )A、“碳中和”是指一定时期内,二氧化碳排放量与吸收量相平衡的状态,植树造林捕获和储存大气中的CO2过程中涉及了氧化还原反应 B、速滑竞赛服采用的聚氨酯材料是一种有机高分子材料 C、运动员使用的可降解餐具用聚乳酸制造,聚乳酸是天然高分子材料 D、场馆的照明、运行均由光伏发电和风力发电提供,有利于实现碳达峰