-
1、下列实验设计能达到对应实验目的的是( )
选项
实验目的
实验设计
A
检验溶液中是否含
在待测液中滴加溶液,观察是否出现特征蓝色沉淀
B
检验含碘食盐中存在碘元素
在含碘食盐溶液中加入淀粉溶液,再滴加稀硝酸,观察溶液是否变蓝
C
验证溶度积:
在2mL 0.1溶液中先滴加5滴0.1溶液,再滴加5滴0.1溶液,观察是否出现沉淀
D
探究和氧化性强弱
在溶液中滴加酸化的过氧化氢溶液,观察溶液是否变为黄色
A、A B、B C、C D、D -
2、扬州大学俞磊教授团队利用萤石直接制备电池电解质材料甲()的新方法如下:、 , 其中X、Y、Z、M、Q为原子序数依次增大的前20号主族元素,X、Q为金属元素,Y、M为同主族元素,且Y是电负性最大的元素,基态Z原子的成对电子数与未成对电子数之比为4∶1。下列说法错误的是( )A、基态X原子核外只有1个未成对电子 B、第一电离能:Q<Z<M<Y C、简单离子半径:Q>M>Y D、、均为三角锥形分子
-
3、下列离子方程式或电极反应式书写错误的是( )A、向溶液中滴加少量氨水,出现蓝色沉淀: B、酸性条件下,电解丙烯腈()生产己二腈[]的阴极反应: C、铅酸蓄电池放电时的正极反应: D、用纯碱溶液除去锅炉水垢中的:
-
4、下列说法错误的是( )A、一级结构的蛋白质分子主要通过氢键形成盘绕、折叠二级结构 B、聚乳酸作为可降解塑料是因为其结构中含酯基 C、对粉末进行X射线衍射,衍射图谱中出现明锐的衍射峰,则为非晶体 D、五光十色的霓虹灯发光变色过程属于物理变化
-
5、实验室用固体和浓盐酸制备纯净的时用不到的实验仪器有( )
 A、①②④⑤ B、③⑥ C、②③⑤ D、③④⑤
A、①②④⑤ B、③⑥ C、②③⑤ D、③④⑤ -
6、实验室可用蘸有浓氨水的玻璃棒靠近盛有浓硝酸的试剂瓶口,检验试剂瓶中是否有逸出:。下列说法或化学用语表示错误的是( )A、基态O原子的价电子排布式: B、放射性元素氚(T): C、的电子式为
 D、中含有离子键、极性键
D、中含有离子键、极性键
-
7、中国传统文化历史悠久,传统文化中承载着大量的化学知识。下列说法错误的是( )A、商代豕形铜尊的主要成分为合金 B、黑火药点火爆炸发生了氧化还原反应 C、唐摹绢本《兰亭序》卷之绢的主要成分为蛋白质 D、花鼓戏之兽皮鼓面的主要成分是橡胶
-
8、为了实现“碳达峰”和“碳中和”的目标,将转化成可利用的化学能源的“负碳”技术是世界各国关注的焦点。回答下列问题:
方法Ⅰ:催化加氢制甲醇。
以、为原料合成涉及的反应如下:
反应ⅰ:
反应ⅱ:
反应ⅲ:
(1)、计算反应ⅲ的。(2)、一定温度和催化剂条件下,在密闭恒容容器中按照投料发生反应(不参与反应),平衡时的转化率、和CO的选择性(如的选择性)随温度的变化曲线如图所示。
①图中曲线a表示物质的变化(填“”“”或“CO”)。
②上述反应体系在一定条件下建立平衡后,下列说法正确的有(填标号)。
A.升高温度,反应ⅰ逆向移动,所以正反应速率减小
B.向容器中再通入少量 , 的平衡转化率下降
C.移去部分 , 反应ⅲ平衡一定不移动
D.选择合适的催化剂能提高的选择性
③保持温度不变,在恒容反应器中,初始总压为5p kPa,只发生反应ⅰ和ⅱ,达到平衡时的转化率为80%,CO的选择性为25%,则的转化率为 , 反应ⅱ的压强平衡常数(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(3)、方法Ⅱ:催化加氢制甲酸
科研工作者通过开发新型催化剂,利用太阳能电池将工业排放的转化为HCOOH,实现碳中和的目标。已知。温度为达到平衡时,化学平衡常数。实验测得: , , 、为速率常数。时,;若温度为达到平衡时, , 则(填“>”、“<”或“=”)。
-
9、DMSO(
 )是一种无色粘稠液体,广泛用作溶剂和反应试剂。实验模拟“氧化法”制备DMSO粗品的装置如图所示(部分夹持和加热装置省略)。
)是一种无色粘稠液体,广泛用作溶剂和反应试剂。实验模拟“氧化法”制备DMSO粗品的装置如图所示(部分夹持和加热装置省略)。
已知:Ⅰ.DMSO与的相关数据如下表
相对分子质量
熔点
沸点
密度
DMSO
78
18.4℃
189℃
1.10
62
-83.2℃
37.5℃
0.85
Ⅱ.微热易分解为NO、和。
实验过程:①连接好装置,检查装置的气密性,装好药品。打开活塞b,通入 , 打开活塞a,滴加稀硫酸,微热三颈烧瓶A。将A仪器中制得的足量气体通入31.00mL二甲基硫醚中,控制温度为60~80℃,反应一段时间得到DMSO粗品,
②粗品经减压蒸馏后共收集到24.11mLDMSO纯品。
回答下列问题:
(1)、B中盛放的试剂是(填名称);仪器X的进水口为(填“d”或“c”)口。(2)、多孔球泡的主要作用是。(3)、关闭活塞b,装置A中产生的气体通入装置C中发生反应后,气体成分不变。生成DMSO的化学方程式是。(4)、D装置吸收尾气的优点是。(5)、实验中通入过量的目的是(答两点)。(6)、DMSO被誉为“万能溶剂”,其易溶于水的主要原因是。(7)、本实验的产率是%(结果保留2位小数)。 -
10、化合物G(4-甲基-3-环己烯甲腈)是一种重要的化工原料,以丙烯和乙炔为主要原料的一种合成路线如下:

已知:

回答下列问题:
(1)、化合物F的名称是。(2)、化合物C中的官能团名称为 , C→D的反应类型为。(3)、化合物D中最多有个原子共平面,化合物G核磁共振氢谱图中有组峰。(4)、A→B的化学方程式为。(5)、化合物H是B的同系物,且相对分子质量比B大14,则满足以下条件的H的同分异构体有种(不考虑立体异构体,羟基直接连在碳碳双键的碳原子上的结构不稳定)。①分子中无环状结构 ②能使溴水褪色
(6)、参照化合物G合成路线,以乙炔、甲醛及无机试剂为原料合成1,4-环己二烯( ),请完成下列合成路线:
),请完成下列合成路线: -
11、硒和碲是重要的稀散元素,都可以作为半导体材料。一种从碲碱渣(碲和硒的含量较高,还含有少量Cu、Pb等元素)分离硒回收碲的工艺流程如下:

已知:①水浸液的主要成分为、及少量可溶性的铜、铅化合物等。
②为两性氧化物,微溶于水。
③亚硒酸为二元弱酸,
回答下列问题:
(1)、硒与氧同族,基态Se原子价电子排布式为。(2)、“除杂渣”的主要成分为。(3)、“中和”时控制pH为4~5,生成沉淀,若硫酸过量,将导致Te的回收率下降的原因是。(4)、“酸浸液”中硒主要以亚硒酸的形式存在。若控制“酸浸液”的pH为2,此时溶液中。(5)、“沉硒”时生成了一种无污染的单质气体,写出“沉硒”时发生的主要反应的化学方程式。(6)、碘量法测定“粗硒”中硒的含量,过程如下:取0.1000g粗硒,加入足量硫酸和硝酸,充分反应生成 , 再加热至90℃使过量的硝酸挥发;继续向溶液中加入过量的KI溶液,生成Se和;然后滴入2滴淀粉溶液,用0.4000mol/L溶液滴定()。重复上述操作2次,消耗的溶液的平均体积为12.50mL。①判断滴定至终点的方法是。
②该粗硒的纯度为。
-
12、为三元弱酸,在溶液中存在多种微粒形态。将NaOH溶液滴到1mo/L溶液中,各种含R微粒的分布分数δ[如随pH变化曲线如图所示。下列说法正确的是( )
 A、的 B、当pH调至11~12时发生反应的离子方程式为: C、时,溶液中 D、时,溶液中
A、的 B、当pH调至11~12时发生反应的离子方程式为: C、时,溶液中 D、时,溶液中 -
13、向密闭容器中充入一定量和混合气体,在一定条件下,发生反应: 。测得在不同温度下的平衡时产率与压强的关系如图所示。下列说法正确的是( )
 A、平衡常数: B、逆反应速率: C、反应温度: D、混合气体平均摩尔质量:
A、平衡常数: B、逆反应速率: C、反应温度: D、混合气体平均摩尔质量: -
14、常温常压下利用Cu/ZnO/ZrO催化剂实现二氧化碳加氢制甲醇的反应历程和能量变化图如下(其中吸附在催化剂表面上的粒子用*标注):

下列说法正确的是( )
A、转化历程有四个基元反应,决速步为: B、若无Cu/ZnO/ZrO催化剂,二氧化碳加氢制甲醇不能自发进行 C、反应过程中断裂与形成的共价键类型相同 D、寻找高效催化剂,有利于的回收利用,使该反应原子利用率达到100% -
15、“宏观辨识与微观探析”是化学学科核心素养之一。下列有关宏观辨识与微观探析说法错误的是( )
宏观辨识
微观探析
A
HF在标准状况下为液态
HF分子间存在氢键
B
在水中的溶解度大于
是极性分子,是非极性分子
C
石墨的导电性只能沿石墨平面的方向
石墨晶体中相邻碳原子平面之间相隔较远
D
船式环己烷()比椅式环己烷稳定
分子空间结构不同,船式的空间位阻小
A、A B、B C、C D、D -
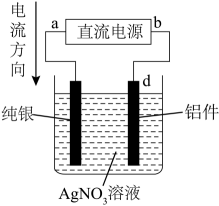
16、下列实验装置(部分夹持装置略)正确且能够达到实验目的是( )
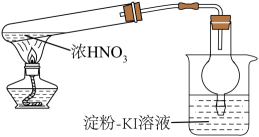


A.验证浓分解生成
B.铝件镀银
C.Na的燃烧
D.制备晶体
A、A B、B C、C D、D -
17、利用光伏并网发电装置电解得到高纯度的装置如图所示。下列说法正确的是( )
 A、m极电势高于n极电势 B、离子交换膜最好为阳离子交换膜 C、b电极的电极反应式为: D、电解产生2.24L时导线中通过0.2mol电子
A、m极电势高于n极电势 B、离子交换膜最好为阳离子交换膜 C、b电极的电极反应式为: D、电解产生2.24L时导线中通过0.2mol电子 -
18、砷化镓是超级计算机、光信号处理的理想材料。图甲为它的一种立方晶胞结构,图乙为该晶胞沿z轴投影图。已知该晶胞边长为d pm,a、b两点原子的分数坐标分别为(0,0,0),(1,1,1)。下列说法错误的是( )
 A、Ga原子占据As原子形成的四面体空隙 B、两个As原子间最短距离是 C、该晶胞的密度为 D、c点原子的分数坐标为
A、Ga原子占据As原子形成的四面体空隙 B、两个As原子间最短距离是 C、该晶胞的密度为 D、c点原子的分数坐标为 -
19、药物贝诺酯有消炎、镇痛、解热的作用,其制备原理为:

在实验室可用以下装置(夹持和水浴加热装置略)制备贝诺酯(沸点453.11℃),实验中利用环己烷-水的共沸体系(沸点69℃)带出水分。已知体系中沸点最低的有机物是环己烷(沸点81℃)。下列说法正确的是( )
 A、反应时水浴温度不能高于69℃ B、根据环己烷带出水的体积可估算出反应进度 C、因为蒸出的是共沸体系,故锥形瓶中不会出现分层现象 D、以共沸体系带出水促使反应正向进行,同时加快了反应速率
A、反应时水浴温度不能高于69℃ B、根据环己烷带出水的体积可估算出反应进度 C、因为蒸出的是共沸体系,故锥形瓶中不会出现分层现象 D、以共沸体系带出水促使反应正向进行,同时加快了反应速率 -
20、超分子是由两种或两种以上的分子通过分子间相互作用形成的分子聚集体。某种超分子结构如图所示。下列有关说法正确的是( )
 A、该超分子中的键角小于的键角 B、该超分子中存在配位键、氢键等化学键 C、该超分子具有自组装的特征 D、该超分子不能发生水解反应
A、该超分子中的键角小于的键角 B、该超分子中存在配位键、氢键等化学键 C、该超分子具有自组装的特征 D、该超分子不能发生水解反应