-
1、化学反应中有颜色变化之美。下列相关离子方程式表示不正确的是( )A、向溶液中滴加稀硫酸出现黄色沉淀: B、向溶液中加入出现红褐色沉淀: C、向酸性溶液中通入后溶液紫色褪去: D、向溶液中加入后溶液变为黄色:
-
2、咖啡酸甲酯可用作食品增香剂及化妆品中的抗氧化剂,其结构如图所示。关于该化合物,下列说法正确的是( )
 A、属于烃类化合物 B、能与Na2CO3溶液反应生成CO2 C、能发生氧化反应、加成反应和取代反应 D、1mol该化合物最多能与2molNaOH反应
A、属于烃类化合物 B、能与Na2CO3溶液反应生成CO2 C、能发生氧化反应、加成反应和取代反应 D、1mol该化合物最多能与2molNaOH反应 -
3、劳动创造美好生活。下列劳动项目与所述的化学知识有关联的是( )
选项
劳动项目
化学知识
A
传承工艺:使用含淀粉酶的麦芽作用于淀粉,制作饴糖(又称麦芽糖饴)
麦芽糖水解可生成葡萄糖
B
环保活动:用Fe2(SO4)3作净水剂
Fe3+水解形成的氢氧化铁胶体可以吸附水中的悬浮物
C
学农活动:向盐碱地(含Na2CO3、NaCl)洒石膏进行处理
Na2CO3能与CaCl2发生复分解反应
D
学工活动:将铝制品电解氧化形成保护膜
铝制品与电源负极相连能够受保护
A、A B、B C、C D、D -
4、钇稳定氧化锆浓差电池可用于测定待测环境中氧气的含量,在冶金、能源等领域应用广泛。其原理是利用空气与待测环境中氧气的浓度差对电压的影响,某工作状态如图所示。该电池工作时,下列说法不正确的是( )
 A、电极A为正极 B、O2-由电极A向电极B迁移 C、电极B发生的反应为 D、理论上,电解质中O2-的总物质的量会增加
A、电极A为正极 B、O2-由电极A向电极B迁移 C、电极B发生的反应为 D、理论上,电解质中O2-的总物质的量会增加 -
5、用碳酸钠标定盐酸,实验步骤为①研细Na2CO3、②加热Na2CO3 , 至质量不变、③冷却、④称量、⑤溶解、⑥用待测盐酸滴定。下列实验步骤所对应的操作正确的是( )A、步骤②
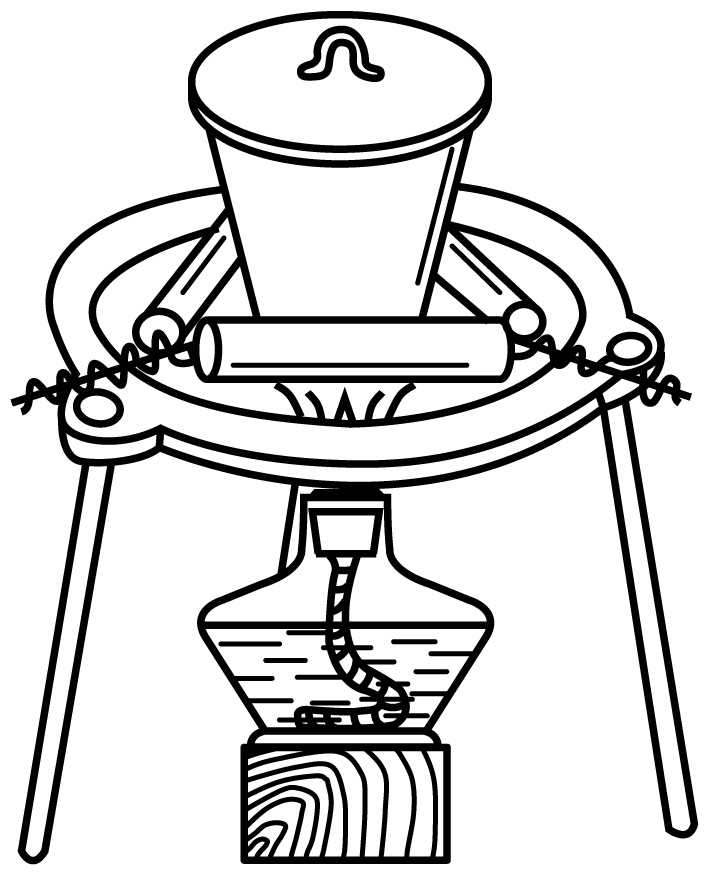 B、步骤④
B、步骤④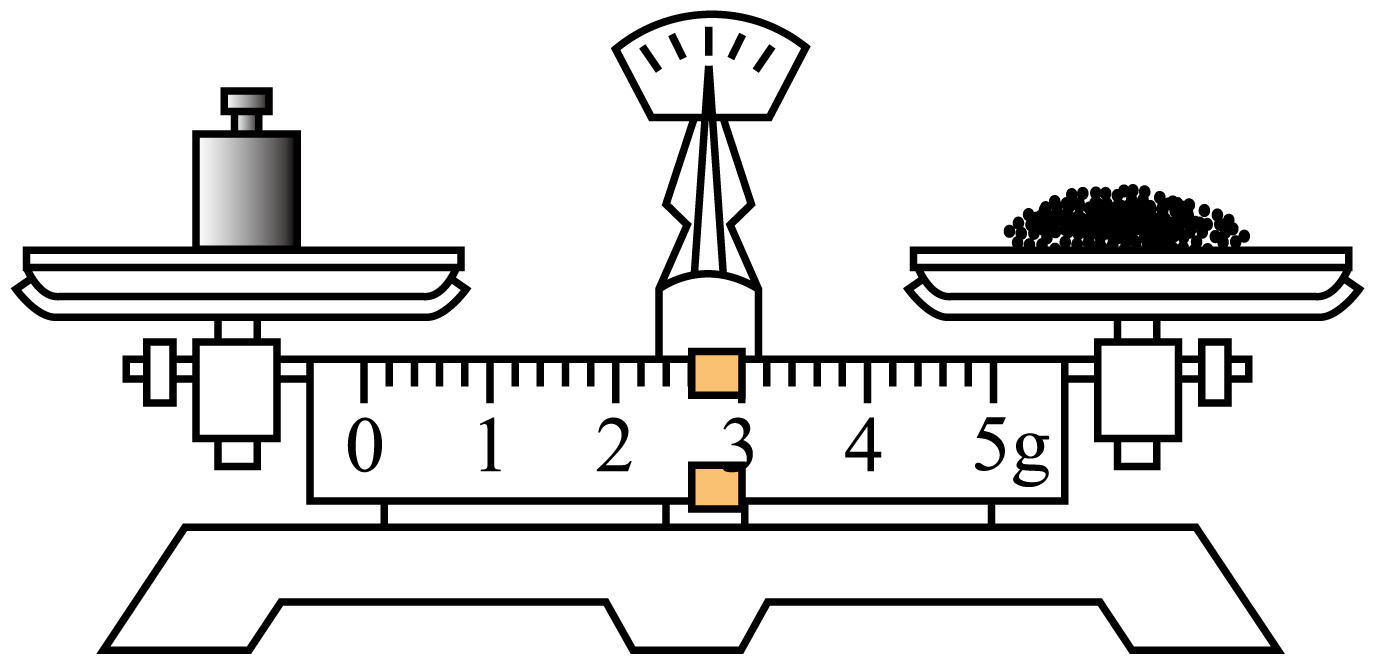 C、步骤⑤
C、步骤⑤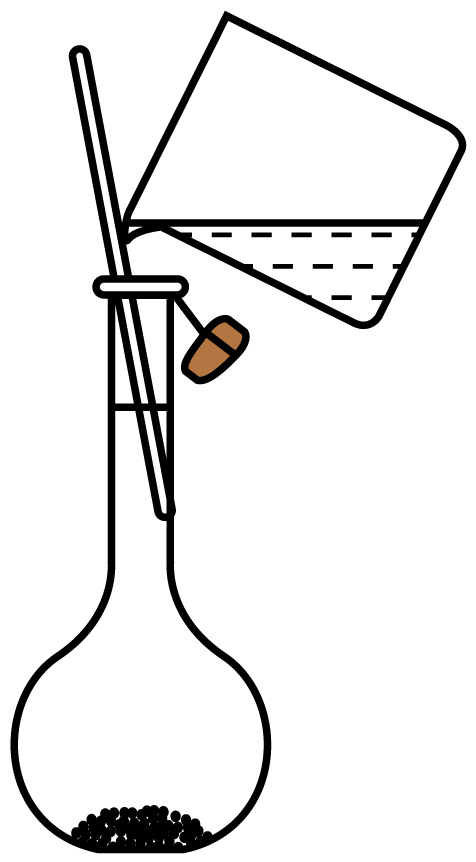 D、步骤⑥
D、步骤⑥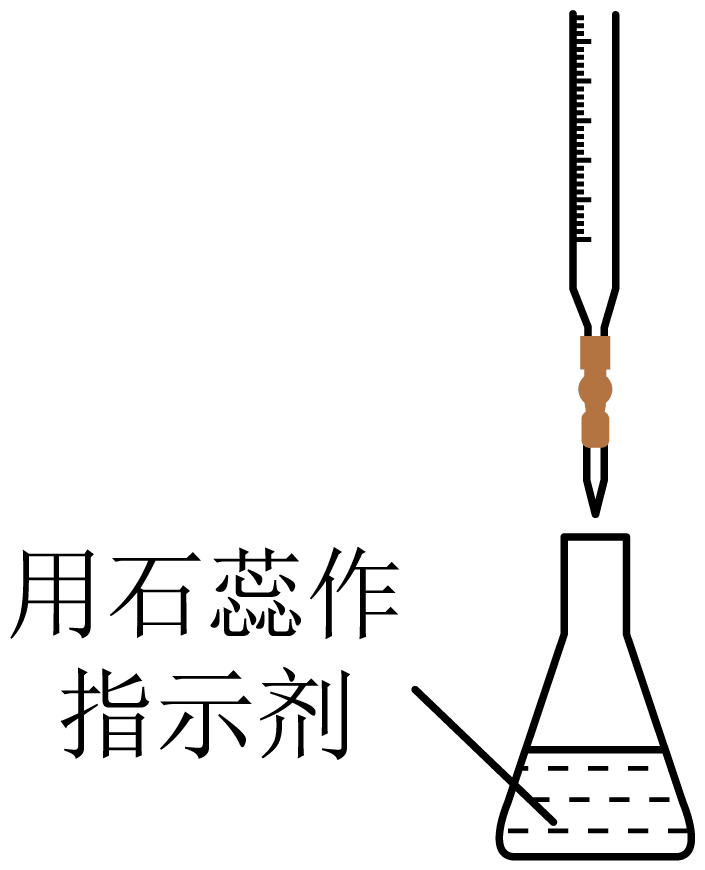
-
6、衣食住行皆化学。下列说法不正确的是( )A、衣服面料中的聚酯纤维、棉、麻均属于有机高分子 B、制作豆腐时煮沸豆浆的过程中蛋白质发生了盐析 C、建筑材料熟石灰中含有离子键和共价键 D、新能源汽车使用锂离子电池供电时化学能转化为电能
-
7、近年来我国科技在各个领域都有重大进展。下列说法正确的是( )A、“天和”核心舱太阳能电池翼使用砷化镓器件,砷是s区元素 B、用转基因蚕丝合成高强度、高韧性“蜘蛛丝”,蚕丝的主要成分为纤维素 C、用磷酸钠钡钴盐[Na2BaCo(PO4)2]实现零下273.056℃制冷,磷酸钠钡钴盐为离子晶体 D、在催化剂作用下用煤炭生产烯烃等液体能源,煤炭属于可再生能源
-
8、中华文化源远流长。下列文物主要由金属材料制成的是( )
文物




选项
A.西周五祀卫鼎
B.唐三彩陶罐
C.东周漆木尊
D.汉代玉璧
A、A B、B C、C D、D -
9、某研究小组按下列路线合成抗抑郁药米氮平。

已知:①
 ②
②
请回答:
(1)、化合物A的官能团名称是。(2)、下列说法正确的是____。A、化合物E可发生缩聚反应 B、E→F,F→G的反应类型均为取代反应 C、化合物G可与盐酸反应 D、米氮平的分子式为(3)、化合物B的结构简式。(4)、写出的化学方程式。(5)、研究小组在实验室用乙苯及甲醇为原料合成药物二苄胺( )。
)。利用以上合成路线的相关信息,设计该合成路线(用流程图表示,无机试剂任选)。
(6)、写出4种同时符合下列条件的化合物的同分异构体的结构简式。①分子中含有苯环,无其他环状结构;
②谱和IR谱检测表明:分子中共有3种不同化学环境的氢原子,且无
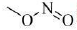 结构。
结构。 -
10、硫代尿素是重要的工业原料。某小组按如图流程开展制备实验(部分装置及夹持仪器已省略)。主要反应:
步骤Ⅱ:
步骤Ⅲ:
已知:硫代尿素可溶于水、乙醇,微溶于乙醚
 (1)、仪器X的名称(填仪器名称)。(2)、下列说法不正确的是____。A、配制5%的BaS溶液必须用到的玻璃仪器有烧杯、玻璃棒、容量瓶等 B、装置A使用恒压分液漏斗添加硫酸溶液时,可以打开漏斗上部的玻璃塞 C、在反应前若向装置B中通入一段时间 , 能提高产品的产率 D、步骤Ⅲ反应完全的现象是溶液变澄清,集气瓶液面不再改变(3)、步骤Ⅰ、Ⅱ、Ⅲ的部分操作如下,其正确的顺序是:
(1)、仪器X的名称(填仪器名称)。(2)、下列说法不正确的是____。A、配制5%的BaS溶液必须用到的玻璃仪器有烧杯、玻璃棒、容量瓶等 B、装置A使用恒压分液漏斗添加硫酸溶液时,可以打开漏斗上部的玻璃塞 C、在反应前若向装置B中通入一段时间 , 能提高产品的产率 D、步骤Ⅲ反应完全的现象是溶液变澄清,集气瓶液面不再改变(3)、步骤Ⅰ、Ⅱ、Ⅲ的部分操作如下,其正确的顺序是:()→()→a→()→e→f→()
a.调节三通阀如图
 , 收集气体一段时间
, 收集气体一段时间b.开启装置A磁力搅拌器,慢慢加入一定量硫酸
c.调节装置B温控磁力搅拌器,并控制温度为30℃
d.调节装置B温控磁力搅拌器,并迅速控温在85℃
e.调节三通阀如图

f.移动水准管并调节活塞Y控制气体流速,反应一段时间后
g.检测气体纯净后连接三通阀
(4)、步骤Ⅳ的主要操作是(请补上第一步):→洗涤、合并滤液→冷冻结晶。上述步骤中的最适宜洗涤剂是:A.冷水 B.热水 C.乙醚 D.滤液
(5)、产品含量的测定:滴定反应:
主要步骤:
Ⅰ.称取mg产品用蒸馏水溶解并定容至500mL。移取该溶液注入碘量瓶中,加碘标准液,20mL氢氧化钠溶液,于暗处放置10min。加适量水及盐酸摇匀,用硫代硫酸钠标准溶液滴定,近终点时,加3mL淀粉指示液 , 继续滴定至终点,消耗体积。
Ⅱ.空白实验:将上述样品溶液改为蒸馏水注入碘量瓶中,重复后续步骤,滴定至终点时消耗体积。
①需要加入淀粉指示液时,锥形瓶中溶液的现象是。
②产品的质量分数为。
-
11、异丁烯是重要的化工生产原料,可由异丁烷催化脱氢制备,反应如下: 。
已知:①主要副反应为
②温度过高会引发烃裂解生成炭(C)。
③相关化学键的键能如下所示:
化学键
键能
615
436
请回答:
(1)、。(2)、有利于提高异丁烷平衡转化率的条件有____。A、低温 B、高温 C、低压 D、高压 E、催化剂(3)、其他条件相同,在恒压的密闭容器中充入异丁烷和各1mol(作惰性气体),经过相同时间测得相关数据如图1和图2所示。[收率 , 空速(GHSV):单位时间通过单位体积催化剂的气体量](不考虑温度对催化剂活性的影响,异丁烷分子在催化剂表面能较快吸附)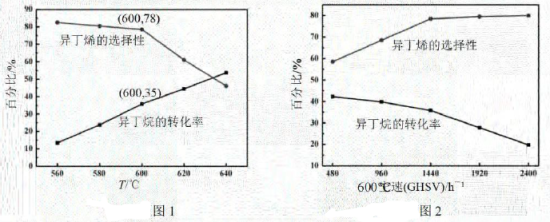
①图1中,600℃时异丁烯收率。
②下列说法正确的是。
A.由图1可知,温度越高,产生异丁烯的速率越快
B.混入的目的之一是减小异丁烷的吸附速率,同时带走催化剂局部多余的热量,从而抑制催化剂的积碳
C.图2中,空速增加,异丁烷转化率降低的原因可能是原料气在催化剂中停留时间过短
D.图2中,空速增加,异丁烯选择性升高的原因可能是原料气将产物迅速带走,抑制了副反应的发生
③图1中,随着温度升高,异丁烷转化率增大而异丁烯选择性下降的原因可能是。
④其他条件相同,异丁烷的平衡转化率如图3所示。若充入改为2mol,在图3中作出异丁烷的平衡转化率随温度变化的曲线(忽略积碳的影响)。
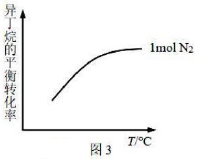
-
12、硝酸盐型熔盐(含)在太阳能光热发电领域被广泛应用。高纯的制备、性质与应用是目前研究的热点,部分生产方法及性质研究如下:

已知:硝酸工业尾气中主要含、NO、。
请回答:
(1)、写出溶液A中的所有离子;方法Ⅱ中,“氧化吸收液”的目的是。(2)、下列说法正确的是____。A、方法Ⅰ说明:该条件下,酸性 B、方法Ⅱ中, , 氮氧化物才能被足量的KOH溶液充分吸收 C、固体与浓硫酸共热,可产生红棕色气体 D、若气体B是一种单质,则所得固体C中不能含有三种元素(3)、方法Ⅰ中,用代替 , 得到副产品。工业上用溶液浸取菱镁矿的煅烧粉(含MgO),不断加热蒸出氨气,以获得较高浓度的溶液,其原理是。(4)、在某温度下,分解得到的可用于制备新型高效多功能水处理剂 , 水溶液放置过程中会放出无色无味气体、产生沉淀、溶液呈强碱性。请依据上述信息,设计实验检验无色无味气体成分和沉淀中的金属元素。写出与、共热制取的化学方程式:。 -
13、镓的化合物种类繁多,应用广泛。(1)、镓位于元素周期表的区。(2)、下列镓原子核形成的微粒中,电离最外层1个电子所需能量最大的是____。A、 B、 C、 D、(3)、①是一种重要的半导体材料,其熔点为1238℃,可由如下反应制备:
。(电负性: )
下列说法正确的是。
A.原子半径:
B.GaAs为共价晶体,为分子晶体
C.沸点:
D.化学键中离子键成分的百分数:
②比较键角:中的中的(填“>”“<”或“=”),请说明理由
(4)、感光材料硫镓银晶体的晶胞如图所示,该晶体的化学式为。
如图所示晶胞沿着z轴的投影图为(填选项字母)。
A.
 B.
B. C.
C. D.
D.
-
14、根据实验目的设计方案并进行实验,观察到相关现象,其中设计和结论均合理的是( )
实验目的
实验方案设计
现象
结论
A
探究与的氧化性强弱
向溶液中加入过理HI溶液充分反应,再滴加淀粉溶液
溶液变蓝色
氧化性:
B
比较与结合的能力
常温,测定溶液的pH
结合能力:
C
探究温度对化学平衡的影响
将的溶液加热后置冷水中,观察现象
加热后溶液为黄绿色,冷水中变为蓝绿色
说明降低温度
向正反应方向移动
D
比较AgCl与的Ksp
向含有浓度均为的、溶液中,逐滴滴加溶液
先生成白色AgCl沉淀
Ksp:
A、A B、B C、C D、D -
15、常温下,往溶液中通入至饱和,有微量FeS生成,溶液中(溶液体积和浓度的变化忽略不计)。[已知:的电离常数 , , ],下列说法不正确的是( )A、溶液中, B、反应的 C、溶液中, D、溶液中,pH约为5
-
16、某小组利用不同膜反应器(可选择性地让某些气体通过而离开体系)研究HI的分解率,工作原理如下图所示。图a、b和c反应区温度维持恒定且相等,仅发生且在反应区内进行。投料均为1mol的 , 反应同时开始,80s时图b反应区处于瞬时平衡状态,其化学平衡常数。

图a装置
图b装置
图c装置
80s时反应区的物质的量/mol
x
下列说法正确的是( )
A、图a装置的化学平衡常数 B、图a装置中,分解率为10% C、图b装置中,前80s内的平均渗透速率约为 D、图c装置中,x一定大于 -
17、某研究小组模拟微库仑滴定法测定样品中的含量,工作原理是电解质溶液中的保持标准值时,电解池不工作;样品进入电解池后与反应,便立即自动进行电解,当又回到标准值,测定结束;溶液中存在:。部分装置如图所示,下列说法不正确的是( )
 A、阳极反应式: B、Pt电极附近离子放电的顺序: C、和溶液可维持电解质溶液的pH在一定范围内基本不变 D、经折算电路中转移电子,则样品中的含量为
A、阳极反应式: B、Pt电极附近离子放电的顺序: C、和溶液可维持电解质溶液的pH在一定范围内基本不变 D、经折算电路中转移电子,则样品中的含量为 -
18、2-甲基环戊醇可作为合成橡胶、塑料和纤维等高分子材料中的软化剂和增塑剂。其合成路线如下:

下列说法不正确的是( )
A、根据化合物B的结构,推测过程I依次发生了加成反应、水解反应 B、试剂1选择的试剂为NaOH醇溶液,反应条件是:加热 C、化合物C是一种难溶于水的液体 D、过程Ⅲ中,化合物C与水反应时可能生成多种组成相同的有机产物 -
19、X、Y、Z、M和Q五种短周期主族元素,原子序数依次增大,X原子中核外电子有8种运动状态,Y元素在短周期中金属性最强,Z与M元素相邻,M和Q基态原子核外有未成对电子数之比为。下列说法不正确的是( )A、熔点:晶体Z>晶体 B、最高价氧化物对应水化物的酸性: C、气态是由极性键构成的极性分子 D、YQ晶体中Y离子距离最近且相等的Q离子有6个
-
20、关于有机物的检测,下列说法正确的是( )A、用质谱法不可鉴别乙醇和二甲醚 B、阿司匹林(
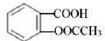 )加稀水解后,直接加溶液检验产物中的酚羟基
C、用新制氢氧化铜(可加热)可鉴别乙醛、乙醇、苯、甲苯
D、已知分子式为的某链状有机物,用核磁共振氢谱法可推断其是否是丙酸
)加稀水解后,直接加溶液检验产物中的酚羟基
C、用新制氢氧化铜(可加热)可鉴别乙醛、乙醇、苯、甲苯
D、已知分子式为的某链状有机物,用核磁共振氢谱法可推断其是否是丙酸