-
1、下列实验装置和实验操作均正确的是( )
A
B
C
D
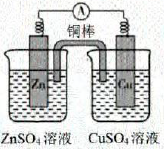
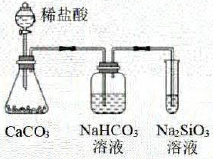
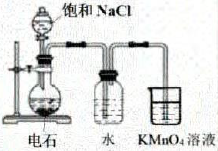
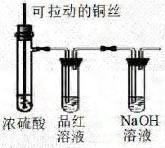
验证双液原原电池的工作原理
比较C与Si的非金属性强弱
用电石制备乙炔并验证乙炔的性质
探究铜与浓硫酸的的反应
A、A B、B C、C D、D -
2、下列反应与方程式相符的是( )A、铅酸蓄电池放电时的负极反应: B、溶于稀硝酸得蓝色溶液, C、丙烯与足量酸性高锰酸钾溶液反应: D、将浓度均为的和溶液按体积比混合:
-
3、材料的合成条件、组成和结构发生变化,其性能也会发生变化,对于促进生产发展、改善人类生活发挥了巨大作用,下列叙述不合理的是( )
原料
反应条件、组成或结构改变
效果
A
碳素钢
改变合金元素
得到性能不同的特种钢
B
高分子聚合物
增加强亲水基团
产生高吸水性树脂
C
头发
二硫键的断裂与形成
定型成需要的形状
D
苯酚、甲醛
控制反应条件,主要生成2,4,6-三羟甲基苯酚中间体
得到线型结构酚醛树脂
A、A B、B C、C D、D -
4、某学习小组欲从含有、乙醇和氨水的实验室废液中分离乙醇并制备硫酸铜铵晶体,设计方案如下,下列说法不正确的是( )
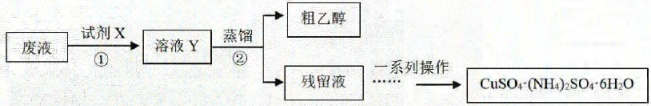 A、试剂X是硫酸,其中发生的反应之一: B、步骤②蒸馏实验可用水浴加热 C、若得到的粗乙醇中乙醇的含量明显偏低,可能是蒸馏时加热温度偏低 D、将残留液加热浓缩、冷却结晶可得到硫酸铜铵晶体
A、试剂X是硫酸,其中发生的反应之一: B、步骤②蒸馏实验可用水浴加热 C、若得到的粗乙醇中乙醇的含量明显偏低,可能是蒸馏时加热温度偏低 D、将残留液加热浓缩、冷却结晶可得到硫酸铜铵晶体 -
5、下列关于元素及其化合物的说法不正确的是( )A、将通入冷的石灰水,制得漂白粉 B、铁是人体必需微量元素,人体内缺铁会发生贫血 C、铝粉和NaOH的混合物可作为家庭厨卫管道疏通剂的主要成分 D、硫元素广泛存在于自然界中,在没有人类活动的影响下,也可能形成酸雨
-
6、高温结构陶瓷氮化硅由石英与焦炭在高温的氮气流中通过以下反应制备:
, 下列说法正确的是( )(为阿伏加德罗常数的值)
A、和是氧化剂 B、既是氧化产物,又是还原产物 C、每消耗1molC转移的电子数为 D、从熵变角度分析,反应更易生成 -
7、侯氏制碱法利用、饱和NaCl溶液先制得 , 进一步生产 , 下列说法不正确的是( )A、生产中,向溶有的饱和食盐水中通入 , 析出 B、将所得固体加热生产出纯碱 C、碳酸氢钠和碳酸钠的溶液均呈碱性,可用作食用碱或工业用碱 D、新制氯水中加入少量碳酸氢钠,可提高氯水漂白效果
-
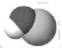
8、下列化学用语表示正确的是( )A、次氯酸的空间填充模型:
 B、氧化钾的电子式:
C、聚丙烯链节:
D、
B、氧化钾的电子式:
C、聚丙烯链节:
D、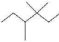 的名称:3,4,4-三甲基己烷
的名称:3,4,4-三甲基己烷
-
9、下列物质属于弱电解质的是( )A、 B、 C、 D、
-
10、化合物J是一种药物中间体,合成该化合物的一种路线如图所示(部分反应条件已简化)。
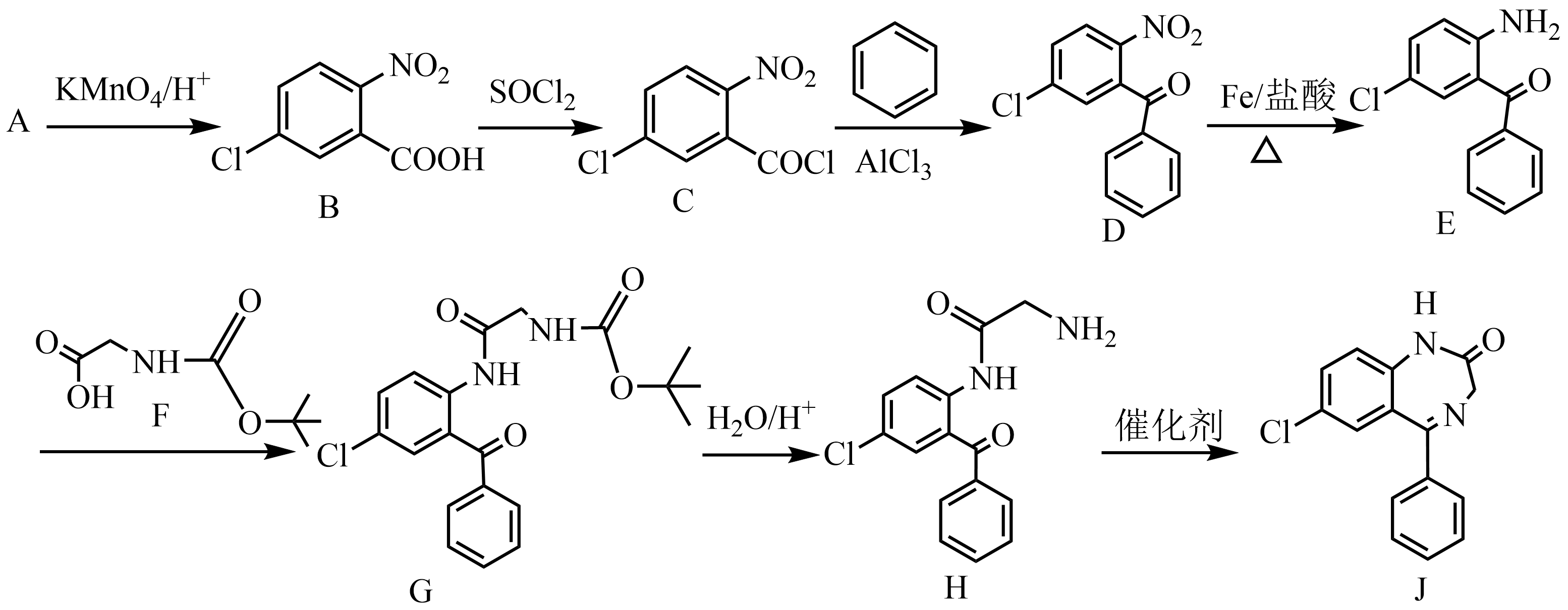
已知:
 (“Boc—”表示
(“Boc—”表示 )
)回答下列问题:
(1)、化合物A中含7个碳原子,且只含两种官能团,则A的结构简式为。(2)、B转化为C的反应类型是。(3)、依据上述合成路线提供的信息,下列反应产物L的结构简式是。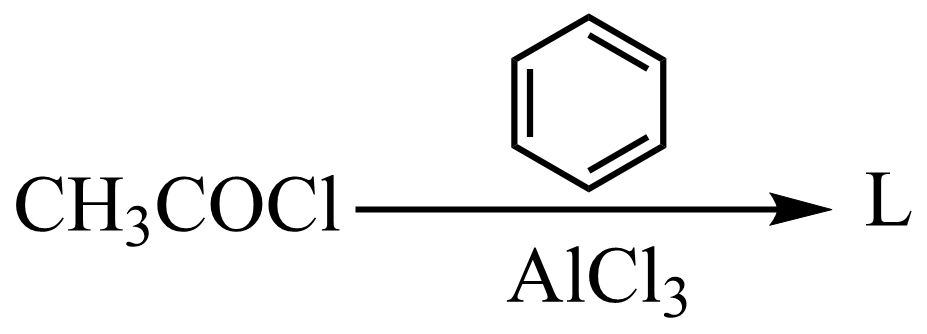 (4)、E转化为G的化学方程式是。(5)、H含有的官能团名称是碳氯键、氨基、。(6)、化合物C的同分异构体中,符合下列条件的有种。
(4)、E转化为G的化学方程式是。(5)、H含有的官能团名称是碳氯键、氨基、。(6)、化合物C的同分异构体中,符合下列条件的有种。①能发生银镜反应
②含硝基
③含苯环结构
其中核磁共振氢谱中有2组峰的结构简式是(填一种)。
(7)、设计以苯和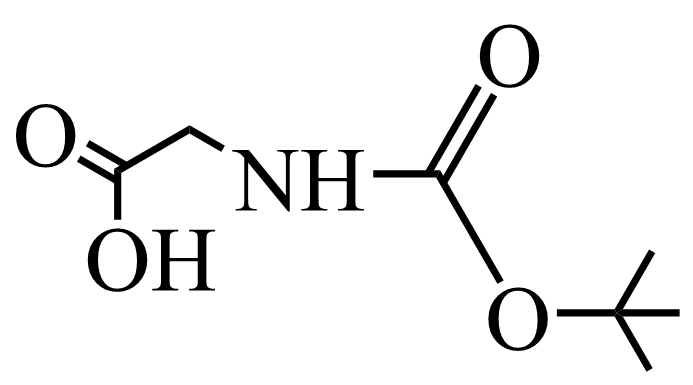 为原料制备
为原料制备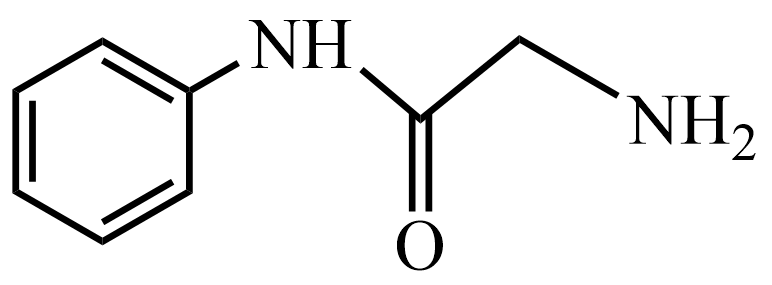 的合成路线:(其他试剂任选)。
的合成路线:(其他试剂任选)。 -
11、一种硫酸镍粗品中含有、、、、等杂质离子,采用下列流程可以对硫酸镍进行提纯,并能获取蓝矾。
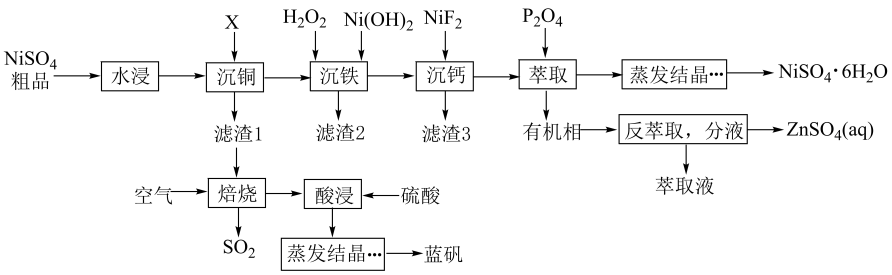
已知:常温下,①;
②部分金属离子(起始浓度为0.1 , 沉淀完全的浓度为)生成氢氧化物沉淀的pH范围如下表:
金属离子
开始沉淀的pH
1.5
4.2
6.2
6.3
6.9
11.8
完全沉淀的pH
2.8
6.2
82
8.3
8.9
13.8
回答下列问题:
(1)、“水浸”时常适当加热,加热的目的是。(2)、常温下,X是一种气体,则X、、中键角从大到小的顺序是(用化学式表示),其原因是。(3)、“沉铁”时,总反应的离子方程式为;其中加入的作用是调节溶液pH=(填字母)。A.1.5 B.4.0 C.6.3 D.6.9
(4)、若某次工艺生产中,“沉铁”后,1.0t(体积约为L)滤液中 , “沉钙”后, , 则最少加入g(保留三位有效数字)。(5)、萃取剂P204的结构简式如图1所示,1mol P204中含mol手性碳原子;萃取时,萃取液pH对相关金属离子的影响如图2所示,则最适宜的pH为。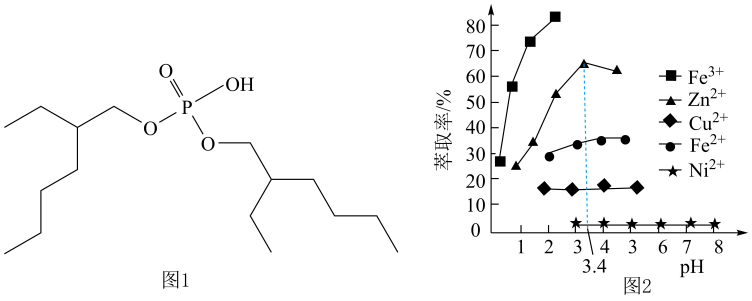
-
12、低碳烯烃是重要的化工原料,广泛用于生产塑料、溶剂、药物、化妆品等。低碳烯烃主要是指乙烯、丙烯、丁烯。回答下列问题:(1)、Ⅰ.我国科学家研究出新型催化剂/ZMS—5,能使加氢生成乙烯,反应过程如图所示:
催化加氢的反应由反应①和反应②两步完成,反应①的活化能>反应②的活化能 , 则催化加氢反应的决速步骤是(填“反应①”或“反应②”)。反应③为解聚、烯烃异构化反应,烯烃异构化是指改变烯烃结构而相对分子质量不变的反应过程,化工生产中的下列烯烃能发生异构化反应的是(填字母)。
A.乙烯 B.2-甲基丙烯 C.2,3-二甲基-1-丁烯
(2)、Ⅱ.丙烯作为化工原料,其用量仅次于乙烯,应用丙烷脱氢制丙烯成为丙烯的重要来源,涉及的主要反应如下:ⅰ.
ⅱ.
。
(3)、按起始投料比将气体匀速通入到恒压(100kPa)密闭容器中,发生反应ⅰ和反应ⅱ。在相同时间不同温度(T)下,测得反应过程中、的转化率变化曲线如图所示:
M表示(填“”或“”)的转化率随温度变化的曲线;C点后,随着温度升高,主要进行的反应是(填“ⅰ”或“ⅱ”),该反应在温度为K时的压强平衡常数kPa(保留一位小数)。
(4)、Ⅲ.中国科学院大连化学物理研究所利用金属氧化物和分子筛的复合催化剂(OXZEO)实现了合成气(CO、)转化为低碳烯烃,反应过程如图所示:
该图显示,CO吸附到金属氧化物表面,碳氧键被“剪断”变成O原子和C原子,与C原子反应形成烃类中间体,该烃类中间体的电子式为。该中间体通过碳原子的链式增长,生成各种烯烃。该反应机理中,碳原子的链式增长的位置为(填字母)。
A.金属氧化物表面 B.金属氧化物与分子筛之间的气体氛围中
C.分子筛表面 D.分子筛的孔道中
-
13、无水氯化铬()是有机合成和无机合成的重要原料,实验室中可采用含水氧化铬制备无水氯化铬。制备步骤如下:
ⅰ.组装好装置,检验装置气密性,向瓷舟中加入。
ⅱ.向体系中通入干燥纯净的一段时间。
ⅲ.使通过 , 进入到硬质玻璃管中,同时打开管式炉,对反应物加热。
ⅳ.制备实验结束后,继续通入纯净的 , 直至产物冷却为室温,硬质玻璃管右端有紫色薄片出现。
ⅴ.检测产品纯度。
实验装置如图所示:

已知相关部分物质的性质如下表:
无水氯化铬()
紫色晶体,950℃升华,易溶于水
绿色粉末固体,熔点2435℃,高温下能被氧化
无色液体,沸点:76~77℃
光气()
无色气体,剧毒,遇水水解:
回答下列问题:
(1)、步骤ⅰ中,检验装置B气密性的方法是。(2)、步骤ⅱ中,通入纯净的时,请描述、、的关闭或打开状态:。(3)、管式炉中,先失水转化为 , 然后与反应,除目标产物外,还产生光气,生成目标产物的化学方程式是。该实验中为了得到足够浓度的气态 , 可采取的方法为。(4)、反应过程中,通入的作用是。(5)、装置C中NaOH溶液的作用是(用离子方程式表示)。(6)、该装置存在的弊端有(填两条)。 -
14、乙二胺(H2NCH2CH2NH2 , 用EDA表示)是一种重要的化工原料,应用于印染工业、电镀、农药制备、医药生产等。常温下,向锥形瓶中加入20.0mL 0.1mol/L乙二胺的盐酸盐(EDAH2Cl2)溶液,并向其中加入NaOH固体,锥形瓶混合液体系中lgc[指lgc(EDA)、、]、与溶液的pOH[]的关系如图所示。下列说法错误的是( )
 A、甲为的变化曲线 B、乙二胺的一级电离常数 C、a点溶液的pH=7.2 D、d点溶液中:
A、甲为的变化曲线 B、乙二胺的一级电离常数 C、a点溶液的pH=7.2 D、d点溶液中: -
15、中国科学院武汉物理与数学研究所在甲烷和一氧化碳催化转化制备有机物X的反应机理(如图)研究方面取得重要进展。下列说法错误的是( )
 A、有机物X可用作厨房中的调味剂 B、中间体和中C的化合价不同 C、反应②过程中存在键的断裂 D、过程⑤的反应为
A、有机物X可用作厨房中的调味剂 B、中间体和中C的化合价不同 C、反应②过程中存在键的断裂 D、过程⑤的反应为
-
16、中国从人工合成淀粉被国际学术界认为是影响世界的重大颠覆性技术,合成步骤由60多步缩减到11步,突破了自然界淀粉合成的复杂调控障碍。其中加氢的主要反应如下。
反应ⅰ:
反应ⅱ:
向密闭容器中通入的混合气体,在不同压强(、)、不同温度下,平衡体系中的转化率、和CO的选择性随温度的变化如图所示。

下列说法错误的是( )
A、压强: B、曲线①、⑤分别表示平衡体系中的选择性和的转化率 C、235℃时,m点体系中 D、随着温度升高,与的平衡转化率之比先减小后增大 -
17、含氮废水中氮元素有铵态氮和硝态氮两种形式,利用铁碳微电池法在弱酸性条件下进行电化学处理,可同时除去铵态氮和硝态氮,该电化学装置的工作原理如图所示。下列说法正确的是( )
 A、该装置工作时,碳电极附近pH增大 B、该装置工作时,移向碳电极附近 C、Fe电极为负极,电极反应为 D、理论上消耗的与的物质的量之比为5∶3
A、该装置工作时,碳电极附近pH增大 B、该装置工作时,移向碳电极附近 C、Fe电极为负极,电极反应为 D、理论上消耗的与的物质的量之比为5∶3 -
18、一种钇钡铜氧化物为黑色固体,能作高温超导体,应用广泛,其晶体结构单元如图所示。设表示阿伏加德罗常数的值,下列说法错误的是( )
 A、基态的价电子轨道表示式为
A、基态的价电子轨道表示式为 B、该晶体的化学式为
C、与等距离且距离最近的为8个
D、该晶体的密度为
B、该晶体的化学式为
C、与等距离且距离最近的为8个
D、该晶体的密度为
-
19、海水综合利用后的一种卤水中含NaCl、LiCl及少量的、、等,利用该卤水制备的简要流程如图所示(第一次加入纯碱的量以不损失Li,其他离子尽量除去为标准):

已知:
①卤水中、;。
②的溶解度随温度升高而降低。
③常温下,几种难溶物质的溶度积数据如下表:
物质
下列说法错误的是( )
A、滤渣中含有、和 B、在实验室中分离出滤渣需要的玻璃仪器主要为漏斗、玻璃棒和烧杯 C、“沉淀池Ⅱ”中滴加烧碱前, D、从“沉淀池Ⅲ”中析出的需用热水洗涤 -
20、中山大学药学院巫瑞波、罗海彬和广州中医药大学中药学院何细新等人合作报道了PDE4抑制剂(抑制炎症的一种药物)的优化(过程如图所示)。下列说法错误的是( )
 A、甲中碳原子有两种杂化类型 B、乙分子中含5种官能团 C、等物质的量的甲、乙分别与过量反应,消耗的物质的量之比为3∶2 D、该药物的优化过程只涉及取代反应和加成反应
A、甲中碳原子有两种杂化类型 B、乙分子中含5种官能团 C、等物质的量的甲、乙分别与过量反应,消耗的物质的量之比为3∶2 D、该药物的优化过程只涉及取代反应和加成反应