-
1、乙烯的产量是一个国家石油化工水平的重要标志,研究制备乙烯的原理具有重要的意义,科学家研究出各种制备乙烯的方法。(1)、Ⅰ.由乙烷直接脱氢或氧化脱氢制备,原理如下:
直接脱氢:
氧化脱氢:
已知键能 , , 生成1mol碳碳π键放出的能量为kJ,从热力学角度比较直接脱氢和氧化脱氢,氧化脱氢法的优点为。(2)、一定温度下,在恒容密闭容器中充入一定量的和 , 维持初始压强 , , 发生上述两个反应。2.5min时, , , 则用的分压变化表示直接脱氢反应的平均速率为;反应一段时间后,和的消耗速率比小于2:1的原因为。(3)、Ⅱ.利用乙炔和氢气催化加成制备乙烯,发生如下反应:①
②
保持压强为20kPa条件下,按起始投料 , 匀速通入装有催化剂的反应器中发生反应①和②,测得不同温度下和的转化率如右图实线所示(图中虚线表示相同条件下平衡转化率随温度的变化)。

表示转化率的曲线是(填“m”或“n”)。
(4)、随着温度的升高,m和n两条曲线都是先升高后降低,其原因是。(5)、时,两种物质的转化率分别为0.75、0.5,反应①的平衡常数。 -
2、实验室利用固体和反应制备无水 , 并收集该反应产生的光气(),实验装置如图所示(夹持及加热装置已省略)。

已知:
Ⅰ.光气与水易反应,能溶于溶液;
Ⅱ.有关物质熔沸点如下表。
物质
熔点/℃
1435
1152
-23
-118
沸点/℃
4000
1300
76
8.2
(1)、仪器c的名称是 , d中所装试剂为。(2)、组装好装置并检查装置气密性,保持、、处于打开状态,然后通入 , 此时通入的目的是。(3)、通入一段时间后,保持、打开,关闭 , 将装置A在85℃下进行水浴加热,此时B中发生反应的化学方程式为 , 待B中反应结束后,停止高温加热,将装置C在30℃下进行水浴加热,此时开关、、的状态分别为 , 温度计显示的温度为℃。(4)、实验结束后,E中溶质除了有NaOH,还含有(填化学式)。(5)、称取B中所得产品6.34g溶于水配制成250mL溶液,取25.00mL样品溶液于带塞的锥形瓶中,加入稀硫酸,完全溶解后加入NaOH溶液形成绿色的沉淀后,再加入过量 , 小火加热至沉淀完全转变为溶液后,继续加热一段时间,再滴入指示剂,用新配制的0.20 的溶液进行滴定,到达滴定终点时,消耗溶液36.00mL。①写出加入过量后反应的离子方程式。
②产品中质量分数为 , 若沉淀完全转变为溶液后,不继续加热一段时间会导致质量分数(填“偏高”“偏低”或“不变”)。
-
3、镍及其化合物在工业上有广泛的应用。工业上用镍矿渣(主要含、NiS,还含FeO、、MgO、CaO和)制备的过程如图所示(已知:溶液中金属离子开始沉淀和完全沉淀的pH如下表)。

金属离子
开始沉淀时的pH
6.8
2.2
7.5
9.4
沉淀完全时的pH
9.2
3.2
9.0
12.4
(1)、的价电子排布式为;电离一个电子需要吸收的能量(填“大于”或“小于”)。(2)、“酸溶”过程中,NiS发生反应的离子方程式为;如何判断已足量:(写出具体操作过程)。(3)、滤渣1的成分有。(4)、滤渣3的成分为和。若滤液1中 , 当滤液2中时,除钙率为(忽略沉淀前后溶液体积变化)。(已知:、)(5)、“滤液2”加入碳酸钠溶液后所得沉淀可表示为。进行下列实验:称取干燥沉淀样品3.41g,隔绝空气加热,剩余固体质量随温度变化的曲线如图所示(500℃~750℃条件下加热,收集到的气体产物只有一种,750℃以上残留固体为NiO),则该样品的化学式为。 (6)、资料显示,硫酸镍结晶水合物的形态与温度有如表关系。由溶液获得稳定的晶体的操作M依次是蒸发浓缩、、过滤、洗涤、干燥。
(6)、资料显示,硫酸镍结晶水合物的形态与温度有如表关系。由溶液获得稳定的晶体的操作M依次是蒸发浓缩、、过滤、洗涤、干燥。温度
低于30.8℃
30.8℃~53.8℃
53.8℃~280℃
280℃
晶体形态
多种结晶水合物
-
4、甲烷是一种温室气体,将它转化为高附加值产品甲醇具有重要意义。目前工业上的甲烷转化大多需要先通过重整生成合成气(CO、)再转化为甲醇,涉及的反应如下:
反应Ⅰ:
反应Ⅱ:
在密闭容器中通入3mol 和2mol , 假设只发生反应Ⅰ和Ⅱ,分别在0.2MPa和2MPa下进行反应,其中和的平衡体积分数随温度变化如图所示。

已知:对于反应Ⅱ, , , 、为速率常数,只与温度有关,分压=总压×物质的量分数。下列说法不正确的是( )
A、压强为0.2MPa时,表示和的曲线分别是b、d B、混合气体的平均相对分子质量保持不变时,说明反应体系已达到平衡 C、在升温的过程中,反应Ⅱ速率常数增大的倍数;> D、500K,2MPa条件下,若平衡时CO的物质的量为1mol,则的转化率约为66.7% -
5、工业上用双极膜电解槽电解糠醛溶液同时制备糠醇和糠酸盐,电解过程如图所示。下列说法不正确的是( )
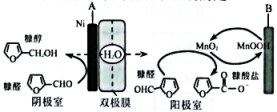 A、电解时,阴极反应为
A、电解时,阴极反应为 B、理论上外电路中迁移2mol电子,消耗1mol糠醛
C、电解时,和MnOOH在电极与糠醛之间传递电子
D、生成糠酸盐的离子反应方程式为
B、理论上外电路中迁移2mol电子,消耗1mol糠醛
C、电解时,和MnOOH在电极与糠醛之间传递电子
D、生成糠酸盐的离子反应方程式为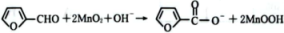
-
6、氮化钛晶体的立方晶胞结构如图所示,该晶胞中N、N之间的最近距离为a pm,以晶胞边长为单位长度建立坐标系,原子A的坐标参数为(0,0,0),下列说法错误的是( )
 A、原子B的坐标参数为 B、晶胞边长是pm C、该物质的化学式为TiN D、Ti的配位数为6
A、原子B的坐标参数为 B、晶胞边长是pm C、该物质的化学式为TiN D、Ti的配位数为6 -
7、下列实验中采取的分离或提纯方法能达到实验目的的是( )
选项
实验目的
分离或提纯方法
A
分离碘的四氯化碳溶液中的碘
用苯萃取
B
除去乙酸乙酯中的乙酸
加入饱和溶液后分液
C
除去蛋白质溶液中少量NaCl
过滤
D
从高级脂肪酸钠和甘油的混合水溶液中分离出高级脂肪酸钠
加入乙醇和浓硫酸并加热,然后蒸馏
A、A B、B C、C D、D -
8、25℃时,的电离常数。在10.0mL 0.10mol/L的溶液中加入5.0mL 0.10mol/L的NaOH溶液。下列说法不正确的是( )A、该混合溶液呈酸性 B、该混合溶液中: C、0.10mol/L的溶液中 D、将0.10mol/L的溶液加水稀释,增大
-
9、X、Y、Z、Q、W是原子序数依次增大的前四周期元素,其中X是宇宙中含量最多的元素;在同周期元素中,第一电离能数值比Y大的元素有2种:Z元素原子的价层电子排布是;Q、W元素原子的最外层均只有1个电子,Q元素的原子半径是前四周期中最大的,W元素基态原子内层轨道均排满电子。下列说法正确的是( )A、电负性: B、属于酸性氧化物 C、Q与Z可以形成多种化合物 D、W元素位于元素周期表的d区
-
10、下列实验装置、试剂选用和操作正确的是( )




A.制备并干燥收集
B.制备氢氧化铁胶体
C.从NaCl溶液中获得NaCl晶体
D.干燥氯气
A、A B、B C、C D、D -
11、有机化合物Ⅱ是一种药物中间体,可用有机化合物Ⅰ制得。下列有关有机化合物Ⅰ、Ⅱ的说法正确的是( )
 A、有机物Ⅰ的分子式为 B、Ⅰ的分子中所有原子处于同一平面 C、可以用酸性溶液鉴别Ⅰ和Ⅱ D、反应Ⅰ→Ⅱ的原子利用率为100%
A、有机物Ⅰ的分子式为 B、Ⅰ的分子中所有原子处于同一平面 C、可以用酸性溶液鉴别Ⅰ和Ⅱ D、反应Ⅰ→Ⅱ的原子利用率为100% -
12、铅丹()可用作防锈涂料,它与浓盐酸反应的化学方程式为:。设为阿伏加德罗常数值。下列说法不正确的是( )A、标准状况下,22.4L 溶于水所得溶液中含HClO分子数为 B、1L 12的浓盐酸与足量反应生成的分子数少于1.5 C、标准状况下,22.4L 中,含有H原子数目大于2 D、反应中消耗137g , 转移的电子数目为0.4
-
13、Ni单原子催化剂具有良好的电催化性能,催化转化的历程如下图。下列说法正确的是( )
 A、过程①→②中C的杂化方式都是 B、过程②→③涉及极性键的断裂与生成 C、生成1mol CO,需要1mol电子 D、从反应历程看,Ni未参与反应
A、过程①→②中C的杂化方式都是 B、过程②→③涉及极性键的断裂与生成 C、生成1mol CO,需要1mol电子 D、从反应历程看,Ni未参与反应 -
14、下列有关物质性质与用途具有对应关系的是( )A、熔点高,可用于做耐高温材料 B、显碱性,可用作制冷剂 C、受热易分解,可用作氮肥 D、具有氧化性,可用于自来水的杀菌消毒
-
15、下列各组离子在指定溶液中一定能大量共存的是( )A、氨水溶液中:、、、 B、0.1 KI溶液中:、、、 C、能使甲基橙变红的溶液中:、、、 D、0.1 溶液中:、、、
-
16、我国科研团队对嫦娥五号月壤的研究发现,月壤中存在一种含“水”矿物。下列化学用语或图示不正确的是( )A、的电子式: B、P原子的结构示意图:
 C、的空间结构模型:
C、的空间结构模型: D、的VSEPR模型:
D、的VSEPR模型:
-
17、央视纪录片《如果国宝会说话》中介绍了很多文物,其中主要成分属于硅酸盐的是( )




A.江西省博物馆藏青铜钺
B.霍去病墓石刻
C.素纱禅衣
D.跪射俑
A、A B、B C、C D、D -
18、电池的发明和应用是化学家们对人类社会的重要贡献之一。每一次化学电池技术的突破,都带来了电子设备革命性的发展。最近,我国在甲烷燃料电池的相关技术上获得了新突破,原理如下图所示:
 (1)、通甲烷燃料一极的电极反应式为。(2)、以石墨做电极电解Na2SO4溶液,如图2所示,电解开始后先出现红色的一极的电极反应式为。(3)、随着电池使用范围的日益扩大,废旧电池潜在的污染已引起社会各界的广泛关注。工业上为了处理含有Cr2O72-的酸性工业废水,用绿矾(FeSO4·7H2O)把废水中的六价铬离子还原成三价铬离子,再加入过量的石灰水,使铬离子转变为Cr(OH)3沉淀。
(1)、通甲烷燃料一极的电极反应式为。(2)、以石墨做电极电解Na2SO4溶液,如图2所示,电解开始后先出现红色的一极的电极反应式为。(3)、随着电池使用范围的日益扩大,废旧电池潜在的污染已引起社会各界的广泛关注。工业上为了处理含有Cr2O72-的酸性工业废水,用绿矾(FeSO4·7H2O)把废水中的六价铬离子还原成三价铬离子,再加入过量的石灰水,使铬离子转变为Cr(OH)3沉淀。
①氧化还原过程的离子方程式为。
②常温下,Cr(OH)3的溶度积Ksp=1×10-32 mol4·L-4 , 溶液的pH至少为 , 才能使Cr3+沉淀完全(溶液中离子浓度小于10-5 mol/L时,可视为完全沉淀)。(4)、人工肾脏可采用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图。
①电源的正极为(填“A”或“B”)。
②电解结束后,阴极室溶液的pH与电解前相比将(填“增大”、“减小”、“不变”);若收集到H2 2.24L(标准状况),则通过质子交换膜的H+数目为(忽略气体的溶解)。
-
19、(1)、I.肼()可用做发射卫星的火箭燃料。已知:
①
②
写出气态肼和生成氮气和水蒸气的热化学方程式。
(2)、Ⅱ.硫酸是一种重要的基础化工产品,接触法制硫酸生产中的关键工序是SO2的催化氧化: 。回答下列问题。某温度下,在体积为的刚性密闭容器中投入2molSO2和3.5molO2 , 下图是n(SO2)和n(SO3)随时间的变化曲线。

①0~10min,v(SO3)=。
②反应达到平衡时,平衡常数K=。(保留3位有效数字)
③下列情况不能说明反应达到化学平衡状态的是。
A.v(SO3)=2v(O2) B.混合气体的相对分子质量不再变化
C.体系的压强不再发生改变 D.混合气体的密度保持不变
(3)、当SO2(g)、O2(g)和N2(g)起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa和5.0MPa压强下,SO2平衡转化率α随温度的变化如下图所示。反应在5.0MPa、550℃时的α= , 影响α的因素有温度、压强和。

-
20、研究电解质在水溶液中的平衡能了解它的存在形式。(1)、已知部分弱酸的电离常数如下表:
化学式
HF
H2CO3
H2S
电离平衡常数K(25℃)
Ka=7.2×10-4
Ka1 =4.4×10-7
Ka1 =9.1×10-8
Ka2 =4.7×10-11
Ka1 =1.1×10-12
①写出H2S的Ka1的表达式:Ka1 = 。
②常温下,浓度相同的三种溶液NaF、Na2CO3、Na2S,pH最小的是。
③将过量H2S通入Na2CO3溶液,反应的离子方程式是。
(2)、室温下,用0.100mol•L-1 盐酸滴定20.00mL 0.100mol•L-1的氨水溶液,滴定曲线如图1所示。(忽略溶液体积的变化)①a点所示的溶液中c(NH3•H2O)(填“>”、“<”或“=”,下同)c(Cl-)。
②b点所示的溶液中c(Cl-)c(NH4+)。
③室温下pH=11的氨水与pH=5的NH4Cl溶液中,由水电离出的c(H+)之比为。

 (3)、二元弱酸H2A溶液中H2A、HA-、A2-的物质的量分数随pH的变化如图2所示。则H2A第二级电离平衡常数Ka2=。
(3)、二元弱酸H2A溶液中H2A、HA-、A2-的物质的量分数随pH的变化如图2所示。则H2A第二级电离平衡常数Ka2=。