-
1、下列装置适用于实验室制氨气并验证氨气的性质,其中能达到实验目的的是( )
 A、用装置甲制取氨气 B、用装置乙除去氨气中的水蒸气 C、丙的原理为 D、装置丁中,干燥烧瓶内盛有氨气,烧杯和胶头滴管内盛有水(含酚酞),打开止水夹,挤压胶头滴管的胶头,会出现蓝色喷泉
A、用装置甲制取氨气 B、用装置乙除去氨气中的水蒸气 C、丙的原理为 D、装置丁中,干燥烧瓶内盛有氨气,烧杯和胶头滴管内盛有水(含酚酞),打开止水夹,挤压胶头滴管的胶头,会出现蓝色喷泉 -
2、室温下,在透明的强酸性溶液中能大量共存的离子组是( )A、、、Mg2+、SO42- B、Na+、NH、Cl-、 C、、、Fe2+、NO3- D、Na+、、、HSO
-
3、下列因果关系正确是( )A、浓硫酸有脱水性,用浓硫酸可除去 N2中的水蒸气 B、浓硝酸见光易分解,浓硝酸要保存在棕色试剂瓶里 C、氢氟酸具有弱酸性,氢氟酸可用来刻蚀玻璃 D、氨气液化时吸收大量的热,液氨常用作制冷剂
-
4、下列说法正确的是( )A、泡菜中的微生物将硝酸盐还原为亚硝酸盐的过程,属于氮的固定 B、石英玻璃、碳化硅陶瓷、水泥、石墨烯都是硅酸盐材料 C、高纯硅可用于制作计算机芯片的材料 D、“钡餐”的主要成分为BaCO3
-
5、砷化镓是一种半导体化合物,可用于太阳能电池。一种砷化镓废料(主要成分为GaAs,含、、等杂质)中回收单质镓和砷的化合物的工艺流程如图所示。

已知:①“碱浸”时,GaAs中Ga以的形式进入溶液。
②离子完全沉淀时的pH:为8,为5.6。
(1)、第一电离能比较:AsGa(填“<”“>”或“=”,下同),原子半径比较:AsGa。(2)、下图为砷化镓晶胞,白球所代表原子的配位数是。已知:晶胞参数为apm,密度为 , 则阿伏加德罗常数可表示为(用含a、d的式子表示)。 (3)、“碱浸”时,GaAs参加的离子方程式为。(4)、“调pH①”时,pH=最合适;滤液②的溶质成分为(写化学式)。(5)、写出用情性电极电解制备镓单质的电极反应方程式:。
(3)、“碱浸”时,GaAs参加的离子方程式为。(4)、“调pH①”时,pH=最合适;滤液②的溶质成分为(写化学式)。(5)、写出用情性电极电解制备镓单质的电极反应方程式:。 -
6、冬季下雪天气,使用道路融冰剂消除冰雪保证交通安全。氯化钙是道路融冰剂的主要成分,某实验小组欲测定市售融冰剂中氯化钙的纯度,进行如下实验:
步骤一:取10.0g样品,加入适量水溶解,配成溶液。
步骤二:将上述所得溶液加水稀释,最后定容至。
步骤三:每次取25.00mL待测液于锥形瓶中,加入1-2滴指示剂,用(硝酸酸化)标准液进行滴定,重复滴定三次。
回答下列问题:
(1)、使用碱式滴定管量取待测液。排出碱式滴定管中气泡的方法应采用如图所示操作中的 , 然后小心操作使尖嘴部分充满待测液。 (2)、用标准液进行滴定时,下列试剂可作为该滴定实验指示剂的是____(填“A”或“B”) [已知为白色沉淀,]A、溶液[砖红色沉淀,] B、溶液[黑色沉淀,](3)、滴定时注意观察锥形瓶内沉淀颜色的变化,根据(2)中所选指示剂判断滴定达到终点的依据是。(4)、表示指示剂酸根离子,达到滴定终点时溶液中。(5)、滴定结果如表,第1次滴定读数如图:
(2)、用标准液进行滴定时,下列试剂可作为该滴定实验指示剂的是____(填“A”或“B”) [已知为白色沉淀,]A、溶液[砖红色沉淀,] B、溶液[黑色沉淀,](3)、滴定时注意观察锥形瓶内沉淀颜色的变化,根据(2)中所选指示剂判断滴定达到终点的依据是。(4)、表示指示剂酸根离子,达到滴定终点时溶液中。(5)、滴定结果如表,第1次滴定读数如图:
滴定次数
待测液体积/mL
标准溶液的体积/mL
滴定前刻度
滴定终点刻度
1
25.00
a
b
2
25.00
0.00
20.00
3
25.00
0.20
20.10
第1次滴定终点时读数为;该市售融冰剂中氯化钙的纯度为。
(6)、下列操作会导致氯化钙的纯度测定结果偏高的是____。A、待测液定容时仰视刻度线 B、滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出 C、盛装标准液的滴定管没有用标准液润洗 D、滴定前滴定管尖嘴处有气泡,滴定后消失 -
7、X、Y、Z、W、P、Q是元素周期表前四周期的六种常见元素,原子序数依次增大。X在自然界中有多种同素异形体,其中一种是自然界中最硬的单质;Z是地壳中含量最多的元素;W基态原子核外的9个原子轨道上填充了电子,且有1个未成对电子;P是常见的金属元素,它的某种氧化物可用作红色颜料;Q基态原子的3d层全充满,N层没有成对电子。(1)、P、Q中位于周期表的d区的是(填元素符号,下同),基态Q原子的价层电子排布式为; 元素X、Y、Z中,电负性最大的是。(2)、烃的1个分子中含有个σ键;X和Y的简单氢化物中沸点更高的是(填化学式),理由是(答2点)。(3)、化合物可用作杀菌消毒剂和漂白剂,分子的中心原子杂化类型是;工业上可用W的单质与潮湿的碳酸钠反应制取 , 并生成另外两种含钠的化合物,反应中无其它气体生成,写出该反应的化学方程式。
-
8、Ⅰ肼可作为火箭发动机的燃料,与N2O4反应生成N2和水蒸气。已知:
①N2(g)+2O2(g)=N2O4(l) ΔH1=−19.5 kJ· mol−1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=−534 kJ· mol−1
(1)、写出肼(l)和N2O4(l)完全反应生成N2和水蒸气时的热化学方程式:。(2)、已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,O—H为462,则断裂1 mol N—H键所需的能量是 kJ。(3)、Ⅱ.一定条件下铁可以和CO2发生反应Fe(s)+CO2 (g)FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度变化与时间的关系如图所示。
t1 min时,反应速率的大小关系为v正 (CO2)v逆 (CO2 )(填“>”“<”或“=”)。
(4)、0~4min内,CO2的转化率为(保留三位有效数字) ,CO的平均反应速率为。(5)、下列选项能说明上述反应已达平衡状态的是____(填字母)。A、v(CO2)=v(CO) B、单位时间内生成n mol Fe的同时生成n mol FeO C、容器中气体压强不随时间的变化而变化 D、容器中CO2浓度不随时间的变化而变化(6)、燃料电池因具有发电效率高。环境污染少等优点而备受人们关注。用于笔记本电脑的甲醇(CH3OH)燃料电池示意图如下,a是极,此电极反应为。
-
9、氟化钾镁是一种具有优良光学性能的材料,主要应用于激光领域,其立方晶胞结构如图。表示阿伏加德罗常数的值。下列说法错误的是( )
 A、的配位数为12 B、若位于晶胞的体心,则位于晶胞的面心 C、每个位于距其最近且等距的构成的正四面体空隙中 D、若晶胞参数为a nm,则晶体的密度是
A、的配位数为12 B、若位于晶胞的体心,则位于晶胞的面心 C、每个位于距其最近且等距的构成的正四面体空隙中 D、若晶胞参数为a nm,则晶体的密度是 -
10、短周期主族元素W、X、Y、Z的原子序数依次增大,W的最高正价与最低负价代数和为0,W、X、Y形成的化合物甲的结构如图所示,Z原子M层上有2个未成对电子且此能级无空轨道。下列说法正确的是( )
 A、简单离子半径大小: B、简单氢化物的沸点: C、是由极性键构成的极性分子 D、甲中阴离子的空间构型为三角锥形
A、简单离子半径大小: B、简单氢化物的沸点: C、是由极性键构成的极性分子 D、甲中阴离子的空间构型为三角锥形 -
11、常温下,二氧化氯(ClO2)是一种黄绿色气体,具有强氧化性,其中心原子Cl为SP2杂化已被联合国卫生组织(WTO)列为Al级高效安全消毒剂,其中心原子Cl为SP2杂化。已知,工业上制备二氧化氯的方法之一是用甲醇在酸性条件下与氯酸钠反应,其反应的化学方程式:CH3OH+6NaClO3+3H2SO4=CO2↑+6ClO2↑+3Na2SO4+5H2O,则下列说法错误的是( )A、CO2是非极性分子 B、键角:ClO3-<ClO2- C、CH3OH在反应中发生氧化反应 D、ClO2分子空间构型为V形
-
12、某科研人员提出HCHO与在羟基磷灰石(HAP)表面催化氧化生成 , 的历程,该历程示意图如图(图中只画出了HAP的部分结构)所示。下列说法正确的是( )
 A、HAP降低了该反应的焓变() B、反应过程中,发生了非极性键的断裂和生成 C、HCHO在反应过程中,无键发生断裂 D、和的中心原子上所含孤电子对数不同
A、HAP降低了该反应的焓变() B、反应过程中,发生了非极性键的断裂和生成 C、HCHO在反应过程中,无键发生断裂 D、和的中心原子上所含孤电子对数不同 -
13、观察下列模型并结合信息,判断有关说法错误的是( )
石英
FeSO4·7H2O
S8分子
HCN
结构模型示意图



 A、石英属于共价晶体,且两原子个数比为2:1 B、FeSO4·7H2O结构中键角1、2、3由大到小的顺序:3>1>2 C、固态硫S8中S原子为sp2杂化 D、HCN的结构式为
A、石英属于共价晶体,且两原子个数比为2:1 B、FeSO4·7H2O结构中键角1、2、3由大到小的顺序:3>1>2 C、固态硫S8中S原子为sp2杂化 D、HCN的结构式为 -
14、氨硼烷(NH3BH3)在一定条件下与水反应: , 的结构如图所示,已知H的电负性为2.1,B的电负性为2.0,下列说法正确的是( )
 A、NH3BH3分子中存在配位键,B原子提供孤电子对 B、1molNH3BH3发生反应时转移3mole- C、反应产物中只含有离子键、配位键和非极性共价键 D、反应过程中B原子的杂化方式由sp2变为sp3
A、NH3BH3分子中存在配位键,B原子提供孤电子对 B、1molNH3BH3发生反应时转移3mole- C、反应产物中只含有离子键、配位键和非极性共价键 D、反应过程中B原子的杂化方式由sp2变为sp3 -
15、下列有关化学用语表示正确的是( )A、
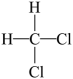 和
和 为同种物质
B、乙烷的结构式:
C、的电子式:
为同种物质
B、乙烷的结构式:
C、的电子式: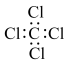 D、
D、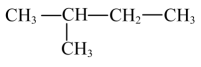 与
与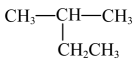 互为同分异构体
互为同分异构体
-
16、某有机物的结构如图所示,则下列说法中正确的是( )
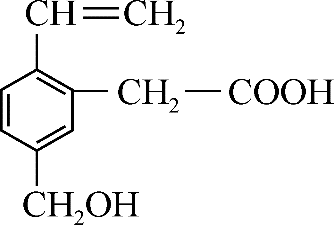 A、1mol该有机物能与2mol Na反应 B、该有机物能发生加成反应但不能发生取代反应 C、该有机物中有4种官能团 D、该有机物能使溴的四氯化碳溶液褪色,不能使酸性高锰酸钾溶液褪色
A、1mol该有机物能与2mol Na反应 B、该有机物能发生加成反应但不能发生取代反应 C、该有机物中有4种官能团 D、该有机物能使溴的四氯化碳溶液褪色,不能使酸性高锰酸钾溶液褪色 -
17、水生生物参与氮循环过程示意图如图所示。下列说法正确的是( )
 A、与分子中N原子的杂化类型、共价键类型均完全相同 B、反应②③⑥中N元素皆被氧化 C、与过程中转移电子的数目相同 D、水生生物的氮循环,既可以为其他生物提供营养物质,又可以减轻水体富营养化
A、与分子中N原子的杂化类型、共价键类型均完全相同 B、反应②③⑥中N元素皆被氧化 C、与过程中转移电子的数目相同 D、水生生物的氮循环,既可以为其他生物提供营养物质,又可以减轻水体富营养化 -
18、科学家已获得极具理论研究意义的N4分子,其结构为正四面体(如下图所示),与白磷分子相似。已知断裂1 mol N-N键吸收193 kJ热量 ,形成1 mol N≡N叁键放出941 kJ热量,则 ( )
 A、N4分子中的N是SP2杂化 B、N4是极性分子 C、N4和N2互为同分异构体 D、1 mol N4气体转化为N2时放出724 kJ 能量
A、N4分子中的N是SP2杂化 B、N4是极性分子 C、N4和N2互为同分异构体 D、1 mol N4气体转化为N2时放出724 kJ 能量 -
19、下列有关物质结构的表述正确的是( )A、次氯酸的电子式:
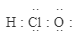 B、As(砷)的简化电子排布式:
C、铜原子价电子轨道表示式:
B、As(砷)的简化电子排布式:
C、铜原子价电子轨道表示式: D、的结构示意图:
D、的结构示意图:
-
20、下列说法错误的是( )A、基态Al原子核外电子的空间运动状态有7种 B、亚硫酸氢钠溶液显酸性的原因: C、中的键角小于中的键角 D、蒸干溶液并灼烧所得固体可最终得到