-
1、某高性能锂硫电池的电池总反应式为 , 装置如图所示。已知:阳离子交换膜只允许阳离子通过。下列关于电池放电时的叙述正确的是( )
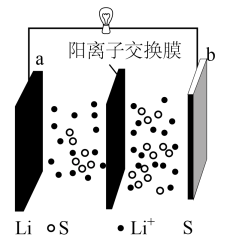 A、化学能全部转化成电能 B、电子由b极经外电路流向a极 C、负极反应式为 D、a极氧化锂时失去电子
A、化学能全部转化成电能 B、电子由b极经外电路流向a极 C、负极反应式为 D、a极氧化锂时失去电子 -
2、部分含铁物质的“价一类”关系如图所示。下列叙述错误的是( )
 A、的转化均能通过一步反应实现 B、在沸水中滴加e的饱和溶液可制备d的胶体 C、在高温下a与水蒸气反应生成b和 D、工业上,可用e溶液刻蚀铜电路板
A、的转化均能通过一步反应实现 B、在沸水中滴加e的饱和溶液可制备d的胶体 C、在高温下a与水蒸气反应生成b和 D、工业上,可用e溶液刻蚀铜电路板 -
3、下列离子方程式错误的是( )A、向稀硫酸中滴加溶液产生白色沉淀: B、将通入冷的石灰乳中制备漂白粉: C、用稀盐酸清洗水垢中的 D、向溶液中加入
-
4、工业上,可用纯碱溶液吸收硝酸厂排放的尾气中的 , 并实现资源再利用。有关反应如下:
①
②
③
下列叙述正确的是( )
A、常温下溶解度: B、和的混合气体一定能被溶液完全吸收 C、用澄清石灰水可以区分和溶液 D、①、②、③中氧化剂与还原剂的物质的量之比均为 -
5、下列各组离子在指定溶液中能大量共存的是( )A、溶液中: B、氨水中: C、溶液中: D、溶液中:
-
6、明朝于谦托物言志创作了《石灰吟》,描述了之间的转化过程:
①千锤万凿出深山,②烈火焚烧若等闲。③粉骨碎身浑不怕,④要留清白在人间。
下列有关《石灰吟》解读错误的是( )
A、①中只含离子键 B、②中反应生成的属于非电解质 C、③中涉及非氧化还原反应 D、④中石灰乳吸收生成 -
7、哲学中“量变引起质变”规律广泛应用于化学反应。下列反应不符合这一规律的是( )A、铁和稀硝酸反应 B、碳酸钠和盐酸反应 C、氨水吸收尾气中 D、硫和铜在加热条件下反应
-
8、2024年“两会”第一次将“新质生产力”写进政府工作报告。新能源与新质生产力密切相关。下列对能源分类错误的是( )A、化石能源:煤、石油、天然气 B、可再生能源:沼气、水能、煤 C、新能源:生物质能、地热能、海洋能 D、清洁能源:太阳能、风能和氢能
-
9、化学与生产、生活息息相关。下列叙述错误的是( )A、工业上可用液氨作制冷剂 B、可用浓氨水检验输送的管道是否泄漏 C、二氧化硅常用于制作太阳能电池板 D、灿烂美丽的烟花是某些金属的焰色试验,焰色试验属于物理变化
-
10、研究发现,氧化物负载的M氧化物纳米粒子和等元素纳米粒子催化剂在合成淀粉过程中有较高的催化活性。以和为主要原料人工合成淀粉涉及的部分反应如下:
反应i:
反应ii:
(1)、在元素周期表中的位置为 , 基态原子核外电子占据的最高能级的原子轨道形状为。(2)、第一电离能: , 其原因是。(3)、反应ii中,中π键的形成方式为(填“肩并肩”或“头碰头”),的同素异形体为(填“极性”或“非极性”)分子。(4)、三者的沸点从高到低的顺序为 , 原因是。(5)、具有型结构(如图),的配位数为;已知的晶胞参数 , 则的半径为。
-
11、应对雾霾污染、改善空气质量需要从多方面入手,如开发利用清洁能源。甲醇是一种可再生的清洁能源,具有广阔的开发和应用前景。(1)、已知反应:① ;
②。
则③中的(用含的式子表示),(用含的式子表示),该反应中每消耗 , 此时转移的电子数为。
(2)、一定条件下用和合成。在恒容密闭容器中充入和 , 在催化剂作用下充分反应,平衡时混合物中的体积分数随温度变化的曲线如图所示:
①下列有关反应的说法正确的是(填标号)。
A.该反应的反应物的键能总和小于生成物的键能总和
B.当混合气体的密度不再随时间改变时,该反应达到平衡
C.升高温度,有利于增大的平衡转化率
D.无论反应进行到何种程度,为某一定值
②平衡常数由大到小的顺序为。
③反应速率:(填“>”“<”或“=”)。
④ , b点的平衡常数。
-
12、广泛应用于油漆颜料、合成橡胶、电池、阻燃剂、药膏等产品。某锌矿的主要成分为 , 杂质为等元素的化合物,提取氧化锌的工艺流程如图。

已知:①“焙烧”时金属元素生成硫酸盐。
②下,的的 , 的。
③当离子浓度时,可视为沉淀完全。
回答下列问题:
(1)、为了提高“焙烧”效率,可采取的措施为 , “滤渣1”的主要成分是、(填化学式)。(2)、若考虑环保因素,“氧化除铁”工序加入的X应选择____(填标号)最合适。A、 B、 C、 D、(3)、等浓度的①溶液 ②溶液 ③溶液的从小到大的顺序为(用标号表示)。(4)、室温时,“沉铝”过程发生反应的离子方程式为。用调节溶液的(保留一位小数),“沉铝”完全。(5)、“沉锌”工序中生成沉淀,写出发生反应的离子方程式:;“滤液”的主要成分为 , 经蒸发浓缩结晶,所得晶体可返回“焙烧”工序循环利用,写出结晶过程发生反应的化学方程式:。 -
13、X、Y、Z、Q、W是元素周期表前四周期中常见的五种元素,其原子序数依次增大。基态X原子核外3个能级上有电子,且每个能级上的电子数相等;基态Y原子的s电子与P电子数目相同;Z是电负性最大的元素;基态Q原子的未成对电子数是同周期中最多的;W与Q同周期,W的一种核素的质量数为63,中子数为34。(1)、W的元素符号为 , X原子含有个运动状态不同的电子。(2)、的空间结构为 , 其中Y原子的杂化轨道类型是。(3)、Q的配合物在药物应用、设计合成新磁材料领域和聚乙烯催化剂方面都有重要应用。由Q(III)、、甲基丙烯酸根形成的配合物的结构为[Q2(CH2=C(CH3)-COO)2Cl4∙6H2O]∙2H2O
①甲基丙烯酸中杂化的碳原子与杂化的碳原子的个数之比为 , 甲基丙烯酸钠中含有的化学键类型有。
②过渡元素离子与水形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为或排布时,无颜色;为时,有颜色,如显粉红色。据此判断,(填“有”或“无”)颜色。
-
14、某可充电锂电池总反应为 , 放电时工作原理刻图所示。下列说法错误的是( )
 A、放电时,a极为负极,发生氧化反应 B、放电时,b极上的电极反应为 C、充电时,固态电解质中移向a极 D、充电时,若转移电子,b极质量减小
A、放电时,a极为负极,发生氧化反应 B、放电时,b极上的电极反应为 C、充电时,固态电解质中移向a极 D、充电时,若转移电子,b极质量减小 -
15、常温下,向溶液中逐滴加入溶液,所得溶液的变化曲线如图所示。下列说法错误的是( )
 A、a点溶液中, B、b点溶液中, C、常温下, D、a、b、c三点溶液中,c点溶液中水的电离程度最小
A、a点溶液中, B、b点溶液中, C、常温下, D、a、b、c三点溶液中,c点溶液中水的电离程度最小 -
16、用X射线衍射测定,得到Fe的两种晶胞,其中一种晶胞的结构如图所示,设为阿伏加德罗常数的值。下列说法错误的是( )
 A、离子半径: B、a原子的参数坐标为 C、若晶体的密度为bg⋅cm , 则1个晶胞的体积为cm D、该晶胞的俯视投影图为
A、离子半径: B、a原子的参数坐标为 C、若晶体的密度为bg⋅cm , 则1个晶胞的体积为cm D、该晶胞的俯视投影图为
-
17、锂离子电池、锂离子电容器中一种非水电解液添加剂的结构如图所示。已知X、Y、Z、W为原子序数依次增大的短周期主族非金属元素,其中X、Y、Z处于同一周期且Y、Z为相邻元素,W与X位于不同周期且W的最外层电子数是其内层电子总数的一半。下列说法正确的是( )
 A、的中心原子杂化方式为 B、Z的最高价为价 C、X、W与Y形成的化合物均不止一种 D、第一电离能:
A、的中心原子杂化方式为 B、Z的最高价为价 C、X、W与Y形成的化合物均不止一种 D、第一电离能: -
18、①、②、③是铂的三种配合物,下列说法正确的是( )A、三种配合物中的化合价均为价 B、①中的配位数为6 C、②中为配体,提供空轨道 D、向含③的溶液中加入足量溶液,可得到沉淀
-
19、下列有关分子结构与性质的描述错误的是( )A、三氟乙酸的酸性大于三氯乙酸,三氯乙酸的酸性大于二氯乙酸 B、三种微粒的空间结构和模型都相同 C、都是由极性键构成的非极性分子 D、相同元素原子之间通过共用电子对形成化学键,一般键能越大,键长越短
-
20、下列关于晶体冰、干冰、金刚石的说法正确的是( )A、熔点:金刚石>干冰>冰 B、上述三种晶体的晶体类型相同 C、金刚石熔化时,化学键一定会断裂 D、冰的沸点高于干冰,是因为水分子的键能大于干冰分子的键能