-
1、下列说法中错误的是( )A、破损的晶体放入饱和溶液中会自动变成规则的多面体 B、电子云通常是用小黑点来表示电子出现的概率 C、某固体是否是晶体,可利用X射线衍射判断 D、处于最低能量状态的原子叫基态原子,过程中形成的是发射光谱
-
2、“证据推理与模型认知”是化学学科培养的核心素养之一、下列推论合理的是( )
选项
已知信息
推论
A
分子空间结构为V形
分子中两碳原子和氧原子不在同一直线上
B
电负性:
第一电离能:
C
沸点:
非金属性:
D
原子半径:
离子半径:
A、A B、B C、C D、D -
3、下列生活中的现象或事实与电化学保护法无关的是( )A、铜锣(铜锌合金)不易产生铜绿 B、铺设在隧道中的钢轨每隔一根轨枕系一块锌片 C、家用电热水器不锈钢内胆镶嵌镁棒 D、焊接钢材时,常用饱和溶液处理焊接点
-
4、与足量溶液反应的化学方程式为(已知的结构式为
 )。下列说法错误的是( ) A、是正盐 B、与甲烷的空间结构均为正四面体形,键角均为 C、当反应中转移电子时,生成 D、键角:
)。下列说法错误的是( ) A、是正盐 B、与甲烷的空间结构均为正四面体形,键角均为 C、当反应中转移电子时,生成 D、键角: -
5、下列中性原子的电子排布式中,表示激发态原子的是( )A、 B、 C、 D、
-
6、化学用语是化学学科独特的语言,下列化学用语表示正确的是( )A、的模型:
 B、的电子式:
B、的电子式: C、基态氧原子的的电子云轮廓图:
C、基态氧原子的的电子云轮廓图: D、基态原子的价层电子轨道表示式:
D、基态原子的价层电子轨道表示式:
-
7、化学与生产、生活、科技具有紧密的联系。下列说法错误的是( )A、耐高温陶瓷材料氮化硅是一种无机非金属材料 B、石墨可用作核反应堆中的慢化剂,石墨属于混合型晶体 C、单晶硅可用于能源行业,单晶硅属于共价晶体 D、中国空间站“天宫”使用的碳纤维,是一种有机材料
-
8、300℃时,向2L的恒容密闭容器中,充入2molCO2(g)和2molH2(g)使之发生反应
, 测得各物质的物质的量浓度变化如图所示:
 (1)、由图可知,CO2(g)的浓度随时间的变化为曲线(填“a”“b”或“c”);2min内的平均反应速率v(CO2)=。(2)、反应至2min时,改变了某一条件,则改变的条件可能是 , 反应到达3min时,比较速率大小v正v逆(填“>”,“<”或“=”)(3)、达到平衡时,CO2(g)的转化率为 , CH3OH的产率为。(4)、下列叙述中能说明上述反应达到平衡状态的是。(填字母)
(1)、由图可知,CO2(g)的浓度随时间的变化为曲线(填“a”“b”或“c”);2min内的平均反应速率v(CO2)=。(2)、反应至2min时,改变了某一条件,则改变的条件可能是 , 反应到达3min时,比较速率大小v正v逆(填“>”,“<”或“=”)(3)、达到平衡时,CO2(g)的转化率为 , CH3OH的产率为。(4)、下列叙述中能说明上述反应达到平衡状态的是。(填字母)a.容器的体积保持不变
b.二氧化碳的浓度保持不变
C.CH3OH的百分含量保持不变
d.化学反应速率3v正(H2)=v逆(CH3OH)
-
9、H2、CO、CH4、CH3OH等都是重要的能源,也是重要为化工原料。
 (1)、已知破坏键、键、键分别需要吸收的能量为436kJ、151kJ、299kJ。则由氢气和碘单质反应生成2molHI需要放出kJ的热量。(2)、将石墨和铜片用导线及电流计相连浸入500mLFeCl3溶液中,构成如右图所示的原电池装置,正极发生的电极反应式为;该电池在工作时,电子的移动方向为。(3)、电动汽车上用的铅蓄电池是以一组海绵状铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解质溶液。放电时总反应为:
(1)、已知破坏键、键、键分别需要吸收的能量为436kJ、151kJ、299kJ。则由氢气和碘单质反应生成2molHI需要放出kJ的热量。(2)、将石墨和铜片用导线及电流计相连浸入500mLFeCl3溶液中,构成如右图所示的原电池装置,正极发生的电极反应式为;该电池在工作时,电子的移动方向为。(3)、电动汽车上用的铅蓄电池是以一组海绵状铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解质溶液。放电时总反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。
①写出放电时负极的电极反应式: 。
②铅蓄电池放电时,正极质量将(填“增加”、“减小”或“不变”)。当外电路上有1mol电子通过时,溶液中消耗H2SO4的物质的量为。
(4)、液态肼(N2H4)—过氧化氢碱性燃料电池由于其较高的能量密度而备受关注,其工作原理如下图所示。该电池的B极区发生(填“氧化反应”或“还原反应”),电池工作过程中,若A极区产生N2 , 请写出A极区的电极反应式 。
-
10、Ⅰ.某学习小组进行浓硫酸对蔗糖的脱水实验,为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如图装置:
 (1)、图1的A选用图2中的(填编号)。(2)、图1的B装置所装试剂是;D装置中试剂的作用是。(3)、图1的A装置中使蔗糖体积膨胀的化学方程式为。(4)、Ⅱ.某小组利用H2C2O4溶液和硫酸酸化的KMnO4溶液反应来探究外界条件对化学反应速率的影响。实验时通过测定酸性KMnO4溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知:
(1)、图1的A选用图2中的(填编号)。(2)、图1的B装置所装试剂是;D装置中试剂的作用是。(3)、图1的A装置中使蔗糖体积膨胀的化学方程式为。(4)、Ⅱ.某小组利用H2C2O4溶液和硫酸酸化的KMnO4溶液反应来探究外界条件对化学反应速率的影响。实验时通过测定酸性KMnO4溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知:实验编号
L酸性溶液的体积/mL
溶液的体积/mL
的体积/mL
实验温度/℃
溶液褪色所需时间/min
①
10
35
25
②
10
10
30
25
③
10
10
50
表中V1=
(5)、探究温度对化学反应速率影响的实验编号是(填编号)(6)、实验③测得KMnO4溶液的褪色时间为2min,忽略混合前后溶液体积的微小变化。这段时间内平均反应速率v(H2C2O4)=。 -
11、回答下列问题
Ⅰ.自然界中硫元素的存在如图1,硫元素的常见化合价与部分物质类别的对应关系如图2,回答下列问题:
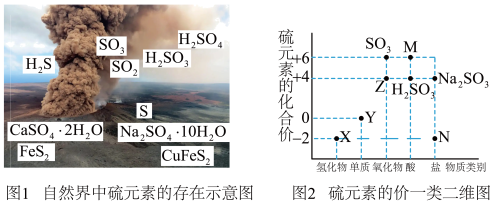 (1)、图2中的N对应图1中物质的化学式为。(2)、X与Z反应中氧化剂与还原剂的物质的量之比为。(3)、Na2SO3溶液易被氧化成Na2SO4 , 检验Na2SO3溶液是否变质的试剂为。(4)、铜和M的浓溶液反应生成Z的化学方程式为。(5)、Ⅱ.氮氧化物(NOx)是大气污染物之一,处理NOx对于环境保护具有重要的意义。
(1)、图2中的N对应图1中物质的化学式为。(2)、X与Z反应中氧化剂与还原剂的物质的量之比为。(3)、Na2SO3溶液易被氧化成Na2SO4 , 检验Na2SO3溶液是否变质的试剂为。(4)、铜和M的浓溶液反应生成Z的化学方程式为。(5)、Ⅱ.氮氧化物(NOx)是大气污染物之一,处理NOx对于环境保护具有重要的意义。在一定条件下NH3可将NO2还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
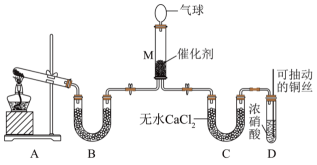
装置D中发生反应的离子方程式是。
(6)、在装置M中NH3和NO2充分反应,生成两种对环境友好的物质,则该反应的化学方程式。(7)、工业生产中利用氨水吸收少量SO2和NO2 , 原理如图所示。NO2被吸收过程的离子方程式是。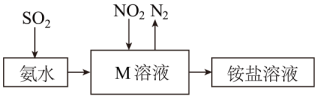
-
12、在一定温度下,将等物质的量的A和B两种气体混合于恒容密闭容器中,发生如下反应:。末该反应达平衡,生成 , , C的平均反应速率是。下列判断正确的是A、 B、内B的反应速率为 C、A的转化率为60% D、混合气体的密度不变或平均相对分子质量不变,都可以表明该反应已达到平衡状态
-
13、恒温恒容,可逆反应2SO2(g)+ O2(g) 2SO3(g)达到平衡的标志是( )A、SO2的分解速率与SO3的生成速率相等 B、混合气体的密度不再变化 C、SO2、O2、SO3的物质的量之比为2:1:2 D、体系的压强不变
-
14、对于反应4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g),下列措施能加快反应速率的是( )
①恒容条件下,再通入一定量的NH3 ②增大体系容积③恒容条件下,再通入一定量的N2 ④适当升高温度
A、①②④ B、①③④ C、①④ D、②④ -
15、党的二十大报告中指出:要“加强污染物协同控制,基本消除重污染天气”。一氧化氮—空气质子交换膜(只允许H+通过)燃料电池将化学能转化为电能的同时,实现了制硝酸、发电、环保三位一体的结合,其工作原理如图所示。下列说法正确的是( )
 A、为电池的负极,发生还原反应 B、电极附近发生的反应: C、若过程中产生2molHNO3 , 则消耗O2的体积为33.6L(标准状况) D、电池工作时H+穿过质子交换膜向Pt1电极迁移
A、为电池的负极,发生还原反应 B、电极附近发生的反应: C、若过程中产生2molHNO3 , 则消耗O2的体积为33.6L(标准状况) D、电池工作时H+穿过质子交换膜向Pt1电极迁移 -
16、下列关于化学反应与能量变化的说法正确的是( )
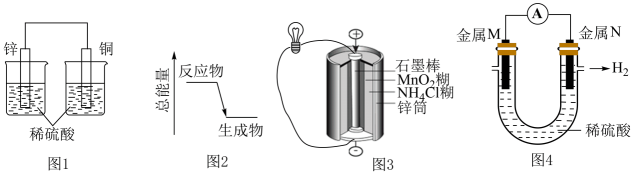 A、图1所示装置可将化学能转化为电能 B、图2可表示晶体与晶体反应的能量变化 C、图3所示的锌锰干电池中在正极发生还原反应 D、图4所示装置可验证金属活动性:M<N
A、图1所示装置可将化学能转化为电能 B、图2可表示晶体与晶体反应的能量变化 C、图3所示的锌锰干电池中在正极发生还原反应 D、图4所示装置可验证金属活动性:M<N -
17、如图所示,电流表指针发生偏转,同时A极质量减少,B极上有气泡产生,C为电解质溶液,下列说法错误的是( )
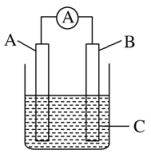 A、B极为原电池的正极 B、A、B、C可能分别为Zn、Cu、稀硫酸 C、C可以是酒精溶液 D、A极发生氧化反应
A、B极为原电池的正极 B、A、B、C可能分别为Zn、Cu、稀硫酸 C、C可以是酒精溶液 D、A极发生氧化反应 -
18、下列图示与对应的叙述相符的是( )
 A、图甲代表浓H2SO4稀释过程中体系的能量变化 B、图乙表示反应物断键吸收的能量小于生成物成键放出的能量 C、图丙表示白磷比红磷稳定 D、图丁表示CO与H2O的反应是吸热反应
A、图甲代表浓H2SO4稀释过程中体系的能量变化 B、图乙表示反应物断键吸收的能量小于生成物成键放出的能量 C、图丙表示白磷比红磷稳定 D、图丁表示CO与H2O的反应是吸热反应 -
19、NA为阿伏加德罗常数的值。下列说法正确的是( )A、50 mL、18.4 mol/L浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA B、1molFe和足量S充分反应转移电子数为2NA C、常温下,将2.7 g铝片投入足量的浓硝酸中,铝失去的电子数为0.3NA D、标准状况下,22.4 LSO2与足量O2的反应,生成的SO3分子数为NA
-
20、如图是实验室制备、除杂、收集常见四种气体的装置(其中a、b、c表示相应仪器中加入的试剂),其中可行的一组是( )

选项
气体
a
b
c
A
NO
稀硝酸
Cu
浓硫酸
B
盐酸
碳酸钙
饱和NaHCO3溶液
C
浓氨水
生石灰
碱石灰
D
浓盐酸
MnO2粉末
浓硫酸
A、A B、B C、C D、D