-
1、下列反应中,属于取代反应的是( )A、
 B、2CH3CH2OH+O22CH3CHO+2H2O
C、
B、2CH3CH2OH+O22CH3CHO+2H2O
C、 +H2CH3CH2OH
D、CH2=CH2+HClCH3CH2Cl
+H2CH3CH2OH
D、CH2=CH2+HClCH3CH2Cl
-
2、苏轼的《格物粗谈》有这样的记载:“红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩味。”按照现代科技观点,该文中的“气”是指( )A、甲烷 B、生长素 C、丁烷 D、乙烯
-
3、X、Y、Z、W、Q为短周期主族元素,原子序数依次增大且原子序数总和等于49.它们的化合物在常温下有如图所示的转化关系:
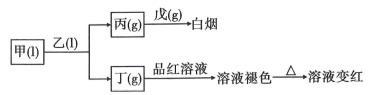
已知:乙、戊分子都含有10个电子,且两种分子中心原子的杂化方式均为杂化,乙中共价键的键角小于戊中共价键的键角。丙易溶于水,0.1mol/L丙的水溶液中,。甲为三种元素组成的化合物,其他化合物均为两种元素组成的化合物。试回答下列问题:
(1)、Q元素原子的简化电子排布式为。(2)、甲、乙、丙、丁、戊五种分子中,中心原子杂化方式为的是(填分子的化学式);乙中共价键的键角小于戊中共价键的键角的原因是。(3)、戊分子为分子(填“极性”或“非极性”),甲分子的VSEPR模型为。(4)、写出甲与乙反应的化学方程式:。(5)、下列说法正确的是____(填序号)。A、简单阴离子半径:W>Q B、常温下,0.1简单氢化物水溶液的pH:Q>W>Z>Y C、最高价氧化物对应水化物的酸性:Q>W D、化合物中含极性键、非极性键和离子键 E、甲与乙的化学反应中,甲作氧化剂 -
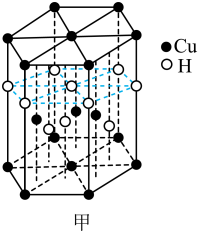
4、Cu及其化合物在医药、催化、材料等领域有广泛应用。回答下列问题:(1)、Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图甲所示。则该化合物的化学式为。
 (2)、通过如图乙所示反应可以实现铜离子的富集,进行回收。
(2)、通过如图乙所示反应可以实现铜离子的富集,进行回收。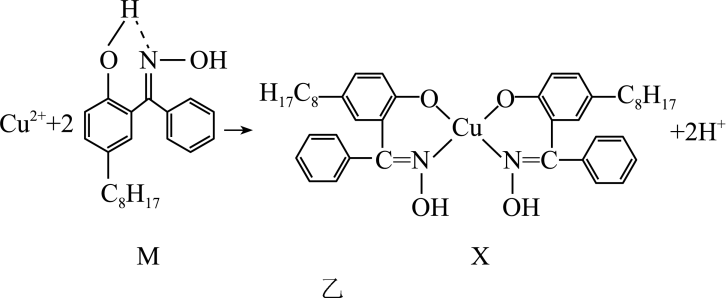
①基态铜原子的核外电子有种空间运动状态。与Cu元素同周期,基态原子有2个未成对电子的金属元素有种。
②下图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的变化图是(填序号),第三电离能的变化图是(填序号)。

③化合物X中的中心铜离子的配位数是 , 图乙反应中断裂和生成的化学键有(填序号)。
a.离子键 b.键 c.极性键 d.氢键 e.配位键
-
5、元素周期表前四周期W、X、Y、Z、E五种元素,W元素的原子最外层电子排布式为;X元素的原子价电子排布式为;Y元素位于第二周期且原子中p能级与s能级电子总数相等;Z元素原子的M能层的p能级中有3个未成对电子;中有5个未成对电子。(1)、写出元素名称:Z;E。(2)、Y基态原子的电子排布图为。(3)、当时,分子中,两共价键的键角为度;当时,X与Y形成的化合物与氢氧化钠溶液反应的离子方程式是。(4)、E元素原子的价电子排布式是 , 在元素周期表中的位置是 , 按照核外电子排布,可以把元素周期表分为5个区,E元素位于周期表的区。
-
6、根据所学知识回答下列问题(1)、下列所示的几种物质中,互为同素异形体的为 , 其中属于共价晶体的是 , 间的作用力是。
 (2)、气态通常以二聚体的形式存在,其空间结构如图甲所示,二聚体中Al的轨道杂化类型为。的熔点为1090℃,远高于的192℃,由此可以判断铝氟之间的化学键为键。结构属于立方晶系,晶胞如图乙所示,的配位数为。若晶胞参数为a pm,晶体密度(列出计算式,阿伏加德罗常数的值为)。
(2)、气态通常以二聚体的形式存在,其空间结构如图甲所示,二聚体中Al的轨道杂化类型为。的熔点为1090℃,远高于的192℃,由此可以判断铝氟之间的化学键为键。结构属于立方晶系,晶胞如图乙所示,的配位数为。若晶胞参数为a pm,晶体密度(列出计算式,阿伏加德罗常数的值为)。
-
7、为原子序数依次增大的前20号元素,它们最外层电子数之和为16,且W、同主族,X的基态原子有7种空间运动状态。下列叙述不正确的是( )A、第一电离能:W一定比同周期相邻的元素小 B、简单气态氢化物稳定性一定为: C、常见氧化物熔沸点:不一定高于 D、简单离子半径可能为:
-
8、下列说法错误的是( )
 A、MgO的离子键的键能大于CaO的 B、BF3键角为120°,的键角大于120° C、如图所示的晶胞的化学式为 D、DNA双螺旋的两个螺旋链通过氢键相互结合
A、MgO的离子键的键能大于CaO的 B、BF3键角为120°,的键角大于120° C、如图所示的晶胞的化学式为 D、DNA双螺旋的两个螺旋链通过氢键相互结合 -
9、某实验小组为探究配合物的性质,进行如下实验:

已知:溶液中,为浅紫色,为红色,为无色。
下列说法正确的是( )
A、与形成配位键时,提供孤电子对 B、和中共价键数目之比为 C、溶于水后溶液呈黄色而不是浅紫色,是因为转化成了沉淀 D、上述实验说明与配位键强度弱于与配位键强度 -
10、设为阿伏加德罗常数的值,下列说法正确的是( )A、124g 含有的键的个数为6 B、18g冰晶体中最多含有的氢键的个数为4 C、12g金刚石中含有的键的个数为1.5 D、60g 中含键的个数为2
-
11、下列说法错误的是( )A、破损的晶体经过重结晶后能够变成规则的多面体,体现了晶体的自范性 B、含有金属阳离子的晶体不一定是离子晶体 C、液晶是介于液态和晶态之间的物质状态,既具有液体的流动性,又具有晶体的某些物理性质,表现出类似晶体的各向异性,说明它属于晶态 D、已知晶胞的组成就可推知晶体的组成
-
12、食用碱是人们生活中常用的食品疏松剂和肉类嫩化剂,其成分为纯碱()和小苏打()。下列说法正确的是( )A、离子半径: B、中的C为杂化 C、非金属性: D、第一电离能:
-
13、下列有关说法正确的是( )A、某晶体溶于水后可以导电,该晶体一定是离子晶体 B、干冰和的晶体类型相同 C、分子晶体的结构特征都是分子密堆积,一个分子周围有12个紧邻的分子 D、标准状况下HF不是气体的原因是HF分子间可以形成分子间氢键,沸点较高
-
14、下列说法正确的是( )A、某原子核外电子由 , 原子放出能量 B、电子云图中的小黑点密度越大,说明该原子核外空间电子数目越多 C、ns能级的原子轨道图可表示为
 D、3d表示d能级有3个轨道
D、3d表示d能级有3个轨道
-
15、下列各项中,前面的能级先填入电子的为( )
①3p和4s ②2s和3s ③3d和3p ④3d和4s
A、①③ B、①② C、②④ D、①④ -
16、下列变化需克服共价键的是( )A、二氧化硅熔化 B、汞变成汞蒸气 C、碘升华 D、食盐溶于水
-
17、下列配合物的配位数不为6的是( )A、 B、 C、 D、
-
18、下列说法正确的是( )A、两原子间形成共价键可能只有π键 B、和分子的共价键均是键 C、2s轨道比1s轨道大,其空间包含了1s轨道 D、可通过原电池将与HCl反应的化学能转化为电能
-
19、下列化学用语表示正确的是( )A、基态电子排布式为 B、电子式为
 C、氮原子的轨道表示式是
C、氮原子的轨道表示式是 D、的空间结构:
D、的空间结构: (三角锥形)
(三角锥形)
-
20、2-[对一异丁苯基]-丙酸具有解热、镇痛、抗炎的作用,其合成路线如下。
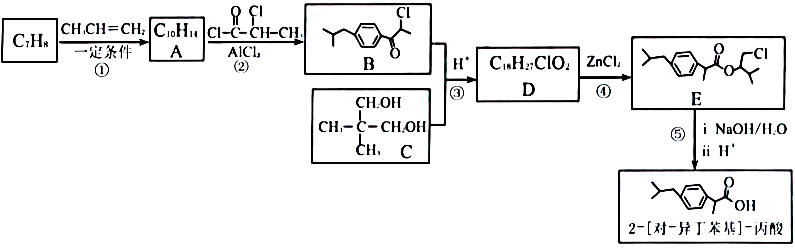
已知:
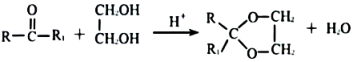
请回答下列问题:
(1)、A的结构简式为。(2)、反应②的反应类型是;E中官能团名称是。(3)、C的系统命名是。(4)、已知D中含有两个六元环,B和C生成D的化学方程式为。(5)、反应⑤的第ⅰ步反应方程式为。(6)、G的相对分子质量比2-[对-异丁苯基]-丙酸少28,且为同系物。则G符合下列条件的同分异构体有种(不考虑立体异构)。a.能发生银镜反应和水解反应,水解产物遇显紫色
b.苯环上有三个取代基
(7)、由2-甲基丙醛和甲醛经两步可以合成C,其合成路线图是(无机试剂自选)。