-
1、锆英石常用作耐火材料,其矿砂常与钛铁矿、金红石等共生。回答下列问题:(1)、锆与钛是同族相邻元素,基态锆原子核外价电子轨道表示式为;第4周期基态原子核外未成对电子数与锆相同的元素有种。(2)、钛铁矿经过 , 等多种物质处理后会生成硫酸氧钛(为+4价)等中间产物。
①空间构型为 , 中存在的大键为(分子中的大键可用符号表示,其中代表参与形成大键的原子数,代表参与形成大键的电子数,例如苯分子中的大键可表示为)。
②硫酸氧钛晶体中,阳离子为如图1所示链状聚合形式的离子,则该晶体的化学式为。
 (3)、能形成多种配合物,物质为 , 物质为与配位数相同的同分异构体。与足量硝酸银溶液反应生成沉淀,的化学式为。(4)、金红石为四方晶系晶体、晶胞参数为 , 。在金红石结构中,原子处在变形的八面体中,距离有4个较近,2个较远。八面体沿着轴共边连接成链,这些链再通过共顶点连接成晶体,结构如图2:晶体沿轴方向的投影如图3。已知原子A的分数坐标为 , 则原子B的分数坐标为;该晶体的密度为(列出计算式,代表阿伏加德罗常数的值)。
(3)、能形成多种配合物,物质为 , 物质为与配位数相同的同分异构体。与足量硝酸银溶液反应生成沉淀,的化学式为。(4)、金红石为四方晶系晶体、晶胞参数为 , 。在金红石结构中,原子处在变形的八面体中,距离有4个较近,2个较远。八面体沿着轴共边连接成链,这些链再通过共顶点连接成晶体,结构如图2:晶体沿轴方向的投影如图3。已知原子A的分数坐标为 , 则原子B的分数坐标为;该晶体的密度为(列出计算式,代表阿伏加德罗常数的值)。
-
2、废弃电池中锰可通过浸取回收。某温度下,在和混合溶液中,的分布系数与的关系如图。

已知:难溶于水,具有两性;。下列说法错误的是
A、曲线代表的变化 B、点, C、点, D、点, -
3、某学习小组对与的反应的快慢及颜色变化进行探究,实验操作及现象如下:
实验
操作及现象
I
将表面打磨光洁的铜丝末端绕成螺旋状,伸入盛有浓硝酸的试管中,反应开始较为缓慢,随后迅速加快,固液交界处的铜丝表面析出蓝色固体,溶液变为绿色。取反应片刻后的溶液加入水中稀释,溶液变为蓝色,加入铜片立刻产生大量气泡。
Ⅱ
取实验I稀释后的溶液置于酒精灯上微热,再次加入铜丝,表面出现少量气泡。
已知:溶液受热非常容易分解,可以与形成绿色配合物。下列说法正确的是
A、铜丝表面析出的蓝色固体难溶于水 B、两个实验中硝酸均表现氧化性 C、实验I中溶液变蓝的主要原因是与水发生反应 D、通过以上实验可证明对与的反应有催化作用 -
4、将转化为有机碳酸酯 , 可有效减少碳排放。转化为的总反应为 , 可通过两步反应完成:I. ;Ⅱ. ;反应Ⅱ的反应机理如图1所示,其中催化剂参与催化循环和脱水循环;随的变化曲线如图2.已知:(和为常数)。

下列说法错误的是
A、对于总反应,活化能 B、该反应的催化剂是 C、反应I为吸热反应
D、脱水循环可以提高DMC的平衡产率
C、反应I为吸热反应
D、脱水循环可以提高DMC的平衡产率
-
5、四乙基铅能提高汽油的辛烷值,但污染严重,是一种潜在替代品,以和为原料,电解合成的原理如图所示(为催化剂)。

下列说法正确的是
A、电解过程中起到催化剂作用,其浓度保持不变 B、电极发生的电极反应为: C、每生产产品,转移电子的物质的量为 D、已知以和为原料也可以直接放电制备产品,该方法能耗更低产率更高 -
6、下列实验操作对应的现象及结论均正确的是
实验操作
现象
结论
A
分别向盛有和的试管中滴加浓盐酸
盛的试管中产生黄绿色气体
氧化性:
B
用标准溶液滴定未知浓度的溶液,用甲基橙作指示剂
终点的颜色变化为橙色到黄色
反应终点在指示剂变色范围内,误差较小
C
量取同体积不同浓度的溶液,分别加入等体积等浓度的溶液
浓度大的溶液产生气泡速度快
反应物浓度越大,化学反应速率越快
D
用玻璃棒摩擦装有明矾过饱和溶液的烧杯内壁
快速析出晶体
烧杯内壁产生微小的玻璃微晶来充当晶核
A、A B、B C、C D、D -
7、逆水煤气变换体系中存在以下两个反应:
反应I:
反应II:
在恒容条件下,按投料比进行反应,平衡时含碳物质体积分数随温度的变化如图所示。下列说法错误的是
 A、反应I的 , 反应II的 B、M点反应I的平衡常数 C、点的压强是的3倍 D、若按投料,则曲线之间交点位置不变
A、反应I的 , 反应II的 B、M点反应I的平衡常数 C、点的压强是的3倍 D、若按投料,则曲线之间交点位置不变 -
8、是一种用途广泛的磁性材料,以为原料制备并获得副产物水合物的工艺如下。

25℃时各物质溶度积见下表:
物质
溶度积
下列说法错误的是
A、反应釜1中的反应需在隔绝空气条件下进行 B、反应釜2中反应的离子方程式为 C、反应釜3中,25℃时,浓度为 , 理论上不超过10 D、获得水合物的操作为:蒸发浓缩、冷却结晶 -
9、一种可用于海水淡化的新型网状高分子材料,其制备原理如图(反应方程式未配平)。

下列说法正确的是
A、中碳原子均为杂化 B、的重复结构单元中, C、该反应属于加聚反应 D、完全水解消耗 -
10、化合物和所含元素相同,相对分子质量相差7,含电子, , 和三种元素位于同周期,原子最外层电子数是原子核外电子数的一半。下列说法正确的是A、同周期第一电离能比大的元素有3种 B、电负性顺序: C、常温常压下和的单质均为固体 D、和互为同素异形体
-
11、有机化合物与在的催化作用下可反应生成 , 其反应如图:

下列说法正确的是
A、分子中最多有15个碳原子共面 B、与同类别的同分异构体还有2种 C、该反应的副产物为和 D、分子中键角大小: -
12、纤维素可以多条单链的形式存在,在低温下溶于溶液,恢复至室温后不稳定,加入尿素可得到室温下稳定的溶液,可使纤维素绿色再生利用。下列说法错误的是
 A、纤维素难溶于水的主要原因是其链间有多个氢键 B、提供破坏纤维素链之间的氢键,引发溶胀 C、加入尿素形成动态“包覆层”,防止链间重新结合 D、低温时纤维素分子链间的相互作用力增强,更易被溶解
A、纤维素难溶于水的主要原因是其链间有多个氢键 B、提供破坏纤维素链之间的氢键,引发溶胀 C、加入尿素形成动态“包覆层”,防止链间重新结合 D、低温时纤维素分子链间的相互作用力增强,更易被溶解 -
13、下列玻璃仪器(含活塞)在相应实验中选用不合理的是
 A、重结晶法提纯乙酰苯胺(
A、重结晶法提纯乙酰苯胺( ):⑥⑦⑧
B、蒸馏法分离苯(沸点80.1℃)和甲苯(沸点111℃):①③⑤⑨
C、用标准液滴定测量溶液中的含量:③④
D、用作萃取剂,萃取溴水中的溴:②⑥
):⑥⑦⑧
B、蒸馏法分离苯(沸点80.1℃)和甲苯(沸点111℃):①③⑤⑨
C、用标准液滴定测量溶液中的含量:③④
D、用作萃取剂,萃取溴水中的溴:②⑥
-
14、下列化学用语或图示错误的是A、用电子式表示的形成:
 B、用亚铜氨溶液除去合成氨原料气中的:
C、用电子云轮廓图示意键的形成:
B、用亚铜氨溶液除去合成氨原料气中的:
C、用电子云轮廓图示意键的形成: D、用对苯二甲酸与对苯二胺制备芳纶纤维:
D、用对苯二甲酸与对苯二胺制备芳纶纤维: +
+

-
15、关于物质的分离、提纯,下列说法错误的是A、蒸馏法分离乙醇和乙醛 B、重结晶法提纯含有少量食盐的苯甲酸 C、过滤法分离2,4,6-三溴苯酚和乙醚 D、萃取和柱色谱法从青蒿中提取分离青蒿素
-
16、齐鲁大地人杰地灵,辛弃疾和李清照是宋朝词人的杰出代表,下列诗句所涉及的化学知识错误的是A、“稻花香里说丰年,听取蛙声一片”,稻花香气的主要成分是无机化合物 B、“东风夜放花千树,更吹落星如雨”,烟花燃烧涉及氧化还原反应 C、“三杯两盏淡酒,怎敌他晚来风急”,酒的制作过程涉及糖类的水解 D、“轻解罗裳,独上兰舟”,在古代,罗裳的主要成分是蛋白质
-
17、某抗凝血作用的药物Z可用下列反应合成。下列说法正确的是
 A、X与NaHCO3溶液反应可以生成
A、X与NaHCO3溶液反应可以生成 B、1molY与NaOH溶液反应,最多消耗2molNaOH
C、Z中所有碳原子可能共平面
D、X、Y、Z均易溶于水
B、1molY与NaOH溶液反应,最多消耗2molNaOH
C、Z中所有碳原子可能共平面
D、X、Y、Z均易溶于水
-
18、连二亚硝酸(HON=NOH)是一种还原剂,可由反应HNO2+H2NOH→HON=NOH+H2O制备。下列说法正确的是A、中子数为8的氮原子:N B、H2NOH分子含极性键和非极性键 C、H2O的电子式为
 D、HON=NOH中N元素的化合价为+1
D、HON=NOH中N元素的化合价为+1
-
19、、在环境保护中用途广泛。碱性条件下稳定存在。
 (1)、可用于氧化去除高氯(含高浓度)废水中的有机物。
(1)、可用于氧化去除高氯(含高浓度)废水中的有机物。①酸性条件下,在水中产生氢氧化铁沉淀,该反应的离子方程式为。
②酸性溶液中的氧化性大于的氧化性。处理高氯废水中的有机物在酸性条件下有机物去除率较低,其主要原因是。
(2)、高铁酸钠()也可用于氨氮处理。的氧化性受溶液中的H+浓度影响较大。如图所示。①碱性条件下,可将水中的转化为除去,该反应的化学方程式为。
②用氧化含氨氮废水,其他条件相同时,废水pH对氨氮去除率及氧化时间影响如图所示。当pH小于9时,随着pH的增大,氧化所需时间明显增长原因是。
(3)、水中的+6价铬元素对水质严重的损害作用,使用可进行无害化处理。即转化为产品磁性铁铬氧体()沉降。方法是先向含的污水中加入适量的硫酸及溶液,待充分反应后再通入适量空气(氧化部分)并加入NaOH溶液,就可以使铬、铁元素全部转化为磁性铁铬氧体。①写出在酸性条件下被还原为的离子方程式。
②若处理含0.5mol(不考虑其他含铬微粒)污水时恰好消耗760g , 并消耗0.125mol氧气。则加入NaOH溶液后最终得到的磁性铁铬氧体的化学式为(x、y、z取正整数)。
-
20、下列为某有机物的合成路线。
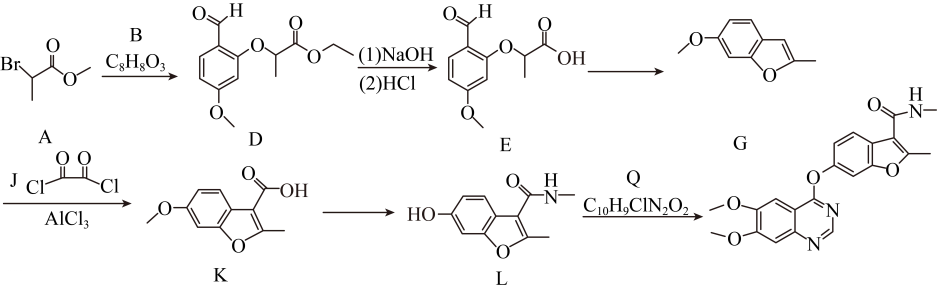 (1)、A 中含氧官能团名称 为 , A到D的反应灾害为。(2)、B的结构简式为。(3)、D到E的反应产物,除E外,另一产物的结构简式为。(4)、下列说法正确的是( )____。A、G中存在大键 B、K中碳原子来自于J C、L中存在氢键 D、(5)、G的同分异构体中,满足下列条件的有种。
(1)、A 中含氧官能团名称 为 , A到D的反应灾害为。(2)、B的结构简式为。(3)、D到E的反应产物,除E外,另一产物的结构简式为。(4)、下列说法正确的是( )____。A、G中存在大键 B、K中碳原子来自于J C、L中存在氢键 D、(5)、G的同分异构体中,满足下列条件的有种。①:存在
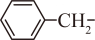 和2个环外键
和2个环外键②:不含与sp杂化的碳原子
写出其中核磁共振氧谱峰面积比为()的结构简式。
(6)、有机物Q的合成路线如下: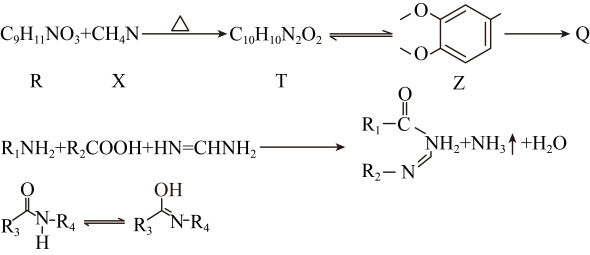
根据已知信息,由R和X生成T的化学方程式为。