-
1、加热时,浓硫酸与木炭发生反应:。设为阿伏加德罗常数的值。下列说法正确的是( )A、含质子数为 B、常温常压下,含σ键数目为 C、的稀硫酸中含数目为 D、与充分反应得到的分子数为
-
2、化学实验充满着五颜六色的变化。下列描述错误的是( )A、
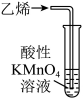
溶液褪色 B、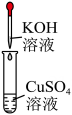
产生红色沉淀 C、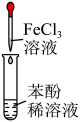
溶液呈紫色 D、
试纸变为蓝色
-
3、材料是人类赖以生存和发展的物质基础。下列材料属于金属材料的是( )A、高强韧无磁不锈钢——聚变能实验装置中的低温结构部件 B、金刚石薄膜——“梦想”号大洋钻探船使用的钻头表面涂层 C、超细玄武岩纤维——嫦娥六号携带的月面国旗的纺织材料 D、超细玻璃纤维——国产大飞机中隔音隔热的“飞机棉”
-
4、“碳中和”"具有重要意义。(1)、空间站里常用“Sabatier反应”控制空气中含量。

已知:ⅰ.和的燃烧热分别为和。
ⅱ. 。
则Sabatier反应:的。
(2)、烟气中的捕集可通过下列转化实现。
“碳化”的温度不能过高的原因是;“脱碳”的化学方程式为。
(3)、氧化丙烷脱氢。下,将不同组分的原料混合气以相同流速通过装有催化剂的反应床,测得转化率和选择性随时间的变化关系如图-1所示,图中A、B分别代表、的两种原料气。
①随着反应的进行,4小时前A组分原料气中转化率和选择性均有所提升,且在反应床出口检测到CO。研究表明,氧化丙烷脱氢经历了以下两个反应:
Ⅰ.;
Ⅱ.。(填化学方程式)
②反应进行至4小时后,B组分原料气的反应几乎无法进行,而A组分原料气的反应仍保持相对优异的稳定性,其可能原因是。
(4)、电催化还原可以制备甲酸,原理如图-2所示,电解质溶液为KOH。2024年,我国研究人员为降低系统能耗,对装置改进,搭建“(阴阳极)共产甲酸耦合系统”,将KOH电解液更换为混合溶液,应将极区(填“a”"或“b”)电解液更换。此时,该电极的电极反应式为。
-
5、废定影液的主要成分为Na3[Ag(S2O3)2],用废定影液为原料制备AgNO3的实验流程如图:
 (1)、“沉淀”时发生的反应为:2[Ag(S2O3)2]3-(aq)+S2-(aq)Ag2S(s)+4S2O(aq),平衡常数K=。检验沉淀完全的操作是。(已知:Ksp(Ag2S)=1×10-50 , Ag+(aq)+2S2O(aq)[Ag(S2O3)2]3-(aq) K1=1×1013)(2)、“反应”时有淡黄色固体生成,发生反应的化学方程式为。(3)、已知:2AgNO32Ag+2NO2↑+O2↑,2Cu(NO3)22CuO+4NO2↑+O2↑。AgNO3粗产品中常含有Cu(NO3)2 , 请设计由AgNO3粗产品获取纯净AgNO3的实验方案: , 蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得到纯净的AgNO3。(实验中须使用的试剂:稀硝酸、NaOH溶液、蒸馏水)(4)、蒸发浓缩AgNO3溶液的装置如图所示。使用真空泵的目的是。判断蒸发浓缩完成的标志是。
(1)、“沉淀”时发生的反应为:2[Ag(S2O3)2]3-(aq)+S2-(aq)Ag2S(s)+4S2O(aq),平衡常数K=。检验沉淀完全的操作是。(已知:Ksp(Ag2S)=1×10-50 , Ag+(aq)+2S2O(aq)[Ag(S2O3)2]3-(aq) K1=1×1013)(2)、“反应”时有淡黄色固体生成,发生反应的化学方程式为。(3)、已知:2AgNO32Ag+2NO2↑+O2↑,2Cu(NO3)22CuO+4NO2↑+O2↑。AgNO3粗产品中常含有Cu(NO3)2 , 请设计由AgNO3粗产品获取纯净AgNO3的实验方案: , 蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得到纯净的AgNO3。(实验中须使用的试剂:稀硝酸、NaOH溶液、蒸馏水)(4)、蒸发浓缩AgNO3溶液的装置如图所示。使用真空泵的目的是。判断蒸发浓缩完成的标志是。
-
6、G是一种口服抗血小板聚集药物,其合成路线如下:
 (1)、G分子中氮原子的轨道杂化方式有。(2)、C→D的转化中,除使用K2CO3外,还可以使用下列物质中的(填字母)。
(1)、G分子中氮原子的轨道杂化方式有。(2)、C→D的转化中,除使用K2CO3外,还可以使用下列物质中的(填字母)。A.CH3COOH B.CH3OH C.CH3CH2ONa
(3)、E→F包括两步反应,第一步为取代反应,第二步为反应。(4)、F→G反应后生成两种产物,除G外,另一产物的结构简式为。(5)、D的一种同分异构体同时满足下列条件,写出其结构简式:。①不能使FeCl3溶液发生显色反应,水解后可生成三种有机产物X、Y和Z;
②X、Y均为α-氨基酸;
③Z能使FeCl3溶液发生显色反应,且含有3种化学环境不同的氢。
(6)、已知RCN(R表示烃基)在浓硫酸或其他酸作用下会转化为RCOOH。设计以BrCH2COOH、CH3CH2OH、 为原料制取
为原料制取 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。 -
7、水体中的、、是高毒性的重金属离子,可用表示。可以采用还原沉淀法、吸附法等处理含废水。(1)、钡盐沉淀法:
①部分转化为的离子方程式为。
②向含的酸性废水中加入钡盐,可生成难溶于水的沉淀,其他条件一定,使用等物质的量的或 , 反应足够长的时间,使用时的沉铬率要优于使用的原因是。
(2)、纳米铁粉还原法:纳米铁粉可将水体中还原为 , 再通过调节溶液pH转化为沉淀而被除去。
①在氮气气氛保护下,向一定量的溶液中逐滴加入一定量的溶液,可制得纳米铁粉,反应的离子方程式为 , 已知电负性: , 反应每转移4mol电子,被氧化的的物质的量为。
②实验发现,其他条件相同,含铁的物质的量相同,用纳米铁粉和铁-铜粉分别处理5的含废水,废水中的去除率随时间变化关系如图1所示,用铁-铜粉处理含废水的效果更好,原因是。
 (3)、还原吸附法:
(3)、还原吸附法:可吸附并部分还原 , 原理如图2所示。实验控制在的弱酸性条件下进行。

①在的水溶液中表面带正电荷,在的水溶液中表面带负电荷。在弱酸性条件下,除铬的速率比碱性条件下快的原因是。
②起始时,溶液中和的浓度随时间的变化如图3所示。浓度先增大后减小的原因是。
 (4)、离子交换法:
(4)、离子交换法:阴离子交换树脂去除酸性废水中的原理为:。某树脂的摩尔交换总容量为 , 即每升湿树脂最多吸收。现将含量为的废水以的流量通过填充有30mL湿树脂的淡化室。试通过计算说明,通废水20h时,该离子交换树脂是否达到吸收饱和。[均以铬元素计,写出计算过程]
-
8、在二氧化碳加氢制甲烷的反应体系中,主要反应的热化学方程式为:
反应I:
反应II:
反应III:
向恒压、密闭容器中通入和平衡时的物质的量随温度的变化如图所示。下列说法错误的是
 A、图中曲线C表示CO的物质的量随温度的变化 B、 C、为了提高甲烷的产率,最佳控制温度在800℃~1000℃之间 D、a点所对应温度下反应II的平衡常数
A、图中曲线C表示CO的物质的量随温度的变化 B、 C、为了提高甲烷的产率,最佳控制温度在800℃~1000℃之间 D、a点所对应温度下反应II的平衡常数 -
9、一种捕集烟气中CO2的过程如图所示。室温下用1.0mol/L KOH溶液吸收CO2 , 溶液中含碳物种的浓度。忽略通入CO2所引起的溶液体积变化和H2O挥发,且不考虑烟气中其他气体的影响

已知:H2CO3: , ;;;。
下列说法正确的是
A、饱和澄清石灰水pH=11.7 B、KOH吸收CO2所得到的溶液中: C、若“吸收”后 , 将该溶液稀释10倍,几乎不变 D、“转化”后过滤,所得滤液中存在: -
10、室温下,下列实验方案能达到实验目的的是
选项
实验方案
实验目的
A
向溶液中先滴加几滴新制氯水,再滴加几滴KSCN溶液,观察现象
验证氧化性:
B
向溶液中,滴入2滴NaOH溶液,产生白色沉淀,再滴入2滴溶液,白色沉淀逐渐变为蓝色
证明:
C
向甲苯中滴加酸性高锰酸钾溶液,溶液褪色
苯环对甲基产生影响
D
测定溶液的pH,测得溶液
A、A B、B C、C D、D -
11、工业利用钒渣(主要成分为FeV2O4 , 杂质为Al2O3)制备V2O5的工艺流程如下:

已知:“焙烧”的产物之一为NaVO3。下列说法不正确的是
A、“焙烧”时,n(氧化剂):n(还原剂)=4:5 B、“调pH”的目的是将溶液中的铝元素转化为Al(OH)3而除去 C、不选用HCl“调pH”的原因可能与的氧化性较强有关 D、“沉钒”后的溶液中 -
12、科学家最近发明了一种Al-PbO2电池,电解质为KOH、K2SO4、稀H2SO4 , 通过X和Y两种离子交换膜将电解质溶液隔开,形成M、R、N三个电解质溶液区域(a>b),结构示意图如图所示。下列说法正确的是
 A、R区域的电解质浓度逐渐减小 B、通过Y膜移向N区 C、放电时,PbO2电极上的电极反应式为 D、理论上,消耗2.7g Al时,N极区质量减少28.8g
A、R区域的电解质浓度逐渐减小 B、通过Y膜移向N区 C、放电时,PbO2电极上的电极反应式为 D、理论上,消耗2.7g Al时,N极区质量减少28.8g -
13、阅读材料,氧元素及其化合物的应用广泛。性质活泼,遇活泼金属可以形成过氧化物()。的空间结构为V形,可以使湿润的淀粉KI试纸变蓝。能与熔融的反应生成硫酰氯()。的燃烧热为。完成问题。(1)、下列说法正确的是A、、互为同素异形体 B、键角: C、中O原子采用杂化 D、分子中有键(2)、下列化学反应表示正确的是A、碱性条件下,氧化KI的离子方程式: B、过氧化钾()与水反应: C、燃烧的热化学方程式: D、制备:(3)、下列氧化物的结构与性质或性质与用途具有对应关系的是A、具有还原性,可用作漂白剂 B、分子中存在过氧键,具有氧化性 C、分子之间形成氢键,的热稳定性强 D、的极性微弱,在中溶解度小于在水中溶解度
-
14、工业上分别用、还原可得无定形硅、晶体硅。下列说法正确的是A、硅单质属于非极性分子 B、熔沸点:晶体硅< C、电负性: D、酸性:
-
15、“科技兴国,高质量发展”一直是我国建设现代化国家的重要战略方针。下列说法不正确的是A、聚碳酸酯不属于新型无机非金属材料 B、丝绸富含酰胺基,具有良好的吸湿性 C、“海水中提取碘单质”的过程中涉及氧化还原反应 D、“神舟十六号”推进器使用的氧化剂是 , 其中N是第ⅤA族元素
-
16、测定湖盐(盐湖中提取的天然盐)中和含量的实验过程如下:

已知25℃时的电离平衡常数: , 。下列说法不正确的是
A、用甲基橙作指示剂滴定时发生的反应为: B、在滴定过程中的溶液存在: C、在滴定过程中,的溶液中存在: D、在滴定过程中,的溶液中存在: -
17、甲烷催化氧化偶联制乙烯是提高甲烷附加值的一项重要研究课题,其涉及的反应如下:
反应I.
反应II.
已知:①的选择性;②:用平衡分压代替平衡浓度计算;分压总压物质的量分数。
回答下列问题:
(1)、反应III:的 , 反应III能够自发进行的原因是。(2)、向刚性容器中充入4mol和2mol , 起始压强为、温度为TK条件下发生反应I、反应II,达到平衡后,测得反应体系总压强为 , 的分压为 , 则的选择性为 , 反应I的分压表示的平衡常数(用含代数式表示),若再向刚性容器中充入一定量的 , 重新达平衡后,则分压将(填“增大”“减小”或“不变”),将(填“增大”“减小”或“不变”)。(3)、向刚性容器中,充入4mol和2mol , 分别在催化剂A、催化剂B作用下发生反应I、反应II,反应tmin时测得转化率、选择性与温度关系如图所示:
①在催化剂A的作用下,表示转化率与T关系曲线是(填“X”或“Z”);
②在催化剂B的作用下,曲线Q随温度升高逐渐降低的可能原因是。
-
18、某学生实验小组用如图所示简易装置测定101kPa、298K下的气体摩尔体积。塑料注射器活塞摩擦力大,玻璃注射器活塞摩擦力小,可忽略不计。已知:双氧水分解是放热反应。

实验步骤:
①检查装置的气密性后,向注射器筒中加入少量二氧化锰颗粒(固体体积忽略不计);
②打开止水夹,将20mL玻璃注射器活塞推到0刻度处,关闭止水夹;
③缓缓推动5mL注射器活塞,向注射器筒内注入1mL3%双氧水(密度约为);
④充分反应后,……,读取玻璃注射器中的气体体积为12.3mL。
回答下列问题:
(1)、步骤①中加入少量二氧化锰就能达到实验目的,其原因是 , 产生氧气的物质的量为mol(保留2位有效数字)。(2)、步骤④中省略的操作步骤为 , 101kPa、298K下气体摩尔体积为(保留3位有效数字)。(3)、若反应器中不再产生气泡,立即读取玻璃注射器中的气体体积,则测定的101kPa、298K下的氧气的气体摩尔体积(填“偏大”“偏小”或“无影响”)。(4)、另一化学实验小组提出分解与浓度密切相关,随着浓度降低分解速率降低,当浓度低于一定程度,不再发生分解,同时其浓度随着放置时间也会发生改变。因此提出新的实验方案:I.利用排水法收集VmL101kPa、298K下的氧气,将其缓慢通入稍过量碱性悬浊液,反应生成;
II.向反应后悬浊液加入稍过量KI溶液,再加硫酸酸化,在暗处静置5min,将其配成500mL溶液,取出25.00mL于碘量瓶中,然后加入几滴淀粉试液,用标准溶液滴定生成的()。
①配成500mL溶液时需要的主要玻璃仪器有烧杯、玻璃棒、 , 则达到滴定终点时消耗溶液的体积为amL,则101kPa、298K下气体摩尔体积为;
②下列操作导致101kPa、298K下气体摩尔体积偏大的是(填标号)。
a.步骤I中,氧气通入速率太快
b.步骤II中,配制500mL溶液时,仰视定容
c.步骤II中,滴定前滴定管尖嘴有气泡,滴定结束后尖嘴没有气泡
-
19、常用于电极材料,工业利用制备产生的废渣[含、、、、等]和有机合成废旧还原剂(含、)合成电池级流程如图所示:

已知:①发生水解;②为难溶于水的黑色沉淀;③当溶液中某离子浓度时,可认为该离子沉淀完全;③常温下,几种沉淀的如下表所示:
回答下列问题:
(1)、“加热除钛”操作中加入铁粉的目的是 , “滤渣I”经脱水处理后,在电弧炉中高温加热可与、碳粉(稍过量)反应制备导电陶瓷材料(),写出制备的化学方程式。(2)、“净化”操作时,若溶液体积为200mL,为 , 其他金属阳离子浓度为 , 为了达到流程目的,加入NaF物质的量至少为mol。(3)、“氧化I”操作时,若加入速率过快,会导致用量大幅增大,其原因是 , “氧化II”操作中发生反应的离子方程式为。(4)、、与足量NaOH溶液反应生成、 , 则有机废旧还原剂中含、属于盐(填“酸式”“碱式”或“正”),“沉铁”操作中如果体系pH值过高或过低,均导致产量降低,pH过低导致产量降低的原因是。“沉铁”后的余液中含有大量的 , 溶解度与温度关系如图所示,从余液中提取的操作是。
-
20、总丹参酮是从中药丹参中提取的治疗冠心病的新药,其衍生物K的合成路线如下:

已知:①RCOOR'RCH2OH+R'OH;
②


回答下列问题:
(1)、F中含氧官能团名称为。(2)、下列说法正确的是。a.C→E的反应类型为加成反应 b.B和E均能使酸性溶液褪色
c.沸点顺序: d.化合物F为顺式结构
(3)、DMP是一种含碘化合物,其化学式可以简写为(是一种阴离子),反应生成 , 写出J→K的化学方程式。(4)、制备G的过程中会生成与G互为同分异构体的副产物G' , G'的结构简式为(不考虑立体异构)。(5)、 在一定条件下还原得到化合物M(),写出所有符合下列条件的M的同分异构体的结构简式。
在一定条件下还原得到化合物M(),写出所有符合下列条件的M的同分异构体的结构简式。①能发生银镜反应
②遇溶液显紫色
③核磁共振氢谱显示有四组峰,且面积比为
(6)、总丹参酮的另一种衍生物为丹参酮ⅡA,合成过程中有如下转化。已知X含三种官能团,不与金属Na反应放出 , 丹参酮ⅡA分子中所有与氧原子连接的碳原子均为杂化。
写出X的分子式 , 丹参酮IIA的结构简式。