-
1、常温下,用溶液滴定(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和).下列说法正确的是( )
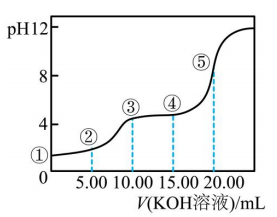 A、点①所示溶液中: B、点②所示溶液中: C、点③所示溶液中: D、点④所示溶液中:
A、点①所示溶液中: B、点②所示溶液中: C、点③所示溶液中: D、点④所示溶液中: -
2、甲烷燃料电池的工作原理如图,下列说法正确的是( )
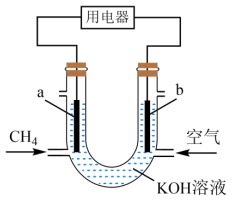 A、a极为正极 B、从b极经溶液流向a极 C、工作一段时间后,b极附近的pH会增大 D、a极的电极反应为
A、a极为正极 B、从b极经溶液流向a极 C、工作一段时间后,b极附近的pH会增大 D、a极的电极反应为 -
3、常温下, , 常温下在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
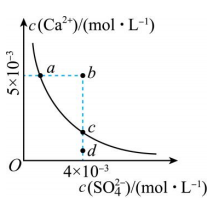 A、加入可使溶液由a点变到b点 B、b点将有沉淀生成,平衡后溶液中一定等于 C、d点溶液通过蒸发可以变到c点 D、a点对应的等于c点对应的
A、加入可使溶液由a点变到b点 B、b点将有沉淀生成,平衡后溶液中一定等于 C、d点溶液通过蒸发可以变到c点 D、a点对应的等于c点对应的 -
4、下列说法中正确的是( )A、的溶液中: B、浓度均为的①②③④ , 由小到大的顺序:④<③<①<② C、向、的混合饱和溶液中加入少量 , 溶液中减小 D、溶液中离子浓度大小顺序为
-
5、、、分别表示酸的电离常数、水的离子积常数、溶度积常数,下列判断正确的是( )A、室温下 , 说明的电离度一定比的大 B、室温下向的醋酸溶液中加入水稀释后,溶液中不变 C、25℃时,均为4的盐酸和溶液中不相等 D、两种难溶电解质做比较时,越小的电解质,其溶解度一定越小
-
6、由下列实验及现象不能推出相应结论的是( )
选项
实验操作
实验现象
解释或结论
A
向溶液中加入的溶液
有无色气体生成
酸性:
B
含和的浊液中通入气体
生成黑色沉淀
溶解度:
C
向均盛有溶液的两支试管中分别滴入和溶液1mL
前者产生气泡的速率更快
催化效果:
D
向浓度均为的和混合溶液中滴加少量溶液
先出现黄色沉淀
A、A B、B C、C D、D -
7、常温下,下列各组离子在指定条件下可能大量共存的是( )A、含有的溶液中:、、、 B、与反应能放出的溶液中:、、、 C、含有的溶液中:、、、 D、使甲基橙变红的溶液中:、、、
-
8、下列关于盐类水解的应用,说法不正确的是( )A、除去溶液中的可加入后过滤 B、水溶液蒸发结晶能得到固体 C、工业上可利用水解制备 D、配制溶液时,先将固体溶于较浓的盐酸中
-
9、下列各图所示装置能达到实验目的的是( )
A
B
C
D
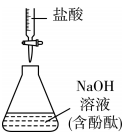
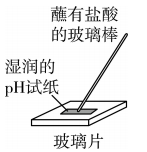
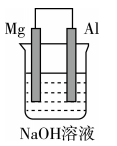

用已知浓度的盐酸测定溶液浓度
用pH试纸测定盐酸的pH
比较Mg和Al的金属性强弱
蒸干溶液制取无水
A、A B、B C、C D、D -
10、下列说法中正确的是( )A、的溶液一定呈酸性 B、将盐酸稀释至 , 所得溶液的为9 C、在常温下,当水电离出的为 , 时,此溶液的可能为1或13 D、将的盐酸与醋酸各分别稀释至 , 所得醋酸的略大
-
11、下列关于离子方程式书写正确的是( )A、用溶液检测: B、溶于水后发生微弱水解: C、用饱和溶液处理水垢: D、溶液中的电离:
-
12、在一定温度下,当固体在水溶液中达到平衡: , 要使固体减少而不变,可采取的措施是( )A、加固体 B、加盐酸 C、加少量水 D、加固体
-
13、下列不能表明是弱电解质的是( )A、的溶液 B、溶液能与纯碱反应 C、室温下溶液呈碱性 D、常温下同浓度溶液的导电性比盐酸弱
-
14、醋酸在水溶液中存在下列电离平衡: , 下列说法不正确的是( )A、加入醋酸钠晶体后,溶液的增大 B、加入碳酸钠,平衡向右移动 C、升高温度,增大 D、加水稀释,溶液中和均减少
-
15、化学与生产、生活息息相关.下列做法正确的是( )A、铵态氮肥和草木灰可以混合施用 B、废水中的、等离子可用处理 C、次氯酸钠溶液呈碱性,可用作胃酸中和剂 D、明矾溶于水形成胶体,可用于杀菌
-
16、用钛白厂的副产品和氯化钾制备硫酸钾,并得到副产品颜料铁红的流程如图:
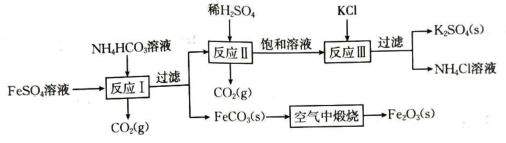
依据该流程回答下列问题:
已知:上述流程中,s表示固体,g表示气体。
(1)、配制硫酸亚铁溶液时,通常加入少量的铁粉,加入铁粉的目的是;“反应I”的离子方程式为;如果向硫酸亚铁溶液中直接滴加氢氧化钠溶液,可观察到的现象是 , 沉淀颜色变化的总反应的化学方程式为。(2)、“空气中煅烧”制取铁红的反应的化学方程式为 , 还原剂是(填化学式)。(3)、“反应Ⅲ”的离子方程式为 , 该反应原理类似氨碱法制小苏打,利用了相同条件下物质溶解性差异的特点,其中(填名称)的溶解度相对其他物质比较小,可以以固体形式析出。 -
17、铁及其化合物在生产、生活中有重要用途。某化学兴趣小组的同学设计了以下两个实验,请回答下列问题:(1)、I.“铁与水反应”,并检验产物的性质。(夹持装置已略去)

装置A中盛放碎瓷片的仪器的名称为 , 装置A的作用是。(2)、装置B中发生反应的化学方程式为。(3)、实验一段时间后,装置E中的实验现象为。(4)、Ⅱ.制备Fe(OH)2。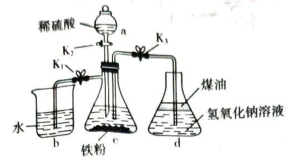
已知:NaOH溶液是用去氧水配制的。
仪器a使用之前需要采取的操作是 , 煤油的作用是。(5)、实验开始时的具体操作是 , 仪器b中产生均匀气泡后的操作是。(6)、设计实验检验仪器c中的金属离子:。 -
18、价一类二维图是基于核心元素的化合价和物质类别研究物质的一种方法。钠元素的价一类二维图如图所示,通过该图,可以从不同角度认识含钠元素的物质的性质及其转化关系,图中a~e均为含钠元素的物质,b为白色固体。回答下列问题:
 (1)、a通常保存在中,a与水反应时能说明a的密度比水小的现象是a在空气中加热时发生反应的化学方程式为(用单线桥法标明电子的转移情况)。(2)、c中阴、阳离子个数比为 , c常用作(填一种用途即可)。(3)、将氯气通入d的溶液中可制得漂白液,该反应的离子方程式为。实验室制取氯气的装置如图:
(1)、a通常保存在中,a与水反应时能说明a的密度比水小的现象是a在空气中加热时发生反应的化学方程式为(用单线桥法标明电子的转移情况)。(2)、c中阴、阳离子个数比为 , c常用作(填一种用途即可)。(3)、将氯气通入d的溶液中可制得漂白液,该反应的离子方程式为。实验室制取氯气的装置如图:
装置I中发生反应的离子方程式为;完善装置Ⅳ:。
-
19、日常消毒应做到安全消毒、有效消毒、绿色消毒。下列是我们常见的几种消毒剂:
①“84”消毒液、②高铁酸钠、③漂白粉、④、⑤、⑥碘酒、⑦75%的酒精、⑧过氧乙酸( , 是一种弱酸)。回答下列问题:
(1)、上述物质中属于电解质的是(填标号);“84”消毒液的有效成分NaClO在水中的电离方程式为。(2)、已知反应 , 则在该反应的条件下,氧化性:(填“>”或“<”) , 当反应中转移电子的数目为时,生成的氧气在标准状况下的体积为L。(3)、高铁酸钠是一种新型净水剂,在水中发生反应:(胶体)。①该反应中,高铁酸钠中铁元素被(填“还原”或“氧化”)。
②某课外活动小组进行胶体的制备及相关性质实验。
制备:若将饱和溶液分别滴入下列物质中,能形成胶体的是(填标号)。
A.冷水 B.沸水 C.浓溶液 D.浓溶液
鉴别:胶体与溶液的鉴别方法是。
胶体区别于溶液最本质的特征是。
-
20、某化学实验兴趣小组为确定某铝镁合金中各组分的含量,设计实验:取50mL硫酸与一定质量的镁铝合金反应,合金全部溶解,向所得溶液中滴加5mol·L-1NaOH溶液至过量,生成沉淀质量与加入NaOH溶液体积的关系如图。下列说法错误的是( )

已知:(可溶于水)
A、段沉淀质量减少是因为能与溶液反应 B、原合金的质量为 C、C点溶液中可大量存在 D、原合金中铝和镁的物质的量之比为1:2