-
1、某温度时,ⅥA元素单质与H2反应生成气态H2X的热化学方程式如下:
①
②
③
请回答:
(1)、上述反应中属于放热反应的是(填序号,下同),属于吸热反应的是。(2)、2 g H2完全燃烧生成气态水,放出的热量为。(3)、请写出O2与H2S反应生成S的热化学方程式。(4)、根据下图写出热化学方程式。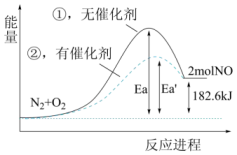 (5)、加入催化剂该反应的反应热是否发生了改变(填“是”或“否”)。
(5)、加入催化剂该反应的反应热是否发生了改变(填“是”或“否”)。 -
2、下图表示H2O2分解时能量随反应进程的变化,下列说法正确的是( )
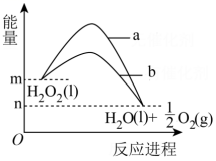 A、曲线a表示加入催化剂时能量随反应进程的变化 B、曲线b表示反应的热效应减小了 C、双氧水催化分解不需要加热,由此推测,催化剂存在下的分解都不需要加热 D、该反应的热化学方程式:
A、曲线a表示加入催化剂时能量随反应进程的变化 B、曲线b表示反应的热效应减小了 C、双氧水催化分解不需要加热,由此推测,催化剂存在下的分解都不需要加热 D、该反应的热化学方程式: -
3、下列热化学方程式正确的是( )A、通常状况下,将1 g氢气在氯气中完全燃烧,放出92.4 kJ热量:; B、已知充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出b kJ热量:; C、1 g炭与适量水蒸气反应生成一氧化碳和氢气,需吸收10.94 kJ的热量: D、已知甲烷燃烧生成二氧化碳和液态水放出的热量为:;
-
4、下面均是正丁烷与氧气反应的热化学方程式(25°,101 kPa):
①
②
③
④
由此判断,正丁烷的燃烧热是( )
A、-2878 kJ/mol B、-2658 kJ/mol C、-1746 kJ/mol D、-1526 kJ/mol -
5、下列说法或表示方法正确的是( )A、吸热反应一定需要加热才能发生 B、氢气与氧气反应生成等量的液态水和水蒸气,后者放出的热量多 C、1 mol硫完全燃烧放热297.3 kJ,其热化学方程式为: D、在稀溶液中: , , 若将含0.5 mol H2SO4的稀硫酸与含1.1 mol NaOH的稀溶液混合,放出的热量等于57.3 kJ
-
6、强酸与强碱的稀溶液发生中和反应的热效应为: 。分别向1 L 的的溶液中加入①浓硫酸;②稀硫酸;③稀硝酸;④稀醋酸,恰好完全反应的热效应分别为、、、 , 下列关系正确的是( )A、 B、 C、 D、
-
7、下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是( )

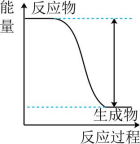
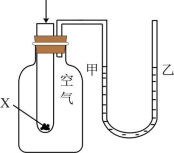
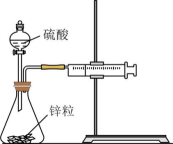
A.温度计的水银柱不断上升
B.反应物总能量大于生成物总能量
C.反应开始后,甲处液面低于乙处液面
D.反应开始后,针筒活塞向右移动
A、A B、B C、C D、D -
8、 (); , 下列能量变化示意图正确的是( )A、
 B、
B、 C、
C、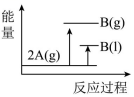 D、
D、
-
9、下列关于反应热的叙述正确的是( )A、当时,表示该反应为吸热反应 B、1 mol H2与0.5 mol O2反应生成1 mol水时放出的热量即是H2的燃烧热 C、热化学方程式中的化学计量数只能是整数,不能是分数 D、1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应放出的热量:CH3COOH<HNO3
-
10、已知 , 和反应过程中的能量变化如图所示。a、b、c、d都表示正数,下列说法正确的是( )
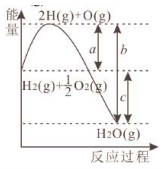 A、c代表新键形成所放出的能量 B、该反应是吸热反应 C、若 , 则 D、
A、c代表新键形成所放出的能量 B、该反应是吸热反应 C、若 , 则 D、 -
11、CO2是一种廉价的碳资源,其综合利用具有重要意义,用CO2与NH3为原料合成尿素是固定和利用CO2的成功范例。
已知:①
②
③
则:反应的为( )
A、 B、 C、 D、 -
12、已知:一些烷烃的燃烧热(101 kPa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量)如表:
化合物
甲烷
乙烷
丙烷
燃烧热
-891.0
-1560.8
-2221.5
下列说法中正确的是( )
A、C—H键的键能为 B、乙烷燃烧的热化学方程式为 C、等质量的三种烷烃完全燃烧,丙烷放出的热量最多 D、由表中数据不能确定C—C键的键能 -
13、已知 ,
,
若使23 g酒精液体完全燃烧,最后恢复到室温,则放出的热量为( )kJ
A、 B、 C、 D、 -
14、已知:的。其中相关的键能数据如下表所示,则x的值为( )
化学键
F—F
N—F
键能
946
x
283
A、471 B、157 C、138 D、756 -
15、已知:氧化锂(Li2O)晶体形成过程中的能量变化如图所示。
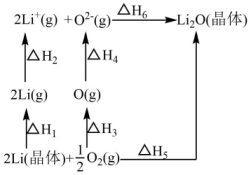
下列说法正确的是( )
A、 , B、 C、 , D、 -
16、在同温同压下,下列各组热化学方程式中,的是( )A、 ; B、 ; C、 ; D、 ;
-
17、关于化学反应与能量的说法正确的是( )A、需要加热的反应都是吸热反应 B、反应物总能量与生成物总能量一定相等 C、断裂化学键要吸收能量 D、燃烧热指的是101 kPa时,1 mol纯物质完全燃烧生成氧化物时所放出的热量
-
18、一种以生石灰(CaO)为原料制备KClO3的流程如图:
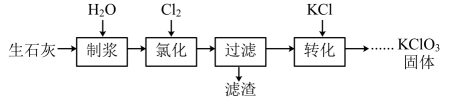 (1)、“制浆”过程中发生的化学反应方程式为。(2)、“氯化”过程氯化过程是Cl2与Ca(OH)2作反应。
(1)、“制浆”过程中发生的化学反应方程式为。(2)、“氯化”过程氯化过程是Cl2与Ca(OH)2作反应。①可以通过缓慢通入的方法提高Cl2的利用率,二者反应生成Ca(ClO3)2的离子方程式为。
②Cl2与Ca(OH)2作用除生成Ca(ClO3)2外,还可能生成Ca(ClO)2 , 若生成含等物质的量氯元素的Ca(ClO3)2与Ca(ClO)2时,消耗的Cl2的物质的量之比为。
③“氯化”过程中会有少量Ca(ClO)2 , 经光照还会有少量无色无味气体生成,该气体可能是(填化学式)。
(3)、“转化”过程各物质的溶解度曲线如图所示。
①Ca(ClO3)2的溶解度曲线是(填A或B),若溶液中KClO3的含量为100g•L-1 , 从该溶液中得到KClO3固体的方法是蒸发浓缩、、、洗涤。
②KClO3与SO2在强酸性条件下可反应制得ClO2 , SO2被氧化为S , 该反应的离子方程式为。
-
19、(1)、I.铁是人体必需的微量元素,严重缺铁时需要服用补铁剂。实验小组为研究某补铁剂中铁元素的价态及其含量,设并进行了如下实验:
【查阅资料】
i.该补铁剂不溶于水,但能溶于人体中的胃液(含盐酸)。
ii.KSCN中的硫元素为-2价。
iii.Fe(OH)3受热分解生成Fe2O3。
实验I.检验该补铁剂中铁元素的价态。
试剂2是。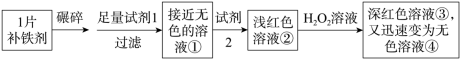 (2)、能证明溶液①中含有Fe2+的实验现象是。(3)、写出Fe2+与H2O2发生反应的离子方程式:。(4)、实验II.测定该补铁剂中铁元素的含量。
(2)、能证明溶液①中含有Fe2+的实验现象是。(3)、写出Fe2+与H2O2发生反应的离子方程式:。(4)、实验II.测定该补铁剂中铁元素的含量。
计算每片该补铁剂含铁元素的质量为g。 (5)、II. 乳酸亚铁是一种很好的补铁剂,制备乳酸亚铁晶体的方法之一是用新制的碳酸亚铁与乳酸溶液反应,某化学社团小组成员模拟上述流程制备碳酸亚铁,反应的装置如图所示:
(5)、II. 乳酸亚铁是一种很好的补铁剂,制备乳酸亚铁晶体的方法之一是用新制的碳酸亚铁与乳酸溶液反应,某化学社团小组成员模拟上述流程制备碳酸亚铁,反应的装置如图所示: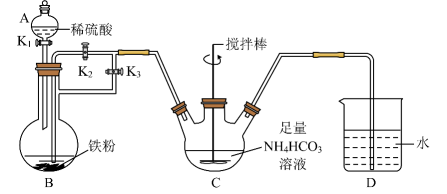
完成下列填空:
小组成员按上图连接好装置,检查装置气密性后加入药品,打开K1和K3 , 关闭K2。
仪器A中名称为。
(6)、反应一段时间后,关闭(填“K1”、“K2”或“K3”,下同),打开 , 观察到B中的溶液会流入C中,同时C中析出沉淀。(7)、B中产生的气体除了把B中溶液压进C外,还有什么作用?。(8)、仪器C中生成的离子方程式为。 -
20、某实验小组同学在配制80mL0.5mol/LNa2CO3(式量为106)溶液时,进行如下实验操作:
①将称量好的Na2CO3固体放入小烧杯中,加适量蒸馏水溶解。
②将Na2CO3溶液冷却到室温后,小心转入____中。
③用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都要小心转入容量瓶中,并轻轻摇匀。
④继续加蒸馏水至液面距刻度线1~2cm处,改用____滴加蒸馏水至溶液凹液面最低点与刻度线相切。
⑤将容量瓶瓶塞塞紧,充分摇匀。
回答下列问题:
(1)、实验中需称量gNa2CO3固体。(2)、实验步骤②④中需使用的仪器名称分别为、 。(3)、所配溶液中Na+物质的量浓度是mol/L。(4)、取出50mL配置好的溶液,加入足量稀盐酸,产生的气体在标况下的体积是L,写出该反应的离子方程式。(5)、经过测定,某同学配制该溶液浓度偏高,则可能的原因是(填序号)①容量瓶用蒸馏水洗涤后未经干燥
②洗涤烧杯内壁后将洗涤液弃去
③转移溶液时,不慎有少量溶液洒出
④定容、摇匀后发现溶液的凹液面低于刻度线
⑤定容时,俯视容量瓶刻度线
(6)、下列关于容量瓶的操作,正确的是。