-
1、回收废旧电池,既可以减轻重金属对环境的污染,又可以变废为宝.对废弃的锂电池正极材料进行氯化处理以回收等金属的工艺路线如图:
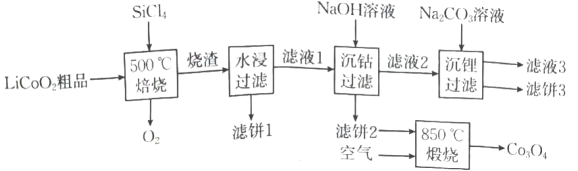
已知:常温下,的电离常数的电离常数 .
回答下列问题:
(1)、写出一条提高焙烧效率的措施: .(2)、若烧渣是和的混合物,写出焙烧时发生反应的化学方程式: .(3)、简述洗涤滤饼3的操作: .(4)、现有相同的以下三种溶液.a.溶液 b.溶液 c.氨水
①(填“>”“<”或“=”)1.
②三种溶液中由水电离出的的浓度的关系是(用a、b、c表示).
(5)、完全沉淀时(溶液中离子浓度小于时可认为沉淀完全),溶液的最小值约为 .(6)、煅烧滤饼2时发生反应的化学方程式为 , 得到的的组成类似于 , 则中与的个数比为 . -
2、丙烷作为奥运火炬的燃料,价格低廉,燃烧后只生成二氧化碳和水,不会对环境造成污染.丙烷燃烧产生的火焰呈亮黄色,比较醒目.
已知:①某些常见化学键的键能数据如下.
化学键
键能/
803
463
348
413
497
② .
(1)、写出表示丙烷燃烧热的热化学方程式:;该反应中反应物的总能量(填“>”“<”或“=”)生成物的总能量.(2)、丙烷的爆炸极限窄,故其为比较理想的便携式燃料电池的燃料.以丙烷为燃料的固体氧化物(能传导)燃料电池的结构示意图如图.该电池利用催化剂对正、负极气体选择催化性的差异而产生电势差进行工作.
①电池工作时,丙烷在(填“正”或“负”)极上发生(填“氧化”或“还原”)反应,电极反应式为 .
②电池工作时,丙烷会与氧气反应转化成合成气(成分为和)而造成电能损失.若丙烷先完全转化成合成气后再发生电极反应,则电能损失率为%,总反应消耗氧气的物质的量(填“增大“减小”或“不变”).
-
3、常温下,向三元酸溶液中滴加的溶液,溶液中含A微粒的物质的量分数随溶液的变化如图所示,下列说法正确的是( )
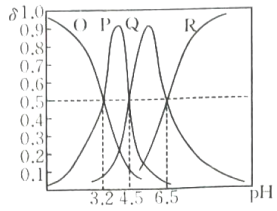 A、P为的物质的量分数与溶液的关系曲线 B、该三元酸的第一步电离是完全的 C、常温下,的水解常数 D、当加入溶液时,溶液显酸性
A、P为的物质的量分数与溶液的关系曲线 B、该三元酸的第一步电离是完全的 C、常温下,的水解常数 D、当加入溶液时,溶液显酸性 -
4、我国某大学科研团队提出用多孔泡沫铁、高度膨化的纳米泡沫碳和添加了的溶液构建独特的“摇椅式”全铁离子电池,电池结构如图(阴离子未标出).下列说法错误的是( )
 A、可增加电解质溶液的导电性 B、充电时,阳极的电极反应式为 C、放电时,电极N为负极 D、放电时,每转移 , 参与反应的铁元素的总质量为
A、可增加电解质溶液的导电性 B、充电时,阳极的电极反应式为 C、放电时,电极N为负极 D、放电时,每转移 , 参与反应的铁元素的总质量为 -
5、如表所示,在三个初始温度均为的容器中进行反应: , 下列说法正确的是( )
容器编号
容器类型
初始体积
反应物的起始投入量/
平衡时
A
B
C
甲
恒温恒容
0
0
2
1.6
乙
恒容绝热
2
1
0
a
丙
恒温恒容
6
3
0
b
A、 B、 C、下该反应的平衡常数 D、平衡时A的正反应速率: -
6、羰基硫是一种粮食熏蒸剂,能防治某些害虫和真菌的危害.一定条件下,与能反应生成羰基硫: , 设为阿伏加德罗常数的值,下列说法正确的是( )A、每转移个 , 吸收能量 B、溶液中含有的数目为 C、中含有的双键数目为 D、与充分反应可生成分子的数目为
-
7、常温下,将溶液和溶液均稀释到 . 下列叙述正确的是( )A、稀释后两溶液中的均减小 B、稀释后两溶液中水的电离程度均减小 C、稀释后两溶液的导电性均增强 D、稀释后两溶液中含硫微粒的关系:
-
8、用石墨作电极,电解溶液的装置如图,当电路中通过时,下列说法错误的是( )
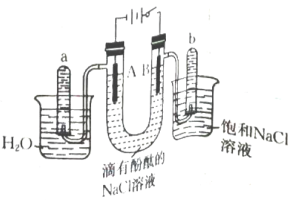 A、滴有酚酞的溶液变为红色 B、通入 , 可使电解质溶液恢复到电解前的状态 C、a试管中的气体体积略大于b试管中的 D、A极的电极反应式仅为
A、滴有酚酞的溶液变为红色 B、通入 , 可使电解质溶液恢复到电解前的状态 C、a试管中的气体体积略大于b试管中的 D、A极的电极反应式仅为 -
9、常温下,下列离子组在指定溶液中能大量共存的是( )A、“84”消毒液中: B、的溶液中: C、常温下,的溶液中: D、久置的饱和氯水中:
-
10、直接甲醇燃料电池具有能量密度高、成本低、运输方便等优点,是便携式电子设备以及电动汽车的理想供能装置.其中,由于甲醇氧化反应涉及多个电子转移步骤,通常需要使用基催化剂来加快反应.在两种催化剂表面的反应历程如图.下列说法错误的是( )
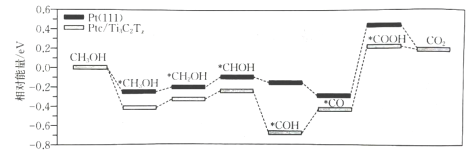 A、使反应焓变降低的程度比大 B、反应过程中有极性键的断裂和形成 C、对甲醇分子具有较高的吸附和活化能力 D、吸附在催化剂表面的过程放出能量
A、使反应焓变降低的程度比大 B、反应过程中有极性键的断裂和形成 C、对甲醇分子具有较高的吸附和活化能力 D、吸附在催化剂表面的过程放出能量 -
11、利用下列装置进行的实验,不能达到预期目的的是( )
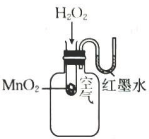

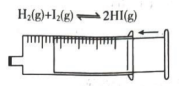
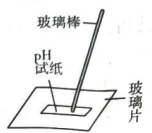
A.探究双氧水分解的热效应
B.制作水果(柠檬)电池
C.探究压强对平衡移动的影响
D.粗测碳酸钠溶液的
A、A B、B C、C D、D -
12、测定中和反应反应热的装置如图.已知: , 下列说法正确的是( )
 A、用金属材质的搅拌器效果更好 B、为使反应充分,应分批加入酸碱 C、测盐酸温度后的温度计可立即测溶液 D、若把盐酸换成醋酸,所测
A、用金属材质的搅拌器效果更好 B、为使反应充分,应分批加入酸碱 C、测盐酸温度后的温度计可立即测溶液 D、若把盐酸换成醋酸,所测 -
13、在一恒容密闭容器中,仅与发生反应生成 , 反应速率分别用表示.若从反应开始至达到平衡的这一段时间内,测得 , 则该反应的方程式为( )A、 B、 C、 D、
-
14、下列关于电化学的说法错误的是( )A、原电池可使化学能转化成电能 B、可通过电解熔融的办法获得单质 C、组成的原电池中作负极 D、电解水时可在水中加入少量以增强溶液导电性
-
15、下列资源利用的措施不是从环境保护角度考虑的为( )A、使用电子鞭炮代替烟花爆竹 B、使用乙醇汽油 C、燃煤脱硫 D、天然气中加入臭味剂
-
16、夏季,受台风影响,某些地区狂降暴雨.下列有关水汽变成雨的过程中焓变和熵变的判断正确的是( )A、 B、 C、 D、
-
17、2023年4月12日21时,中国有“人造太阳”之称的全超导托卡马克核聚变实验装置创造了新的世界纪录,成功实现稳态高约束模式等离子体运行403秒,对提升核聚变能源经济性、可行性,加快实现聚变发电具有重要意义.其原理为 , 下列有关说法正确的是( )A、核聚变为放热反应 B、聚变发电有利于减少碳排放量 C、聚变发电,可使核能全部转化成电能 D、互为同素异形体
-
18、我国力争在2060年前实现“碳中和”,综合利用CO2具有重要的意义。300 MPa、200℃条件下,CO2与H2反应可制得气态甲醇(CH3OH),其反应方程式为。(1)、该反应的能量变化如图所示:
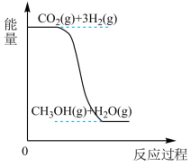
该反应是反应(填“吸热”或“放热”),判断的理由是。
(2)、为了加快该反应的速率,可以采取措施(任写一种)。(3)、在实际生产中,测得合成塔中H2及H2O(g)的物质的量随时间变化如下图所示,则图中代表H2的曲线是(填“X”或“Y”),v(正)与v(逆)相等的点为(填字母)。 (4)、在一定温度下,将2 mol CO2与6 mol H2气体混合于2 L密闭容器中制甲醇,2 min末生成0.8 mol H2O(g):
(4)、在一定温度下,将2 mol CO2与6 mol H2气体混合于2 L密闭容器中制甲醇,2 min末生成0.8 mol H2O(g):①用单位时间内CO2浓度的减小来表示2 min内该反应的平均速率为;
②2 min末容器中H2的物质的量浓度。
-
19、写出下列反应的热化学方程式。(1)、16 g CH4(g)与适量O2(g)反应生成CO2(g)和H2O(l),放出890.3 kJ热量:。(2)、若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量:。(3)、汽油的重要成分是辛烷(C8H18),1 mol C8H18(l)在O2(g)在燃烧,生成CO2(g)和H2O(l),放出5518 kJ热量:。(4)、卫星发射时可用肼(N2H4)作燃料,1 mol N2H4(l)在O2(g)中燃烧,生成N2(g)和H2O(l),放出622 kJ热量:。
-
20、根据要求,回答下列问题:(1)、有机物M经过太阳光光照可转化成有机物N,转化过程如下:

两者稳定性大小是:NM(填“>”“<”或“=”)。
(2)、已知:的燃烧热; 。则(填“>”“<”或“=”)。(3)、使Cl2(g)和H2O(g)通过灼热的炭层,生成HCl(g)和CO2(g)。每消耗1 mol Cl2(g)放出145 kJ热量,则该反应的热化学方程式为。(4)、火箭和导弹表面的涂层是耐高温的物质。将铝粉、二氧化钛粉和石墨粉按一定比例混合在高温下煅烧,所得物质可作耐高温材料,反应的热化学方程式为 。则反应过程中,每转移2 mol电子,放出的热量为kJ。