-
1、在一定温度下的容积不变的密闭容器中发生反应:。下列不能说明反应达到平衡状态的是( )A、气体的压强不再变化 B、的体积分数不再变化 C、混合物的密度不再变化 D、各物质的浓度不再变化
-
2、向一个密闭容器中充入2mol 和1mol , 在一定条件下使其发生反应生成。达到平衡时,下列说法中正确的是( )A、、和的物质的量浓度之比为2∶1∶2 B、完全转化为 C、正反应速率和逆反应速率都为零 D、单位时间内消耗2a mol , 同时消耗2a mol
-
3、下列措施对增大反应速率有明显效果的是( )A、Na与水反应时,增加水的用量 B、Al与稀硫酸反应制取时,改用浓硫酸 C、Zn与稀硫酸反应制取时,将锌片改为锌粉 D、溶液与溶液反应时,增大压强
-
4、《我在故宫修文物》展示了专家精湛的技艺和对传统文化的热爱与坚守,也令人体会到化学方法在文物保护中发挥的巨大作用.某博物馆修复出土铁器的过程如下:(1)、检测锈蚀产物
主要成分的化学式
铁器在具有、等环境中容易被腐蚀。
(2)、分析腐蚀原理一般认为,铁经过了如下腐蚀循环:
①Fe转化为;
②在自然环境中生成 , 该物质中铁元素的化合价为;
③和反应形成致密的保护层,的作用是(填字母).
a.氧化剂 b.还原剂 c.既不是氧化剂也不是还原剂
④保护层被氧化为 , 如此往复腐蚀:
(将反应补充完全)。
(3)、研究发现,对铁的腐蚀会造成严重影响.化学修复:脱氯、还原,形成保护层,方法如下:将铁器浸没在盛有溶液的容器中,缓慢加热至60~90℃.一段时间后,取出器物,用溶液洗涤至无 .①检测洗涤液中有无的方法是;
②脱氯反应: . 离子反应的本质是离子浓度的减小,比较与溶解度的大小:;
③还原生成的离子方程式是
(将反应补充完全)。
-
5、某家用防疫品“84消毒液”的包装说明如下,回答下列问题:
【产品名称】84消毒液
【有效成分】
【规格】
【物质的量浓度】
注:①按一定比例稀释后使用
②不得与酸性产品(如洁厕灵)同时使用
(1)、 “84”消毒液可由与溶液反应制得,该反应的离子方程式为。(2)、欲将“84消毒液”原液稀释配制成的溶液.①配制过程中,需要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒、。
②配制时,需要取用mL“84消毒液”原液.
③下列操作会使溶液中浓度偏高的是。
A.取用的“84消毒液”原液是久置的
B.定容操作时,俯视刻度线
C.量取“84消毒液”原液时,仰视读数
D.定容摇匀后,液面低于刻度线,再加水至刻度线
E.转移时没有洗涤烧杯和玻璃棒
(3)、用次氯酸钠固体配置一定物质的量浓度溶液的消毒液,下列操作正确的是。 (4)、利用如图装置探究84消毒液与洁厕灵(主要成分为盐酸)的反应,当注射器中的洁厕灵注入试管中时,装置内产生黄绿色气体,可观察到试纸的现象是 , 棉花团(蘸有溶液A)的作用是。
(4)、利用如图装置探究84消毒液与洁厕灵(主要成分为盐酸)的反应,当注射器中的洁厕灵注入试管中时,装置内产生黄绿色气体,可观察到试纸的现象是 , 棉花团(蘸有溶液A)的作用是。 (5)、资料查得:“84消毒液”与双氧水混合会反应产生一种常见的无色无味气体,且消毒能力大大降低,写出该反应的离子方程式。
(5)、资料查得:“84消毒液”与双氧水混合会反应产生一种常见的无色无味气体,且消毒能力大大降低,写出该反应的离子方程式。 -
6、铁是人类较早使用的金属之一,运用所学知识,回答下列问题.(1)、I.某学习小组研究腐蚀铜后所得的废液成分并回收铜,进行了如下实验:
滤渣C中所含物质的化学式为;通入F发生反应的离子方程式为。 (2)、 滤渣C与试剂D反应的离子方程式为 , 为测定滤渣中铜的质量分数,取的滤渣与足量的试剂D反应,得到气体(标准状况下),试计算滤渣中铜的质量分数。(3)、II.学习小组同学继续研究铁与水蒸气的反应,分别进行了如图实验
(2)、 滤渣C与试剂D反应的离子方程式为 , 为测定滤渣中铜的质量分数,取的滤渣与足量的试剂D反应,得到气体(标准状况下),试计算滤渣中铜的质量分数。(3)、II.学习小组同学继续研究铁与水蒸气的反应,分别进行了如图实验
实验I中反应的化学方程式是。实验I 实验II 
 (4)、 甲同学观察到实验Ⅰ中持续产生肥皂泡,但实验Ⅱ中溶液B未呈现红色,则溶液B未呈现红色的原因是。(写出反应的离子方程式)(5)、 实验室在制备时必须隔绝空气,否则发生的现象是;反应化学方程式为。
(4)、 甲同学观察到实验Ⅰ中持续产生肥皂泡,但实验Ⅱ中溶液B未呈现红色,则溶液B未呈现红色的原因是。(写出反应的离子方程式)(5)、 实验室在制备时必须隔绝空气,否则发生的现象是;反应化学方程式为。 -
7、电解饱和食盐水的化学反应方程式为 , 现电解消耗的质量为 , 完全反应后,测得烧杯中剩余溶液的体积是 , 请计算(写出计算过程):(1)、求消耗的的物质的量?(2)、 求生成的在标准状况下的体积?(3)、 求生成的的质量?(4)、 反应后所得溶液的物质的量浓度?
-
8、将铁粉加入到的氯化铁溶液中,充分反应后,其结果是( )A、铁粉剩余,溶液呈浅绿色,基本不变 B、向溶液中滴入无色KSCN溶液,仍无色 C、溶液中与物质的量之比为6:1 D、氧化产物与还原产物的物质的量之比为2:5
-
9、将溶于水配成混合溶液,溶液体积为 , 部分离子物质的量如图所示,下列说法错误的是( )
 A、该混合溶液中的物质的量为 B、若将该混合溶液加水稀释至体积为 , 稀释后溶液中的物质的量浓度为 C、若向该混合溶液中逐滴加入溶液至恰好完全沉淀,需溶液 D、该混合溶液中由电离出的浓度为
A、该混合溶液中的物质的量为 B、若将该混合溶液加水稀释至体积为 , 稀释后溶液中的物质的量浓度为 C、若向该混合溶液中逐滴加入溶液至恰好完全沉淀,需溶液 D、该混合溶液中由电离出的浓度为 -
10、某实验小组拟用药品铁粉、稀硫酸和氢氧化钠溶液设计如图所示装置制备氢氧化亚铁,下列说法错误的是( )
 A、装置甲放入药品铁粉、稀硫酸,装置乙盛放氢氧化钠溶液 B、装置甲中铁粉应略为过量,防止被氧化 C、实验开始阶段,应把弹簧夹和都打开 D、一段时间后,关闭弹簧夹和在乙中生成白色絮状沉淀
A、装置甲放入药品铁粉、稀硫酸,装置乙盛放氢氧化钠溶液 B、装置甲中铁粉应略为过量,防止被氧化 C、实验开始阶段,应把弹簧夹和都打开 D、一段时间后,关闭弹簧夹和在乙中生成白色絮状沉淀 -
11、实验是化学研究的基础.下列装置能达到相应实验目的的是( )
 A、甲可用于灼烧碎海带 B、乙可配制一定物质的量浓度的硫酸溶液 C、丙可观察的生成 D、丁可制备
A、甲可用于灼烧碎海带 B、乙可配制一定物质的量浓度的硫酸溶液 C、丙可观察的生成 D、丁可制备 -
12、工业废弃物的资源化回收再利用,可以更大限度地发挥原材料的价值.下图是工业生产纳米磁性氧化铁的流程:

下列说法不正确的是( )
A、用溶液浸泡是为了除去废铁屑表面的铁锈 B、若生产中不通入 , 暴露在空气中生产,将不能得到高纯度产品 C、加适量的是为了将部分氧化为 , 涉及反应: D、溶液A中和的浓度比为1:2 -
13、将一定量的铁粉投入硫酸铜与硫酸铁的混合溶液中,充分反应后有固体剩余.下列分析一定正确的是( )A、剩余固体中只含未反应的铁粉 B、反应后的溶液中只有一种溶质 C、剩余固体中只含有铜 D、反应后的溶液中不可能含有
-
14、已知的溶液中含有 . 下列关于该溶液的说法不正确的是( )A、该溶液中溶质的物质的量浓度为 B、该溶液中含有 C、该溶液中含有的和的总数约为个 D、用量筒量取该溶液时,俯视读数,所得溶液中的物质的量小于
-
15、常温下,下列各组离子在指定溶液中能大量共存的是( )A、澄清透明酸性溶液: B、溶液: C、使酚酞变红的溶液: D、溶液中:
-
16、下列说法不正确的是( )A、用溶液除去镁粉中少量的铝粉 B、可采用饱和食盐水除去中的杂质 C、保存溶液时需要加少量铁粉 D、金属钠保存在煤油中
-
17、下列两种物质反应,若改变条件(反应物用量比或温度)产物不会改变的是( )A、钠与氧气 B、铁与氯气 C、与氢氧化钠溶液 D、木炭与氧气
-
18、将氯气持续通入紫色石蕊试液中,溶液颜色呈如图变化:
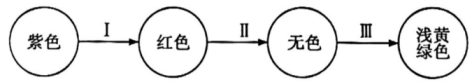
关于溶液中导致变色的微粒I、II、III的判断正确的是( )
A、 B、 C、 D、 -
19、化学与生活密切相关.下列说法正确的是( )A、“84”消毒液具有强氧化性,能用于饮用水杀菌消毒 B、维生素C用作抗氧化剂,说明维生素C具有氧化性 C、放映机到银幕间产生光柱是因为丁达尔效应 D、俗称铁红,可用作红色油漆和涂料
-
20、 下列事实解释错误的是( )A、氯水可以使有色布条褪色,是因为Cl2具有漂白性 B、钠保存在煤油中是因为煤油与钠不反应,且密度比钠小可以隔绝空气 C、钠长期暴露在空气中的产物是Na2CO3 , 原因是钠在空气中生成的Na2O会与水和二氧化碳反应 D、为了提高漂白粉的漂白效果,使用时可加少量盐酸,原因是Ca(ClO)2+2HCl=CaCl2+2HClO