-
1、如图所示,在A处通入未经干燥的氯气,当关闭B阀时,C处的红布条看不到明显现象:当打开B阀,C处的红布条逐渐褪色:则D瓶中盛放的溶液可能是( )

①饱和NaCl溶液 ②NaOH溶液 ③ ④浓硫酸
A、①② B、①③ C、②④ D、③④ -
2、下列图示方法,能完成相应实验的是( )
 A、用图①方式做焰色实验检验钾元素的存在 B、用图②装置在实验室制取 C、用图③探究碳酸氢钠和碳酸钠的热稳定性 D、用图④方式制备胶体
A、用图①方式做焰色实验检验钾元素的存在 B、用图②装置在实验室制取 C、用图③探究碳酸氢钠和碳酸钠的热稳定性 D、用图④方式制备胶体 -
3、钢铁“发蓝”是将钢铁制品浸到某些氧化性的溶液中,在钢铁的表面形成一层四氧化三铁的技术过程。其中一种办法是将钢铁制品浸到亚硝酸钠和浓氢氧化钠的混合溶液中加热到130℃反应。其过程可以用如下化学方程式表示,下列说法不正确的是( )
①
②(未配平)
③
A、碱性条件下,的氧化性比 , 都强 B、反应①、②是氧化还原反应,③不是氧化还原反应 C、反应②配平后,的化学计量数是6 D、整个反应过程中,每有16.8 g Fe参加反应转移0.8 mol电子 -
4、下列实验目的和操作对应不正确的是( )
实验目的
实验操作
A
用豆浆做豆腐
向煮沸的豆浆中加入盐卤(含NaCl、、等)溶液
B
除去溶液中的
向混合液中加入适量NaOH溶液
C
检验某溶液中含
向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色
D
除去中的HCl
混合气体通过盛有饱和溶液的洗气瓶
A、A B、B C、C D、D -
5、设阿伏加德罗常数的值为 , 下列说法不正确的是( )A、常温下,100 g质量分数46%的乙醇()水溶液中,含有的氧原子数为 B、1 mol钠与氧气完全反应生成或时,失电子数目均为 C、与水反应时,生成0.1 mol 转移的电子数为 D、17 g 所含中子数目为
-
6、下列说法或描述不正确的是( )A、100 mL 1 mol·L溶液与150 mL 2 mol·L KCl溶液比较,前者浓度大 B、浓度和体积相同的和溶液充分反应: C、某酸性透明溶液中,、、、一定不能大量共存 D、二氧化碳的水溶液能导电,但二氧化碳属于非电解质
-
7、“化学”和生活密切相关,学好化学会让生活更美好,下列说法错误的是( )A、灿烂美丽的烟花表演中呈出的色彩,实质上是金属元素的焰色反应 B、小苏打指碳酸氢钠,可用于治疗胃酸过多 C、纳米材料分散到适当的分散剂中可以得到胶体,能产生丁达尔现象 D、为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入生石灰包
-
8、某兴趣小组做如下探究实验:
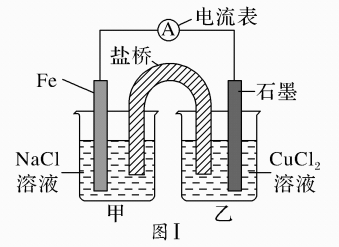
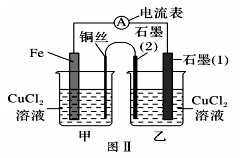 (1)、图Ⅰ为依据氧化还原反应设计的原电池装置,Fe极作原电池的(填“正、负”)极,该原电池反应的离子方程式为。(2)、如图Ⅰ,其他条件不变,若将NaCl溶液、CuCl2溶液分别换为FeCl2、NH4Cl溶液,石墨电极上发生(填“氧化、还原”)反应,写出电极反应方程式。(3)、如图Ⅱ,其他条件不变,将图Ⅰ中NaCl溶液换成CuCl2溶液、盐桥换成弯铜导线与石墨相连成n形,以下对甲、乙装置的判断正确是____(填代号)。A、甲装置作原电池,乙装置不作原电池 B、乙装置作原电池,甲装置不作原电池 C、甲、乙装置都作原电池 D、甲、乙装置都不作原电池(4)、有同学认为常温下将图II甲装置的CuCl2溶液换成浓硝酸,测得电流表A中有电流通过,说明甲装置发生了原电池反应,该原电池的负极是(填化学式),并根据金属的性质解释另一电极作正极的原因
(1)、图Ⅰ为依据氧化还原反应设计的原电池装置,Fe极作原电池的(填“正、负”)极,该原电池反应的离子方程式为。(2)、如图Ⅰ,其他条件不变,若将NaCl溶液、CuCl2溶液分别换为FeCl2、NH4Cl溶液,石墨电极上发生(填“氧化、还原”)反应,写出电极反应方程式。(3)、如图Ⅱ,其他条件不变,将图Ⅰ中NaCl溶液换成CuCl2溶液、盐桥换成弯铜导线与石墨相连成n形,以下对甲、乙装置的判断正确是____(填代号)。A、甲装置作原电池,乙装置不作原电池 B、乙装置作原电池,甲装置不作原电池 C、甲、乙装置都作原电池 D、甲、乙装置都不作原电池(4)、有同学认为常温下将图II甲装置的CuCl2溶液换成浓硝酸,测得电流表A中有电流通过,说明甲装置发生了原电池反应,该原电池的负极是(填化学式),并根据金属的性质解释另一电极作正极的原因 -
9、(1)、某有机物R能与Fe2+形成橙红色的离子[FeR3]2+ , 该离子可被HNO3氧化成淡蓝色的离子[FeR3]3+ , 完成反应的离子方程式:NO3- + 2[FeR3]2+ + 3H+ + 2[FeR3]3+ + H2O(2)、某研究小组对(1)中的反应进行了研究。

用浓度分别为2.0 mol·L-1、2.5 mol·L-1、3.0 mol·L-1的HNO3溶液进行了三组实验,得到c([FeR3]2+)随时间t的变化曲线如图。
①图中对应c(HNO3) = 3.0 mol·L-1时的变化曲线为(填代号III、II、I)。
②c(HNO3) = 3.0 mol·L-1时,在0~1min内,[FeR3]3+的平均消耗速率= mol/(L·min)。
③下列有关说法中,正确的有。
A.平衡后加水稀释,增大
B.[FeR3]2+的平衡转化率:αIII>αII>αI
C.三组实验中,反应速率都随反应进程一直减小
D.体系由橙红色转变为淡蓝色所需时间:tIII>tII>tI
(3)、由R产生的物质L可用于分离稀土,溶液中某稀土离子(用M表示)与L存在平衡:i).M(aq)+L (aq) ML(aq) K1
ii).ML(aq)+L(aq) ML2(aq) K2
研究组配制了M与L起始浓度比c0(M)/c0(L)不同的系列溶液,反应平衡后测定L的含量,测得起始浓度比c0(M)/c0(L)分别为0、a、b时,各成分L的含量S如下表(各成分含L的总量S计为1).

【注】:“<0.01”表示未检测到。
①c0(M)/c0(L)=a时, x=。
②c0(M)/c0(L)=b时,平衡浓度比c平(ML2)/c平(ML)=
 (4)、研究组研究了(3)中M与L反应体系,当C0(L)=1.0×10-5mol·L-1时,测得平衡时各物种L含量C平/C0(L)随C0(M)/C0(L)的变化曲线如图10,C0(M)/C0(L)=0.51时,计算①M的平衡转化率(结果仅保留两位有效数字),②(3)中反应i)的K1.
(4)、研究组研究了(3)中M与L反应体系,当C0(L)=1.0×10-5mol·L-1时,测得平衡时各物种L含量C平/C0(L)随C0(M)/C0(L)的变化曲线如图10,C0(M)/C0(L)=0.51时,计算①M的平衡转化率(结果仅保留两位有效数字),②(3)中反应i)的K1. -
10、磁选后的炼铁高钛炉渣,主要成分有、、、MgO、CaO以及少量的 , 为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
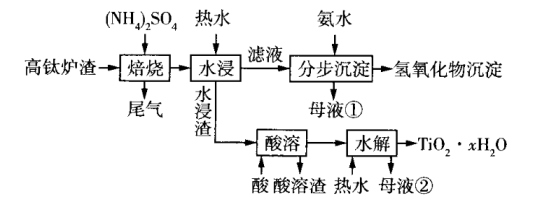
该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH如表所示。
金属离子
开始沉淀的pH
2.2
3.5
9.5
12.4
沉淀完全的pH
3.2
4.7
11.1
13.8
回答下列问题:
(1)、“焙烧”中,几乎不发生反应,、MgO、CaO、转化为相应的硫酸盐,写出转化为的化学方程式。(2)、“水浸”后“滤液”的pH约为2.0,在“分步沉淀”时用氨水逐步调节pH至11.6,依次析出的金属离子是。(3)、“母液①”中浓度为。(4)、“水浸渣”在160℃“酸溶”,最适合的酸是(写名称)。“酸溶渣”的成分是、。(5)、“酸溶”后,将溶液适当稀释并加热,水解析出沉淀,该反应的离子方程式是。(6)、将“母液①”和“母液②”混合,吸收尾气,经处理得 , 循环利用。 -
11、学习小组在实验室中利用下图所示装置制备SO2并进行相关性质的探究。
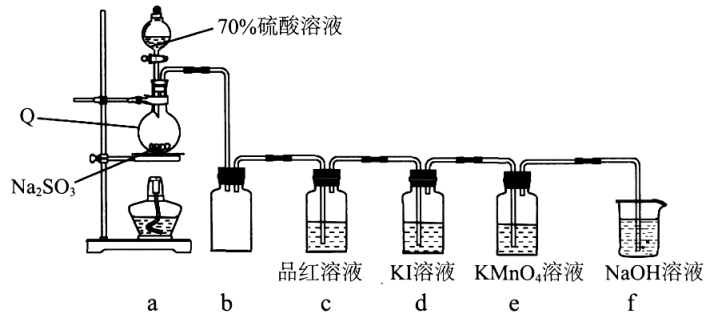
回答下列问题:
(1)、装置a中反应的化学方程式为。(2)、实验开始后,发现装置d中的溶液迅速变黄,继续通入SO2 , 装置d中出现乳黄色浑浊。该小组同学查阅资料得知,存在可逆反应:SO2+4I-+4H+S↓+2I2+2H2O.探究I:探究浓度对上述可逆反应的影响
有同学认为除SO2的浓度外,其他离子的浓度对该可逆反应也有影响。完成实验设计进行验证(SO2体积已折算为标准状况下体积)。
限选试剂:0.1 mol·L-1KI溶液、1.0mol·L-1KI溶液、2.0mol·L-1KI溶液、蒸馏水、浓硝酸、浓盐酸
影响因素
编号
操作
现象
c(I—)
i
取50mL①于锥形瓶中,向其中通入20mL SO2
溶液变为浅黄色
ii
取50mL 1.0mol·L-1 KI溶液于锥形瓶中,向其中通入20mL SO2
溶液迅速变黄
c(H+)
iii
取50mL 1.0mol·L-1 KI溶液和5mL ②于锥形瓶中,向其中通入20mL SO2
溶液迅速变黄
iV
取50mL 1.0mol·L-1 KI溶液和5mL 浓盐酸于锥形瓶中,向其中通入20mL SO2
溶液迅速变黄,且出现乳黄色浑浊
(3)、探究II:探究SO2在KI溶液体系中的反应产物有同学提出上述可逆反应生成的I2可与SO2发生反应:SO2+I2+2H2O=SO42-+2I-+4H+.为进一步探究体系中的产物,完成下列实验方案。
方案
操作
预期现象
结论
i
取适量装置d中浊液,向其中滴加几滴③溶液(填试剂名称),振荡
无明显变化
浊液中无I2
ii
将装置d中浊液进行分离
得淡黄色固体和澄清溶液
取适量分离后的澄清溶液于试管中,④ .
白色沉淀
⑤
⑥综上可知,SO2在KI溶液中发生了歧化反应,其反应的离子方程式为。
-
12、采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇(CH3OH)方向取得重要进展,该反应历程如图所示。下列说法错误的是( )
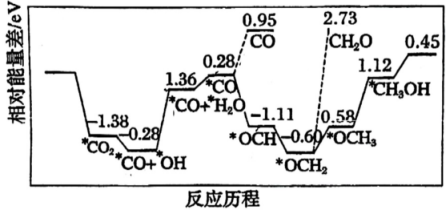 A、总反应焓变 B、上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低*CO+*OH→*CO+*H2O的能量
A、总反应焓变 B、上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低*CO+*OH→*CO+*H2O的能量变化。
C、该催化剂可有效提高反应物的平衡转化率 D、容易得到的副产物有CO和CH2O,其中相对较多的副产物为CO -
13、实验测得0.5 mol·L-1CH3COONa溶液、0.5 mol·L-1CuSO4溶液以及H2O的pH随温度变化的曲线如图所示。下列说法正确的是( )
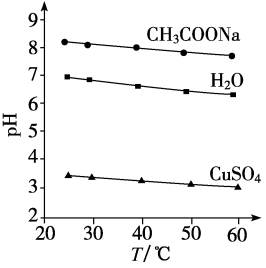 A、随温度升高,纯水中c(H+)>c(OH-) B、随温度升高,CH3COONa溶液的pH降低,是因为CH3COO-水解平衡向逆反应方向移动 C、随温度升高,CH3COONa溶液的c(OH-)减小 D、随温度升高,CuSO4溶液的pH减小是水的电离平衡和水解平衡向正反应方向移动的结果
A、随温度升高,纯水中c(H+)>c(OH-) B、随温度升高,CH3COONa溶液的pH降低,是因为CH3COO-水解平衡向逆反应方向移动 C、随温度升高,CH3COONa溶液的c(OH-)减小 D、随温度升高,CuSO4溶液的pH减小是水的电离平衡和水解平衡向正反应方向移动的结果 -
14、下列关于中和滴定的说法正确的是( )A、用标准浓度HCl溶液滴定弱碱MOH溶液来测定其浓度,选择酚酞为指示剂 B、除去碱式滴定管胶管内气泡的方法是将尖嘴垂直向下,挤压胶管内的玻璃球将气泡排出 C、滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁 D、用稀NaOH滴定盐酸,用酚酞作指示剂,当锥形瓶中溶液由红色变无色时立即停止滴定
-
15、部分弱酸的电离平衡常数如下表:
弱酸
HCOOH
HCN
H2CO3
电离平衡常数(25℃)
Ka1=1.77×10-4
Ka1=4.9×10-10
Ka1=4.3×10-7 ; Ka2=5.6×10-11
下列选项错误的是( )
A、向NaCN溶液中通入少量CO2气体:CN-+H2O+CO2=HCN+HCO B、相同浓度的HCN和NaHCO3的导电能力:HCN>NaHCO3 C、中和等体积、等pH的HCOOH和HCN消耗NaOH的量,前者小于后者 D、等pH的HCOOH和HCN稀释相同的倍数后,pH前者大于后者 -
16、常温下0.1 mol·L-1 ①CH3COOH、②NaOH、③CH3COONa,下列叙述正确的是( )A、①中c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) B、①②等体积混合后,醋酸根离子浓度小于③的二分之一 C、①③等体积混合以后,溶液呈酸性,则c(Na+)>c(CH3COO-)>c(H+) D、①②等体积混合以后,水的电离程度比①③等体积混合后水的电离程度小
-
17、广义的水解观认为:无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别离解成两部分,然后两两重新组合成新的物质。根据上述观点,下列说法不正确的是( )A、BaO2的水解产物是Ba(OH)2和H2O2 B、PCl3的水解产物是HClO和H3PO4 C、Al4C3的水解产物是Al(OH)3和CH4 D、CH3COCl的水解产物是两种酸
-
18、化学是以实验为基础的科学。下列实验操作或做法正确且能达到目的的是( )
选项
操作或做法
目的
A
向两只盛有2mL5%双氧水的试管中,分别滴加5滴饱和溶液和5滴饱和溶液,观察实验现象
探究催化剂对反应速率的影响
B
取5mL0.1mol/LKI溶液于试管中,加入溶液,充分反应后滴入5滴15%KSCN溶液,观察实验现象
探究KI与反应是可逆反应
C
用玻璃棒蘸取NaClO溶液点到干燥的pH试纸中间
测NaClO溶液的pH值
D
在50mL酸式滴定管中装入盐酸,调整初始读数为30.00mL后,将剩余盐酸放入锥形瓶
取20.00mL盐酸
A、A B、B C、C D、D -
19、常温下,下列各组离子在指定溶液中因完全双水解而不能大量共存的是( )A、pH=1的溶液中:Fe2+、、、Na+ B、H+、NH4+、CH3COO-、 C、由水电离的c(H+)=1×10-14 mol/L的溶液中:Ca2+、K+、Cl-、 D、K+、Al3+、、AlO2-
-
20、铅蓄电池的两极分别为Pb、PbO2 , 电解质溶液为H2SO4溶液,工作时的电池反应为:
Pb+ PbO2+2H2SO4 =2PbSO4+2H2O,下列结论正确的是( )
A、Pb为正极,被氧化 B、电池工作时,电解质溶液的pH不断减小 C、向PbO2极移动 D、电池工作时,电解质溶液的pH不断增大