相关试卷
- 湖南省长沙市2016-2017学年九年级化学一模考试试卷
- 广东省东莞市中堂星晨学校2016-2017学年九年级化学一模考试试卷
- 广东省茂名高州市东岸中学2016-2017学年九年级化学一模考试试卷
- 广东省广州市花都区2016-2017学年九年级化学一模考试试卷
- 广西柳州市柳南区2014-2015学年九年级化学一模考试试卷
- 北京市西城区2017—2018学年九年级上学期化学期末考试试卷
- 北京市海淀区2017-2018学年九年级上学期化学期末考试试卷
- 北京市朝阳区2017-2018学年九年级上学期化学期末考试试卷
- 北京市丰台2017-2018学年九年级上学期化学期末考试试卷
- 广东省深圳市罗湖区2017-2018学年九年级上学期化学期末考试试卷
-
1、阅读下列短文,回答相关问题。
自然界中的“氮循环”
在自然界里,氮元素主要以氮分子的形式存在于空气中,部分氮元素存在于动植物体内的蛋白质中,还有部分氮元素存在于土壤、海洋里的硝酸盐和铵盐中。氮是生物体生命活动不可缺少的重要元素。自然界是怎样通过氮的循环为生物体提供氮元素的呢?
将大气中的氮气转化为氮的化合物的过程叫作氮的固定。大自然通过闪电释放的能量将空气中的氮气转化为含氮的化合物,或者通过豆科植物的根瘤菌将氮气转化成氨,从而实现自然固氮;人类则通过控制条件,将氮气转化为氮的化合物,实现人工固氮。工业合成氨是重要的人工固氮途径,不仅为农作物的生长提供必需的氮元素,也为其他化工产品的生产提供了重要原料。
N2是合成氨工业的重要原料,氨气(NH3)能制造化肥,还能通过催化氧化生产硝酸(HNO3)在高温或放电的条件下,N2与O2反应生成NO,NO进一步氧化生成NO2。大气中过量的NOx和水体中过量的 , 均是污染物。催化还原可将烟气和机动车尾气中的NO转化为N2 , 也可将水体中的转化为N2。自然界多种形态的氮及其化合物间的相互转化,形成了自然界的“氮循环”(如图)。
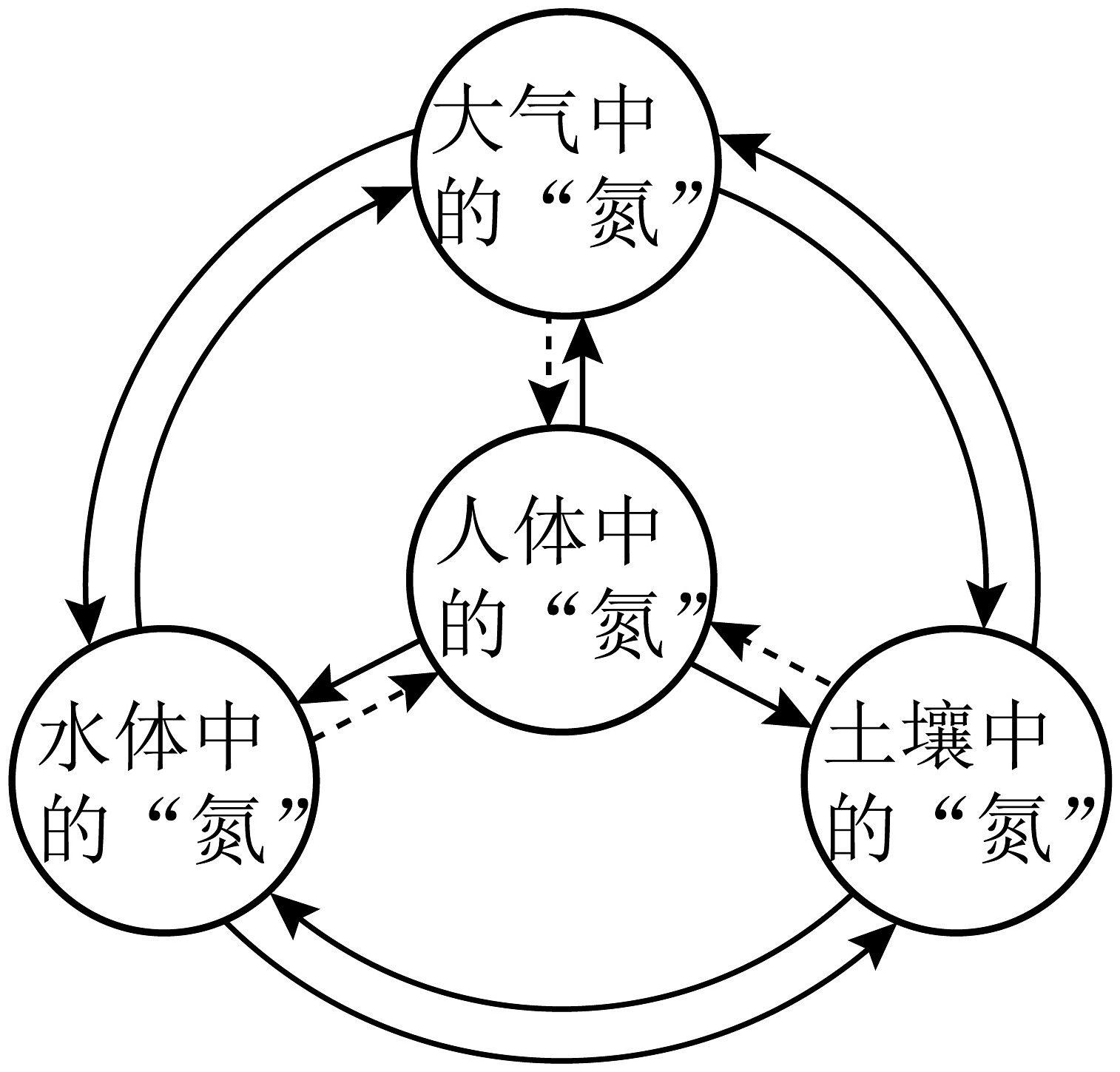
大气、水、土壤与人们的生活息息相关。人类和其他生物生存的生物圈与大气圈、水圈和岩石圈间不断进行着物质和能量的交换,共同构成了地球生态系统。
(1)、下列物质属于复合肥的是________(填字母)。a.NH4Cl b.KNO3 c.NH4NO3
(2)、我国《地表水环境质量标准》中规定:一级饮用水源中氨氮含量小于0.5mg/L、总氮含量小于30mg/L。0.5mg/L的含义是________。(3)、机动车尾气中含有NO的原因可能是________。(4)、氨气在加热和有催化剂(如铂)的条件下,被氧气氧化生成一氧化氮和水。写出反应的化学方程式:________。(5)、下列叙述正确的是________(填字母)。a.自然界中存在氮循环,空气中N2的含量相对稳定
b.水体中过量的 , 转化为N2的过程属于氮的固定
c.科研人员将N2与H2O在一定条件下转化为NH3和O2可实现人工固氮
-
2、《天工开物》是一部综合性的科学技术著作。完成下面小题。
 (1)、制盐。“布灰种盐”的场景如图所示。
(1)、制盐。“布灰种盐”的场景如图所示。(1)“先日撒灰”。古人在预计晴天有雾的前天,在海边沙地上撒上草木灰(主要成分为K2CO3)。K2CO3属于(填物质类别)。
(2)“日中扫盐”。布灰后,海盐水渗入草木灰,经过日晒的草木灰中出现海盐颗粒。海盐析出属于(填“物理”或“化学”)变化。
(3)“布灰种盐”获得海盐。食盐主要成分的化学式为。
(2)、造纸。竹子造纸的流程如下:
(1)“浸泡”的目的是软化纤维。竹子含有纤维素[(C6H10O5)n],纤维素中碳、氢、氧的原子个数比为。
(2)“蒸煮”时,利用石灰浆[主要成分为Ca(OH)2]和草木灰水的碱性,达到除去木素的目的。将石灰浆和草木灰水混合后效果更好,原因是。
(3)“捞纸”与化学实验中物质分离的(填字母)操作相似。
a.溶解 b.过滤 c.蒸发
(3)、炼锌。古代炼锌原理与泥罐结构如图所示,锌的熔点为 , 沸点为。
(1)煤属于(填“可再生”或“不可再生”)能源。
(2)ZnCO3在300℃时分解为ZnO,反应区将ZnO转化为Zn的物质是。
(3)冷凝区中,锌由气态变为液态。该过程(填“放出”或“吸收”)热量。
(4)“泥封”的目的是。
-
3、可燃物R由碳、氢、氧中的一种或几种元素组成。一定质量的R和氧气在密闭容器中燃烧,反应前后各物质的质量如表。
物质
R
氧气
二氧化碳
水
一氧化碳
反应前质量
m1
m2
0
0
0
反应后质量
0
0
m3
m4
m5
下列叙述错误的是
A、m3=0,m5=0时,R中一定含有氢元素 B、时,R中一定含有碳元素,可能含有氧元素 C、时,R中一定含有碳元素和氢元素,可能含有氧元素 D、时,R中一定含有碳、氢、氧三种元素 -
4、取少量久置于空气中的碱石灰(NaOH和CaO的混合物)样品M,加足量水溶解,出现白色沉淀。取上层清液 , 加足量稀盐酸,出现气泡。由实验得出的结论正确的是A、M中一定有Na2CO3 B、N中一定有Ca(OH)2 C、M中一定有CaCO3 D、N中一定有NaOH
-
5、NaCl、KCl的溶解度曲线如图所示。下列叙述正确的是
 A、KCl的溶解度大于NaCl的溶解度 B、T℃时,KCl和NaCl的溶解度相等 C、40℃时,KCl饱和溶液的溶质质量分数为 D、80℃时,KCl不饱和溶液降温,肯定无晶体析出
A、KCl的溶解度大于NaCl的溶解度 B、T℃时,KCl和NaCl的溶解度相等 C、40℃时,KCl饱和溶液的溶质质量分数为 D、80℃时,KCl不饱和溶液降温,肯定无晶体析出 -
6、下列实验方案能达到实验目的的是
选项
实验目的
实验方案
A
检验白醋具有酸性
取样,滴加酚酞溶液
B
鉴别羊毛线和棉线
取样,分别灼烧,闻气味
C
除去CO2气体中的HCl
通入足量的氢氧化钠溶液
D
配制50g质量分数为16%的NaCl溶液
称8gNaCl放入烧杯,加50mL水,搅拌
A、A B、B C、C D、D -
7、下列概念之间存在如图所示“并列”关系的是

选项
A
B
C
D
概念
单质
酸溶液
不饱和溶液
氧化反应
化合物
酸性溶液
稀溶液
化合反应
A、A B、B C、C D、D -
8、在给定条件下,下列物质间的转化能实现的是A、 B、 C、 D、
-
9、锂电池应用广泛。锂在元素周期表中的信息和锂原子的结构示意图如图所示。下列叙述正确的是
 A、锂的原子序数为3 B、锂的相对原子质量为6.941g C、锂原子中的核外电子数为1 D、锂原子在化学反应中容易得到电子
A、锂的原子序数为3 B、锂的相对原子质量为6.941g C、锂原子中的核外电子数为1 D、锂原子在化学反应中容易得到电子 -
10、富氢水是指含有氢气的水。镁与水反应可生成氢气,镁储氢、释氢的过程如图所示。完成下面小题。
 (1)、下列化学用语表达的意义正确的是A、H2—2个氢原子 B、H+——氢元素的化合价为 C、2OH-——2个氢氧根离子 D、H2O——水由氢原子和氧原子构成(2)、镁与水反应的化学方程式为 , 该反应的类型属于A、化合反应 B、分解反应 C、置换反应 D、复分解反应(3)、下列叙述错误的是A、富氢水中含有氢分子 B、常温常压下氢气易溶于水 C、镁和稀盐酸反应可生成氢气 D、镁是一种储氢材料
(1)、下列化学用语表达的意义正确的是A、H2—2个氢原子 B、H+——氢元素的化合价为 C、2OH-——2个氢氧根离子 D、H2O——水由氢原子和氧原子构成(2)、镁与水反应的化学方程式为 , 该反应的类型属于A、化合反应 B、分解反应 C、置换反应 D、复分解反应(3)、下列叙述错误的是A、富氢水中含有氢分子 B、常温常压下氢气易溶于水 C、镁和稀盐酸反应可生成氢气 D、镁是一种储氢材料 -
11、下列物质不属于溶液的是A、泥浆水 B、食盐水 C、蔗糖水 D、苏打水
-
12、氮化镓()可用于制造太阳能电池。下列叙述正确的是A、镓属于非金属元素 B、氮化镓属于混合物 C、氮化镓属于复合材料 D、太阳能属于新能源
-
13、图是甲、乙两物质在一定条件下反应的示意图,下列说法不正确的是
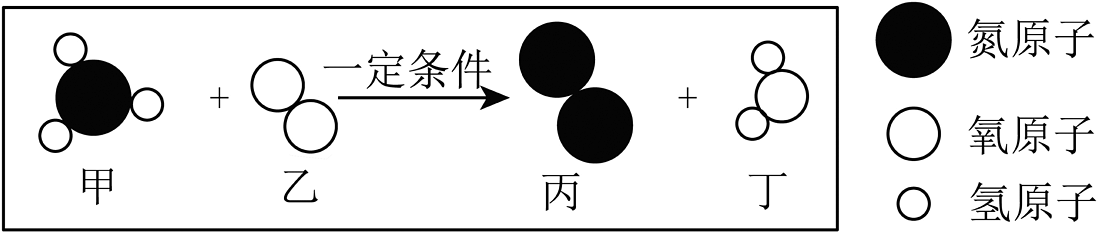 A、该反应前后原子数目不变 B、该反应前后共有两种化合物 C、参加反应的甲和乙分子个数比为 D、反应生成的丙和丁质量比为
A、该反应前后原子数目不变 B、该反应前后共有两种化合物 C、参加反应的甲和乙分子个数比为 D、反应生成的丙和丁质量比为 -
14、金属材料发展史是人类不断突破技术瓶颈、推动文明进步的缩影。古代青铜铁器、工业时代钢铁与铝、现代高性能合金,每一次材料的革新都深刻影响了社会生产力和科技发展。(1)、商代已掌握青铜铸造技术,而铁器直至春秋才普及。请设计实验验证铜、铁的金属活动性顺序,写出操作步骤、现象及结论:________。(2)、用含Fe2O380%的赤铁矿200吨与CO高温反应炼铁,理论上可制得铁多少吨?(假设杂质不参与反应;根据化学方程式计算,写出过程)(3)、钛合金制品放在海水中数年,取出后仍光亮如新。由此可知钛合金具有的化学性质是________(写出一点即可)。
-
15、硫化钠(Na2S)是一种重要的化工原料,广泛应用于矿业、造纸、化学合成等工业。以Na2SO4为原料制备Na2S的部分流程如图所示。

【查阅资料】:H2S水溶液性质与盐酸相似,属于酸,直接排放会污染环境。
(1)、实验前需将Na2SO4固体研磨至0.2mm,其目的是________。(2)、设备1中,通氢气反应前需先通氮气,原因是________。(3)、不同催化剂、不同温度对制备Na2S反应转化率的影响不同。结合图,应选择的催化剂为 , 温度为℃。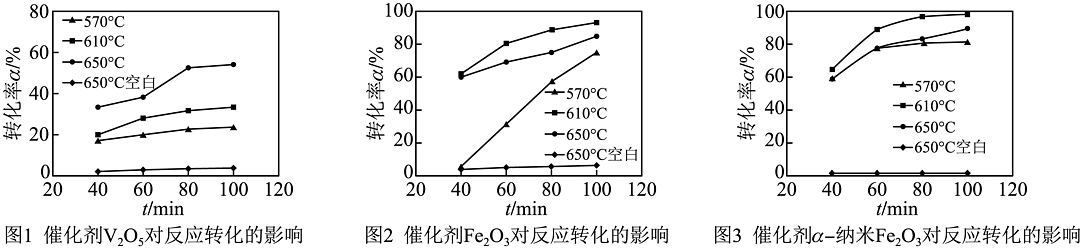 (4)、设备2中,NaOH溶液与H2S发生反应的化学方程式为 , 该反应的基本反应类型为反应。(5)、一定温度下,Na2S溶液经过蒸发浓缩形成饱和溶液,继续恒温蒸发会有Na2S晶体析出,在结晶过程中溶液的溶质质量分数________(选填“变大”“变小”或“不变”)。(6)、用煤粉与Na2SO4在900~1200℃煅烧也可以制备Na2S,其主要反应的化学方程式是2C+Na2SO4Na2S+2CO2↑,相较于上述的H2催化制Na2S生产工艺,该工艺的缺点是________(写出一点即可)。
(4)、设备2中,NaOH溶液与H2S发生反应的化学方程式为 , 该反应的基本反应类型为反应。(5)、一定温度下,Na2S溶液经过蒸发浓缩形成饱和溶液,继续恒温蒸发会有Na2S晶体析出,在结晶过程中溶液的溶质质量分数________(选填“变大”“变小”或“不变”)。(6)、用煤粉与Na2SO4在900~1200℃煅烧也可以制备Na2S,其主要反应的化学方程式是2C+Na2SO4Na2S+2CO2↑,相较于上述的H2催化制Na2S生产工艺,该工艺的缺点是________(写出一点即可)。 -
16、
人们常被蚊虫叮咬所困扰。某家用灭蚊器采用“诱蚊剂”诱蚊、搭配“灭蚊装置”抓捕灭蚊。该诱蚊剂的主要成分是酵母和蔗糖。酵母分解蔗糖产生的CO2能模拟人体呼出的气体,蔗糖甜味可增加诱饵吸引力,以蚊虫喜爱的气味和食品双重诱蚊。
【查阅资料】①CO2在浓度较低时就对蚊虫有引诱效应,且对环境安全友好;
②将过量的CO2持续通入澄清石灰水中,会生成易溶于水的Ca(HCO3)2。
(1)酵母分解蔗糖属于________(选填“物理”或“化学”)变化。
(2)为检验该诱蚊剂是否如宣传中所说“产生了CO2 , 小深提前在塑料瓶中装入诱蚊剂。24小时后用澄清石灰水检验CO2 , 其原理是________(用化学方程式表示)。振荡后,观察到石灰水无明显变化。
【假设】猜想一:未产生CO2;猜想二:产生CO2的量较少;猜想三:产生CO2的量过多。
【实验】小圳利用CO2传感器测定人体呼出气体、装有诱蚊剂的瓶内、空气中CO2含量变化。实验结果如图:

【结论】
(3)分析可得,猜想________正确。
【应用】
(4)该诱蚊剂在________(选填“通风好”或“较封闭”)的环境下诱蚊效果更好。
【自制CO2诱蚊剂】为寻找合适的原料,实验小组利用家中常见的酸和碳酸盐进行实验,记录如表:
碳酸盐酸
纯碱
钙片(含碳酸钙)
鸡蛋壳
白醋
反应过快,混杂醋味
反应产生气体较少,成本高,混杂醋味
缓慢释放气体,成本低,混杂醋味
柠檬酸
反应过快
反应产生气体较少,成本高
缓慢释放气体,成本低,无异味
(5)从微观角度解释“闻到醋味”的原因是________。
(6)白醋(主要成分为醋酸CH3COOH,水溶液中能离解出醋酸根CH3COO-和氢离子H+)与纯碱溶液反应的化学方程式为:2CH3COOH+Na2CO3=2CH3COONa+H2O+________。(请把化学反应方程式填写完整)
(7)综上表格,自制家用CO2诱蚊剂最佳原料为________。
-
17、能源革新与绿色未来。
传统化石燃料推动了工业革命,却带来了资源枯竭与环境污染的双重危机。新能源的研发与应用成为破解这一困境的关键突破口。
在交通领域,新能源汽车正加速发展,其中锂离子电池作为核心动力来源备受瞩目。锂离子电池具有电压高、比能量大、循环寿命长、安全性能好、自放电小、充电快速、工作温度范围较宽等优点。但锂离子电池在使用、储存过程中容量会缓慢衰退,其衰退速率与充电电量和储存温度的关系如图所示。
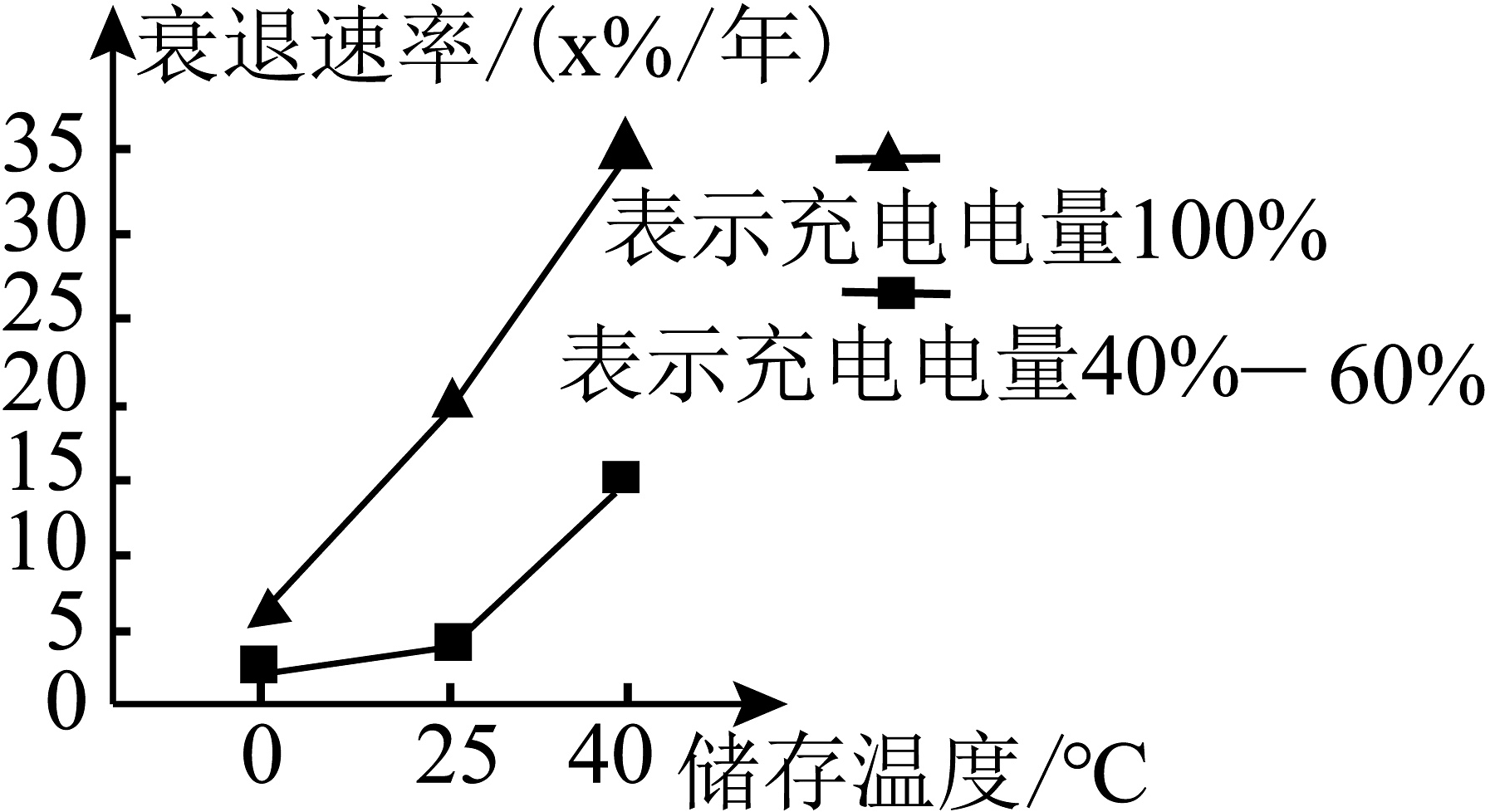
航空航天方面,我国自主研制的朱雀二号遥二运载火箭作为全球首枚成功入轨的液氧甲烷火箭,填补了国内相关技术的空白。推进剂是决定火箭动力的关键因素,液氧煤油、液氧液氢、液氧甲烷是常见的三种液体火箭推进剂。其中,液氧甲烷具有成本低、绿色环保、燃烧效率高、易制取等特点。
随着科技发展,能源领域的变革将更为迅猛。多种形式的新能源将逐渐走向成熟,为人类的未来发展铺就一条绿色之路。
(1)、锂离子电池的优点有________(写出一点即可)。(2)、读图分析,下列锂离子电池储存条件最优的是______(填选项)。A、充电电量50%,储存温度25℃ B、充电电量100%,储存温度40℃ C、充电电量50%,储存温度40℃ D、充电电量100%,储存温度25℃(3)、液体火箭推进剂中助燃剂是。发动机点火后燃料燃烧,点火的作用是。液氧液氢推进剂燃烧的化学方程式为。(4)、请你写出另外一种新能源:________。 -
18、兴趣小组探究酸碱性对H2O2分解快慢的影响。60℃时,每次向10g30%的H2O2溶液滴加调节剂,使溶液的pH从3依次调至13,测得30分钟内产生气体的体积随pH的变化关系如图1。下列分析正确的是
 A、反应原理:2H2O2=2H2O+O2↑;pH越大,H2O2分解越快 B、图2分液漏斗存放调节剂,可通过调节滴加量控制溶液的pH C、常温下,实验室保存H2O2溶液可控制在pH=9的碱性环境中 D、由该实验可知,同一种反应物,反应条件不同,生成物种类不同
A、反应原理:2H2O2=2H2O+O2↑;pH越大,H2O2分解越快 B、图2分液漏斗存放调节剂,可通过调节滴加量控制溶液的pH C、常温下,实验室保存H2O2溶液可控制在pH=9的碱性环境中 D、由该实验可知,同一种反应物,反应条件不同,生成物种类不同 -
19、下列实验方案能达到目的的是
选项
目的
方案
A
除去铁丝上的铁锈
将生锈的铁丝长时间浸泡在稀盐酸中
B
除去CO2中少量HCl
将混合气体通入NaOH溶液中
C
鉴别NH4NO3固体和蔗糖
取等质量样品,分别加入适量等体积的水,测量温度变化
D
检验NaOH溶液是否变质
取样,滴加酚酞溶液,观察
A、A B、B C、C D、D -
20、下列实验设计不能达到目的的是
目的
A.测定空气中O2的含量
B.探究水的组成
C.探究可燃物燃烧的条件
D.探究O2对铁钉锈蚀的影响
实验设计
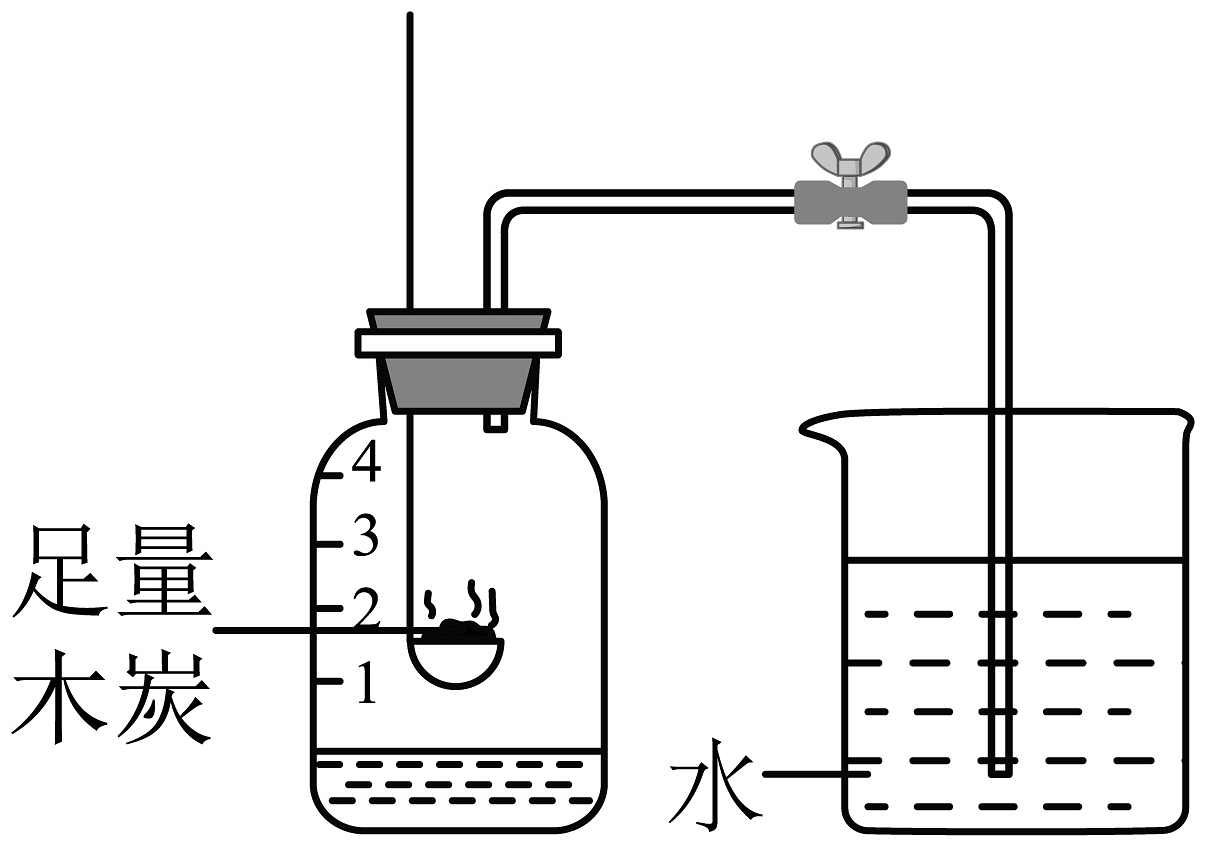
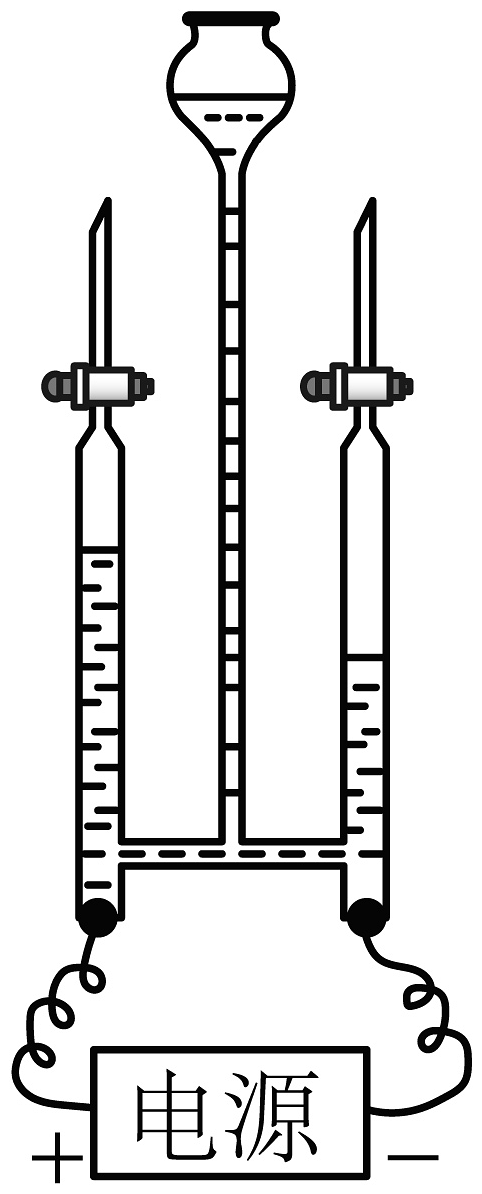

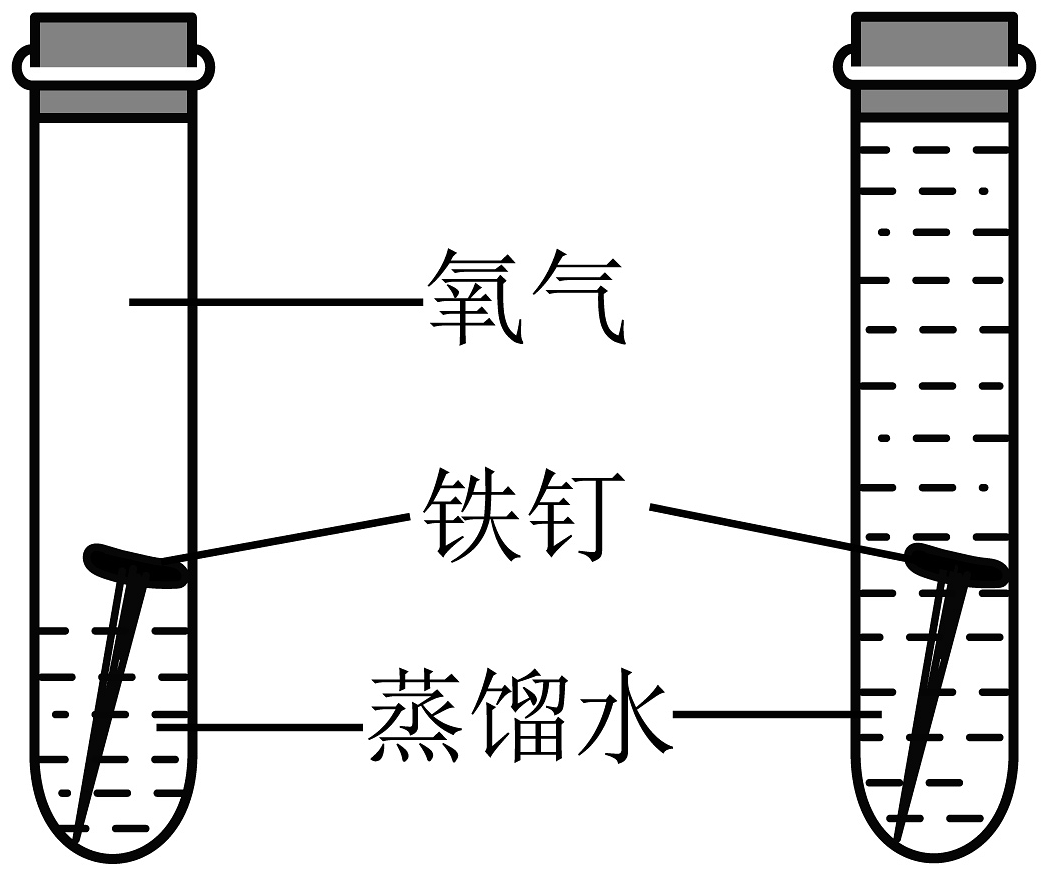 A、A B、B C、C D、D
A、A B、B C、C D、D