广东省东莞市中堂星晨学校2016-2017学年九年级化学一模考试试卷
试卷更新日期:2018-03-01 类型:中考模拟
一、单选题
-
1. 下列成语包含了化学变化的是( )A、刻舟求剑 B、花香四溢 C、百炼成钢 D、凿壁偷光2. 下列实验操作中,错误的是( )A、
 滴加液体
B、
滴加液体
B、 加热液体
C、
加热液体
C、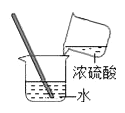 稀释浓硫酸
D、
稀释浓硫酸
D、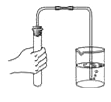 检查气密性
3. 以下说法中正确的是( )A、中和反应有盐和水生成,因此有盐和水生成的反应一定是中和反应 B、氧化物中含氧元素,而含氧元素的化合物不一定是氧化物 C、碱中都含氢元素,所以含氢元素的化合物一定是碱 D、置换反应一定有单质生成,所以有单质生成的反应一定是置换反应4. 水是生产生活中不可缺少的物质.下列关于水的说法中,不合理的是( )A、用淘米的水浇花可节约水资源 B、通过化学变化可以直接将水转变为汽油 C、水在催化剂和太阳能的共同作用下可分解获得氢能 D、浓硫酸沾上皮肤,必须先用大量水冲洗5. 山林里空气中的自由电子附着在氧分子上形成负氧离子(O2﹣),被称为“空气维生素”.O2﹣的相对分子质量是( )A、16 B、32 C、32 g D、336. ZPT常用作洗发液的主要去屑因子,化学式为C10H8N2O2S2Zn,ZPT不溶于水、无异味,具有极强的杀灭真菌作用。下列关于ZPT说法正确的是( )A、ZPT中有25个原子 B、ZPT是有机高分子化合物 C、ZPT是由五种元素组成的 D、不溶于水、无异味属于物理性质7. 在加热条件下,向装有10gCuO的硬质玻璃管中通入H2一段时间,最终玻璃管中剩余固体8.4g.则下列说法正确的是( )A、该反应中CuO发生氧化反应 B、反应生成Cu的质量为8.4g C、参加反应的CuO占原总质量的80% D、反应生成H2O的质量为1.6g8. 根据反应3NO2 + H2O → 2HNO3 + X,推断X的化学式为( )A、N2 B、NO C、N2O3 D、N2O59. 下列关于碳和碳的氧化物知识网络图(图中“→” 表示转化关系,“……”表示相互能反应)说法正确的是( )
检查气密性
3. 以下说法中正确的是( )A、中和反应有盐和水生成,因此有盐和水生成的反应一定是中和反应 B、氧化物中含氧元素,而含氧元素的化合物不一定是氧化物 C、碱中都含氢元素,所以含氢元素的化合物一定是碱 D、置换反应一定有单质生成,所以有单质生成的反应一定是置换反应4. 水是生产生活中不可缺少的物质.下列关于水的说法中,不合理的是( )A、用淘米的水浇花可节约水资源 B、通过化学变化可以直接将水转变为汽油 C、水在催化剂和太阳能的共同作用下可分解获得氢能 D、浓硫酸沾上皮肤,必须先用大量水冲洗5. 山林里空气中的自由电子附着在氧分子上形成负氧离子(O2﹣),被称为“空气维生素”.O2﹣的相对分子质量是( )A、16 B、32 C、32 g D、336. ZPT常用作洗发液的主要去屑因子,化学式为C10H8N2O2S2Zn,ZPT不溶于水、无异味,具有极强的杀灭真菌作用。下列关于ZPT说法正确的是( )A、ZPT中有25个原子 B、ZPT是有机高分子化合物 C、ZPT是由五种元素组成的 D、不溶于水、无异味属于物理性质7. 在加热条件下,向装有10gCuO的硬质玻璃管中通入H2一段时间,最终玻璃管中剩余固体8.4g.则下列说法正确的是( )A、该反应中CuO发生氧化反应 B、反应生成Cu的质量为8.4g C、参加反应的CuO占原总质量的80% D、反应生成H2O的质量为1.6g8. 根据反应3NO2 + H2O → 2HNO3 + X,推断X的化学式为( )A、N2 B、NO C、N2O3 D、N2O59. 下列关于碳和碳的氧化物知识网络图(图中“→” 表示转化关系,“……”表示相互能反应)说法正确的是( )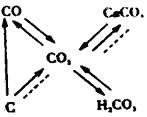 A、“C……CO2”的反应是放热反应 B、“CO→CO2”的反应类型为置换反应 C、“CO2→CaCO3”的反应可用于检验二氧化碳 D、“CO2 H2CO3”的反应可用酚酞试剂验证10. “绿色化学”是21世纪化学科学发展的重要方向之一,其核心是从源头上减少对环境的污染,你认为下列不符合“绿色化学”的是( )
A、“C……CO2”的反应是放热反应 B、“CO→CO2”的反应类型为置换反应 C、“CO2→CaCO3”的反应可用于检验二氧化碳 D、“CO2 H2CO3”的反应可用酚酞试剂验证10. “绿色化学”是21世纪化学科学发展的重要方向之一,其核心是从源头上减少对环境的污染,你认为下列不符合“绿色化学”的是( )
A、不使用任何化学物质 B、使用太阳能、氢能等清洁能源 C、少排或不排放有害物质 D、对废气、废水、废渣严格处理11. 向氧化铜和锌粉的混合物中加入一定量的稀硫酸,反应停止后过滤,再向滤液中插入铁片,铁片无变化.以下判断正确的是( )
A、滤液中一定含有铜和锌 B、滤液中一定含有Zn2+ C、滤液中一定含有铜 D、滤液中一定含有Cu2+12. t℃时,向一支盛有0.15g熟石灰的烧杯中加入50g水,充分振荡后静置,烧杯底部仍有未溶解的白色固体.下列相关叙述正确的是( )A、升高温度上层清液变为不饱和溶液 B、t℃时,熟石灰的溶解度为0.3g C、烧杯中溶液的质量小于50.15g D、上层清液中溶质质量分数大于0.3%13. 建立微观和宏观之间的联系是一种科学的思维方式,下列叙述错误的是( )A、温度升高使原子之间的间隔变大,因此夏天钢轨之间的缝隙变小 B、冰和干冰的化学性质存在差异,因为构成它们的分子不同 C、当一铜块的所有原子都被移出之后,该铜块的质量只减少一部分 D、NaOH和KOH都具有碱性,其原因是在水中均能解离出OH﹣14. 如图是某品牌服装标签。下列有关错误的是( ) A、羊毛属于合成纤维 B、该服装面料不耐高温 C、羊毛和涤纶可用燃烧法区别 D、加入涤纶可增强面料的耐磨性
A、羊毛属于合成纤维 B、该服装面料不耐高温 C、羊毛和涤纶可用燃烧法区别 D、加入涤纶可增强面料的耐磨性二、填空题
-
15. 下列事实说明空气中含有哪些成分?(1)、纸张在空气中燃烧;(2)、空气是制造硝酸和氮肥的原料;(3)、酥脆饼干在空气中放置逐渐变软;(4)、长期暴露在空气中的澄清石灰水表面上有一层白色物质。16. 如图为元素周期表的一部分,请按要求填空:
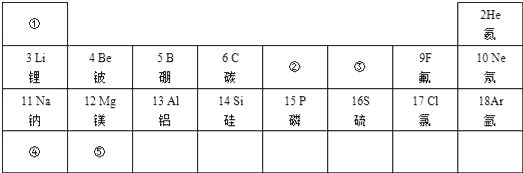 (1)、表中3至10号元素位于第二周期,11至18号元素位于第三周期,分析其规律可知,每一周期元素原子的相同.(2)、表中9号和17号元素最外层电子数相同,都易(选填“得到”或“失去”)电子.则钠元素和氟元素组成的化合物的化学式为 .
(1)、表中3至10号元素位于第二周期,11至18号元素位于第三周期,分析其规律可知,每一周期元素原子的相同.(2)、表中9号和17号元素最外层电子数相同,都易(选填“得到”或“失去”)电子.则钠元素和氟元素组成的化合物的化学式为 .
(3)、请在表中①~⑤五种元素里选出恰当的元素组成一种常见的盐,该盐在农业生产上可用作复合肥料,则该盐的化学式为 .17. 当前日本与我国有钓鱼岛之争、菲律宾与我国有南沙之争、越南与我国有西沙之争。这些国家想侵占我国的领土、领海,抢夺这些地区丰富的渔业和油气等资源。试分析:(1)、石油属于(填“纯净物”或“混合物”),是经过数百万年复杂的物理和化学变化才能形成的一种(填“可再生”或“不可再生”)能源。(2)、天然气的主要成分是 , 实验室点燃气体之前都要先。(3)、怀化地区有丰富的水力资源,相对用煤作燃料的火力发电,水力发电的优势是(任写一种)18. 2016年8月我国自主研制的“海斗”号无人潜水器成功进行万米级下潜应用,这标志着我国研制无人潜水器能力已进入先进国家行列之中。 (1)、无人潜水器耐压壳使用的是钛铝合金材料。下列不属于钛铝合金性质的是(填字母)。
(1)、无人潜水器耐压壳使用的是钛铝合金材料。下列不属于钛铝合金性质的是(填字母)。a.密度大 b.硬度大 c.抗腐蚀
(2)、无人潜水器通信传输系统中使用了光导纤维。光导纤维的主要成分是二氧化硅,则光导纤维属于(填字母)。a.金属材料 b.无机非金属材料
c.合成材料 d.复合材料
(3)、无人潜水器中的管道通常用聚乙烯为原料生产。此类合成材料还有聚丙烯、涤纶、聚酯、氯纶、聚氯乙烯等。①聚乙烯属于(填字母)
a.塑料 b.合成橡胶 c.合成纤维
②聚乙烯的化学式为(C2H4)n , 则聚乙烯中碳元素的质量分数为。
③生活中区分聚乙烯、聚氯乙烯的常用方法是。
19. A、B、C、D、E 是初中化学常见的物质,其中A、B为黑色固体,B的相对分子质量为80,D为无色气体,E为一种可溶性碳酸盐,B、C、D都由两种元素组成,且C中不含B、D中的元素。它们之间的转化关系如图所示(“---”表示相连的两种物质之间可以发生反应,“→”表示一种物质可以转化为另一种物质:反应条件、部分反应物和生成物已略去)。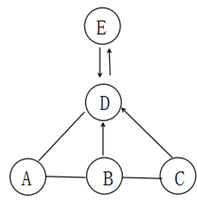 (1)、C的化学式为。(2)、B转化为D时所需要的一种化合物是。(3)、A与B反应的化学方程式为:。
(1)、C的化学式为。(2)、B转化为D时所需要的一种化合物是。(3)、A与B反应的化学方程式为:。该反应属于。(填基本反应类型)
20.(1)、现有H、O、Na、Mg、P五种元素,请根据下列要求写出由所给元素组成的物质(写化学式):① 属于非金属氧化物的是(写出两种即可)。
② 属于碱的是。
(2)、A、B、C三种物质的溶解度曲线如图所示,请回答: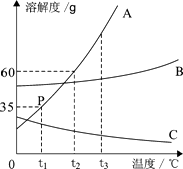
① 对于物质A而言,点P的含义为。
② t3℃ 时,A、B、C三种饱和溶液中,溶质质量分数由大到小的排列为。
③ 若A、B、C三种物质中有一种是易溶于水的气体,则其溶解度曲线是。
④ 烧杯中有t2℃时20%的A溶液50g,要将该溶液变为同温度下的饱和溶液,至少需向烧杯中加入A物质克。
21. 能源“非石油化”是战略目标,发展以CH4 、CO2等为原料的“C1化学”成为当今化工生产的必然趋势。通常天然气中含有H2S等有毒气体,下图为天然气合成氨的工艺流程。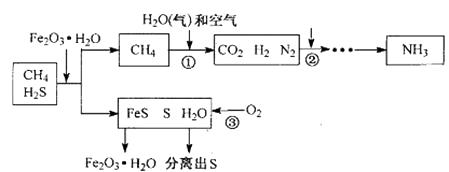 (1)、甲烷----氧气燃料电池是将能转化为能的装置。CH4在空气中燃烧时,将干冷的小烧杯罩在火焰上方,可观察到烧杯内壁有。(2)、CH4可合成多种无机物和有机物。研究CH4和CO2反应生成CO和H2 , 重大意义在于;我国科研人员首先发现CH4可直接分解获得C6H6和H2 , 化学方程式为。(3)、①中CH4与H2O(气)反应生成CO2、H2 , 化学方程式是。②中一般加人K2CO3溶液吸收CO2 , 此反应表示为K2CO3+CO2+H2O = 2 , N2 与 H2按照分子数1:反应生成NH3。
(1)、甲烷----氧气燃料电池是将能转化为能的装置。CH4在空气中燃烧时,将干冷的小烧杯罩在火焰上方,可观察到烧杯内壁有。(2)、CH4可合成多种无机物和有机物。研究CH4和CO2反应生成CO和H2 , 重大意义在于;我国科研人员首先发现CH4可直接分解获得C6H6和H2 , 化学方程式为。(3)、①中CH4与H2O(气)反应生成CO2、H2 , 化学方程式是。②中一般加人K2CO3溶液吸收CO2 , 此反应表示为K2CO3+CO2+H2O = 2 , N2 与 H2按照分子数1:反应生成NH3。三、简答题
-
22. 2009年世界气候大会在丹麦首都哥本哈根举行,旨在控制大气中“温室效应”气体的排放量。“低碳”正成为人们的共识。
(1)、近几十年来大气中二氧化碳含量不断上升的主要原因是。(2)、自然界消耗二氧化碳气体的主要途径是①植物的光合作用。植物在光的作用下吸收二氧化碳和水生成葡萄糖(C6H12O6)和氧气;②海水的吸收。请用化学反应方程式表示出上述两条消耗CO2的途径①、 ②。(3)、科学家正在研究将空气中过多的CO2和H2在催化剂和加热条件下转化成甲烷和水,这个反应的化学方程式是。(4)、请举一例你在日常生活中符合“节能减排”的做法。四、综合题
-
23. 材料是人类赖以生存和发展的重要物质,目前使用量最多的金属材料仍然是钢铁。
(一)铁材料的有关知识
(1)、人类使用金属先后经历了“青铜”、“铁器”时代,直到近代才开始大量使用铝材料.这也反映出Cu、Fe、Al三种金属的活动性由强到弱的顺序是 .
(2)、钢铁材料通常分为生铁和钢.如图1是我国1997年发行的纪念钢产量首次突破1亿吨的邮票.邮票通常密封保存在聚乙烯塑料袋中①以上叙述中不涉及到的材料是(选填序号).
A.合金 B.无机非金属材料 C.有机合成材料
②以赤铁矿为原料冶炼铁反应的化学方程式 。
③钢铁露置在空气中易生锈,请提出防止其生锈的一种措施 .
(3)、(二)铁及其化合物的实验将Fe粉溶于稀H2SO4 , 此反应属于(填基本反应类型).用点燃法检验生成的H2前必须 .
(4)、向上述反应后的溶液中滴加NaOH溶液,生成白色Fe(OH)2沉淀,随后沉淀变为灰绿色.①生成Fe(OH)2反应的化学方程式 .
②白色沉淀变为灰绿色的原因之一是部分Fe(OH)2接触空气生成Fe(OH)3 , 反应的化学方程式 . 生成的Fe(OH)3分解为Fe2O3 .
③过滤、洗涤、低温干燥得到灰绿色固体,其组成为2FeSO4•2Fe(OH)2•Fe2O3〔相对分子质量为644].能证明固体已洗净的方法为 .
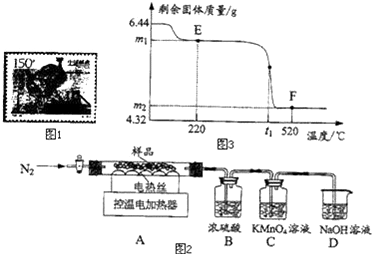
(5)、(三)灰绿色固体的热分解实验兴趣小组称取此固体6.44g,在科研人员的指导下用如图2装置进行热分解实验.
[查阅资料]
①Fe(OH)2在150℃~200℃时完全分解为FeO;
②FeSO4在450℃~500℃时完全分解为Fe2O3 , 2FeSO4 Fe2O3+SO2↑+SO3↑.
加热前后及过程中均通入N2 , 加热前通N2的目的是 .
(6)、控制温度在不同的范围对A中样品加热,测得剩余固体质量随温度的变化如图3所示.B装置中浓硫酸只能吸收SO3和H2O,当加热到t1℃时,装置C中的现象为 .①图3中E点对应的m1= .
②图3中F点对应物质中Fe2O3的质量为 g.
③科研人员将F点所得剩余固体隔绝空气,在密闭容器中加热到1400℃,得到纯净的磁性Fe3O4 . 已知加热过程中发生两个反应,且反应前后固体总质量不变.请写出其中一个反应的化学方程式 .
五、计算题
-
24. 某校化学兴趣小组同学用一瓶含有杂质氯化钠的硫酸钠固体样品,进行如图所示的实验.
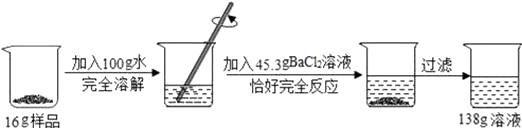
请根据以上信息计算:
(1)、该实验中生成沉淀的质量。(2)、反应后所的溶液中溶质的质量分数(精确到0.1%)。
-
-