相关试卷
- 湖南省长沙市2016-2017学年九年级化学一模考试试卷
- 广东省东莞市中堂星晨学校2016-2017学年九年级化学一模考试试卷
- 广东省茂名高州市东岸中学2016-2017学年九年级化学一模考试试卷
- 广东省广州市花都区2016-2017学年九年级化学一模考试试卷
- 广西柳州市柳南区2014-2015学年九年级化学一模考试试卷
- 北京市西城区2017—2018学年九年级上学期化学期末考试试卷
- 北京市海淀区2017-2018学年九年级上学期化学期末考试试卷
- 北京市朝阳区2017-2018学年九年级上学期化学期末考试试卷
- 北京市丰台2017-2018学年九年级上学期化学期末考试试卷
- 广东省深圳市罗湖区2017-2018学年九年级上学期化学期末考试试卷
-
1、某化学兴趣小组测定某石灰石样品中碳酸钙的质量分数(假定:石灰石样品中除碳酸钙外,其余物质不与稀盐酸反应也不溶于水;且为了反应充分,尽可能地将石灰石粉碎)。称取6g样品,把称取好的样品放入烧杯中(烧杯质量为10g)。将50g稀盐酸分5次加入,每次加入稀盐酸后,用玻璃棒不断搅拌,充分反应后对烧杯(包括溶液和残余固体)进行了称量,记录如表:
第1次
第2次
第3次
第4次
第5次
加入稀盐酸的总质量(g)
10
20
30
40
50
烧杯和药品总质量(g)
25.56
35.12
44.68
54.24
64.24
(1)、求样品完全反应后生成二氧化碳的质量为________g。(2)、求石灰石样品中碳酸钙的质量分数。(请写出计算过程,计算结果精确到0.1%) -
2、
酸在工业、医药等领域的应用特别广泛,其中最常见的就是盐酸和硫酸。化学兴趣小组对酸的相关性质展开了如下项目式探究。
【任务一】初识盐酸和硫酸
(1)某瓶酸溶液由于标签被腐蚀,无法看清药品名称和化学式。根据残留的部分信息可以判断出该酸为________(写出化学式)。

【任务二】构建酸的共性
某化学兴趣小组的同学通过探究,利用左手构建了酸的性质知识网络。但在探究中对于出现的一些现象无法解释,请同学们帮忙解释:

(2)小组同学用紫茄子皮自制了酸碱指示剂,滴加至盐酸和硫酸中都能变成桃红色的本质原因是溶液中都含有________(写出离子符号)。
(3)分别将大小相同的金属铝、锌、铁放入等体积、等浓度的稀硫酸溶液中,观察实验现象,结果发现铝表面开始时并没有气泡产生。铝和稀硫酸反应为什么刚开始没有气泡产生?________(用文字解释)。
【任务三】再探盐酸和硫酸
盐酸和硫酸中酸根离子不同,与其他物质反应,也可体现酸的个性。
【进行实验]小组同学对这个问题进行了如下探究:用滴定管分别向Ba(OH)2溶液中匀速滴加稀盐酸和稀硫酸,观察现象并绘制出电导率随时间变化的曲线。

【查阅资料】I.电导率传感器可通过电脑软件记录溶液中导电情况;
II.电导率与溶液中离子浓度有关。
【分析与结论】
(4)向Ba(OH)2溶液中匀速滴加稀盐酸,并绘制出曲线1,其中曲线1M点处烧杯中溶液的溶质是________(写化学式)。曲线2表示的是向Ba(OH)2溶液中匀速滴加稀硫酸时溶液的电导率变化情况,该反应的微观本质如图所示,图中①处的化学式为________。

(5)根据该实验,下列所得结论正确的是______(填字母)。
A. 溶液中离子浓度越大,电导率越大 B. N点和Q点是中和反应的终点 C. 随着酸的不断增加,电导率最终趋近于稳定值 D. 往Ba(OH)2溶液中滴加盐酸和硫酸溶液时现象相同 -
3、实验室用下列装置制取气体,请据图回答下列问题。
 (1)、仪器①的名称是________。(2)、装置B和C相比,B的优点是________(写一点即可)。(3)、若用E收集氧气,则气体应从________(填“a”或“b”)口进入。(4)、实验室制取氧气时,下列因素中,不需要考虑的是______(填字母)。A、药品容易获得,能生成氧气 B、所选药品的颜色 C、操作简便易行、安全可靠、节能环保 D、反应条件易于控制,反应速率适中
(1)、仪器①的名称是________。(2)、装置B和C相比,B的优点是________(写一点即可)。(3)、若用E收集氧气,则气体应从________(填“a”或“b”)口进入。(4)、实验室制取氧气时,下列因素中,不需要考虑的是______(填字母)。A、药品容易获得,能生成氧气 B、所选药品的颜色 C、操作简便易行、安全可靠、节能环保 D、反应条件易于控制,反应速率适中 -
4、2024国际氢能产业发展论坛上多项全国领先氢能产业成果在京发布,如图流程是一种制备氢气的新工艺。
 (1)、该流程中可以循环利用的物质是________。(2)、流程中涉及的氧化物有________(填化学式)。(3)、利用该流程制备氢气的优点是________(写一点即可)
(1)、该流程中可以循环利用的物质是________。(2)、流程中涉及的氧化物有________(填化学式)。(3)、利用该流程制备氢气的优点是________(写一点即可) -
5、如图是a、b、c三种物质的溶解度曲线,回答下列问题。
 (1)、P点的含义是________。(2)、t1℃时,将30g a物质加入50g 水中,充分溶解后,所得溶液的质量为________g。(3)、a中含有少量b时,最好采用________(填“降温结晶”或“蒸发结晶”)的方法提纯a。
(1)、P点的含义是________。(2)、t1℃时,将30g a物质加入50g 水中,充分溶解后,所得溶液的质量为________g。(3)、a中含有少量b时,最好采用________(填“降温结晶”或“蒸发结晶”)的方法提纯a。 -
6、写出下列反应的化学方程式。(1)、一氧化碳在空气中燃烧:________。(2)、二氧化碳能使澄清石灰水变浑浊:________。
-
7、认真阅读下列材料,回答有关问题。
稀土元素是指元素周期表中第IIIB族的钪(Sc)、钇(Y)以及镧系元素。这些元素的氧化物都不溶于水,外形像泥土,而且很稀少,因而人们喜欢称它们为“稀土元素”。稀土元素的化学性质较为活泼,若与其他元素结合,便可组成种类繁多、功能多样、用途广泛的新型材料,且性能会有较大提高,被称作当代的“工业味精”。稀土元素中镧(La)、铈(Ce)、镨(Pr)、钕(Nd)在元素周期表中的位置如图所示。
57 La
镧
138.9
58 Ce
铈
140.1
59 Pr
镨
140.9
60 Nd
钕
144.2
(1)、从材料中可得出,稀土元素的化学性质________。(2)、镧元素的质子数是________。(3)、从元素分类角度看,钕元素属于________(填“金属”或“非金属”)元素。 -
8、化学与生活息息相关。下列做法正确的是A、患病时,应合理使用药物 B、大量摄入油脂有益于身体健康 C、用小苏打作焙制糕点的发酵粉 D、食用加碘食盐可预防贫血
-
9、分析推理是化学学习中常用的思维方法。下列推理正确的是A、化学变化一定伴随着能量的变化,则有能量变化的过程一定是化学变化 B、中和反应生成盐和水,则生成盐和水的反应一定是中和反应 C、单质是由同种元素组成的,则由同种元素组成的物质一定是单质 D、某物质在氧气中燃烧生成二氧化碳和水,则该物质一定含有碳元素和氢元素
-
10、分类法是学习化学的一种方法。下列各组物质的分类正确的是A、单质:C60、钢铁 B、氧化物:CuO、干冰 C、混合物:空气、冰水混合物 D、盐:KMnO4、NaCl
-
11、硫酸和盐酸是工农业生产中重要的两种酸。下列有关说法正确的是A、打开浓盐酸的瓶盖,可观察到有白烟产生 B、稀硫酸和稀盐酸都能使无色酚酞溶液变红 C、浓硫酸具有腐蚀性,因此在实验室中常用作气体的干燥剂 D、稀盐酸和稀硫酸都可用来除铁锈
-
12、溶液在我们的日常生活、工农业生产、科学研究以及医疗等领域都有广泛的用途。下列关于溶液的说法正确的是A、均一,稳定的液体一定是溶液 B、溶液中的溶质只能是一种 C、饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液 D、实验室里常将固体药品配制成溶液进行化学反应,以提高反应速率
-
13、火的使用推动了人类文明的进步。下列有关燃烧与灭火的说法或措施正确的是A、可燃物接触氧气即可燃烧 B、炒菜油锅着火,可用锅盖盖灭 C、图书、档案失火用干粉灭火器灭火 D、用嘴吹灭蜡烛是因为降低了蜡烛的着火点
-
14、“人类只有一个地球!”我国明确提出减排目标:二氧化碳排放力争于2030年前达到峰值,努力争取2060年前实现碳中和。下列关于碳单质及碳的氧化物的说法正确的是A、金刚石、石墨和C60都是由碳原子构成的物质 B、CO和CO2的组成元素相同,所以它们的化学性质也相同 C、CO2会导致温室效应,所以CO2是一种空气污染物 D、CO与某些氧化物反应可用于冶金工业
-
15、微粒观是化学的基本观念。下列说法错误的是A、物质是由分子、原子、离子等微观粒子构成的 B、物质发生化学变化时,原子的种类和数目不变 C、保持水的化学性质的最小微粒是氢原子和氧原子 D、同种元素的原子,核内质子数和核外电子数一定相等
-
16、今年我国将发射“神舟二十号”和“神舟二十一号”两艘载人飞船,NiFe2O4可作为催化剂将航天员呼出的CO2转化为O2。已知NiFe2O4中Fe为+3价,则Ni的化合价为A、+2 B、+1 C、+3 D、+5
-
17、2024年3月22日~28日是第三十七届“中国水周”,其活动主题为“精打细算用好水资源,从严从细管好水资源”。下列有关水的认识正确的是A、地球上的淡水资源取之不尽,用之不竭 B、合理使用农药、化肥可以减少水体污染 C、水体有自净能力,生活污水可以任意排放 D、自来水厂通常对天然水进行沉降、过滤、吸附、蒸馏等操作生产自来水
-
18、空气是人类生产活动的重要资源。空气中的各种成分广泛应用于工农业生产、医疗和科研等领域。下列说法错误的是A、焊接金属时常用氧气作保护气 B、氮气可用于制造低温环境 C、氧气常常用于医疗急救 D、稀有气体可用于航标灯
-
19、化学是一门以实验为基础的学科,规范的实验操作是实验成功的保障。下列实验操作正确的是A、点燃酒精灯
 B、检查装置气密性
B、检查装置气密性 C、过滤
C、过滤 D、测溶液的pH
D、测溶液的pH
-
20、火力发电厂常使用石灰石进行燃煤烟气脱硫,产生的硫酸钙可用于建筑材料。
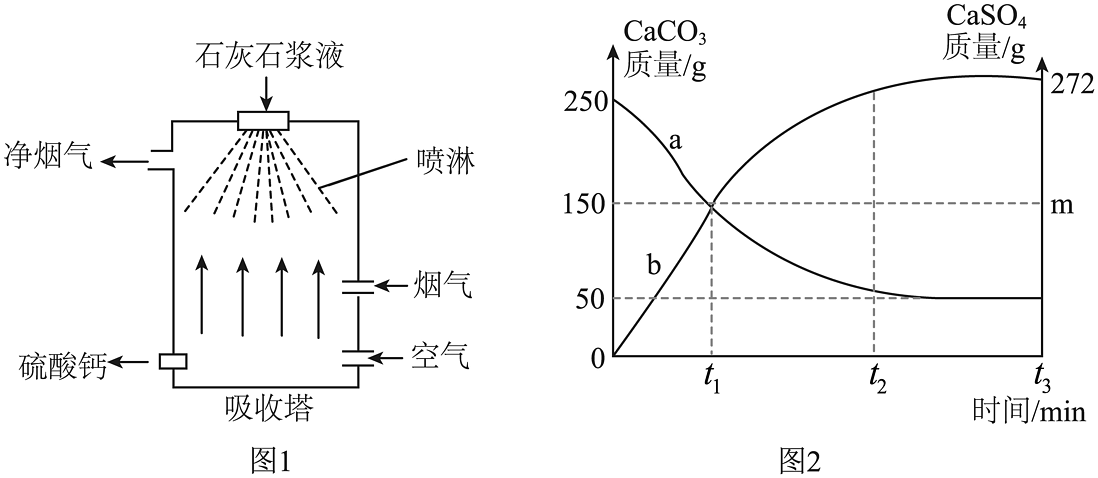 (1)、二氧化硫在空气中发生反应后的生成物溶于雨水,会形成酸雨,酸雨用试纸测得的范围应为 , 会导致土壤的酸性增强,不利于。(2)、“吸收塔”反应: , 部分物质质量变化如图2。
(1)、二氧化硫在空气中发生反应后的生成物溶于雨水,会形成酸雨,酸雨用试纸测得的范围应为 , 会导致土壤的酸性增强,不利于。(2)、“吸收塔”反应: , 部分物质质量变化如图2。i.代表的质量变化曲线是(填“a”或“b”)。
ii.时吸收塔吸收了二氧化硫的质量是多少?(写出计算过程)。
iii.时,硫酸钙的质量为。