-
1、烧制瓷器的黏土中含有以下元素,其中地壳中含量最多的元素是A、铁 B、硅 C、铝 D、氧
-
2、以下是珠海市化学实验操作考试“加热2mL水至沸腾”的部分操作,其中正确的是A、倾倒水
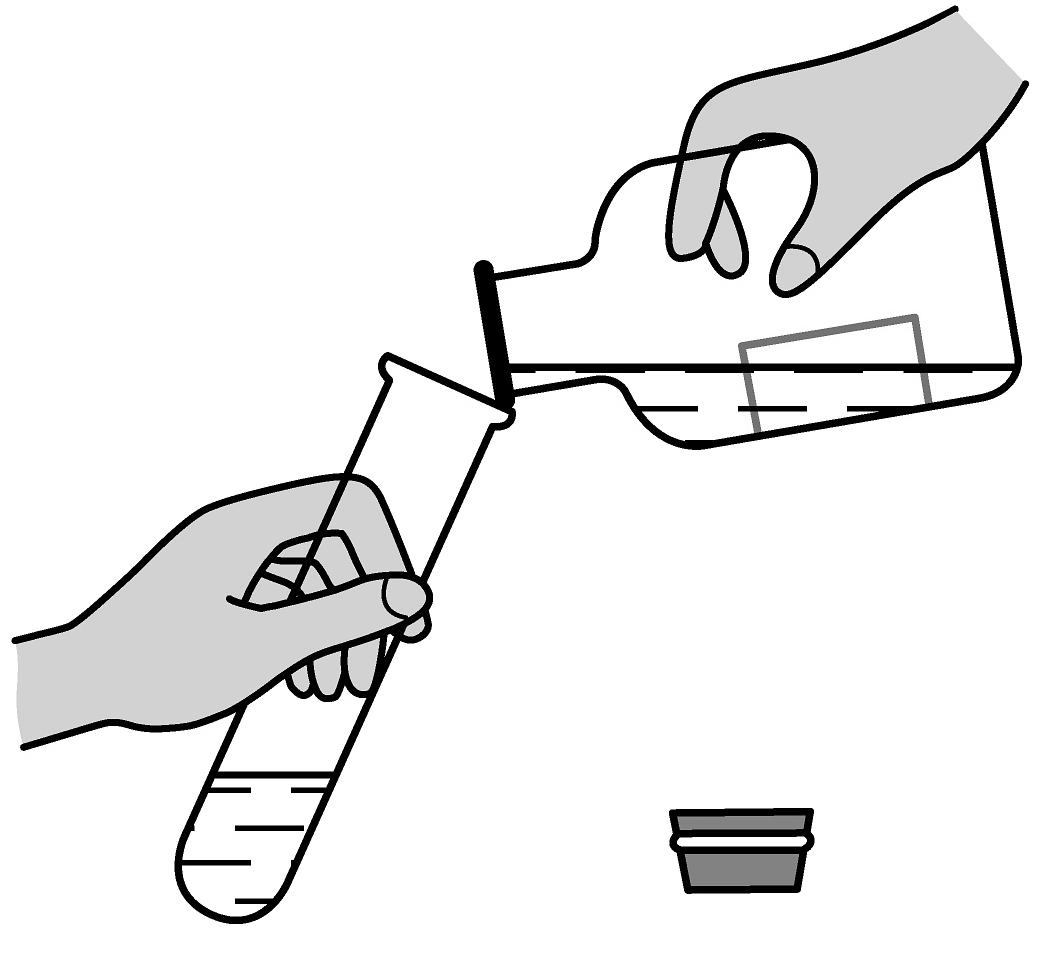 B、点燃酒精灯
B、点燃酒精灯 C、夹持试管
C、夹持试管 D、加热水
D、加热水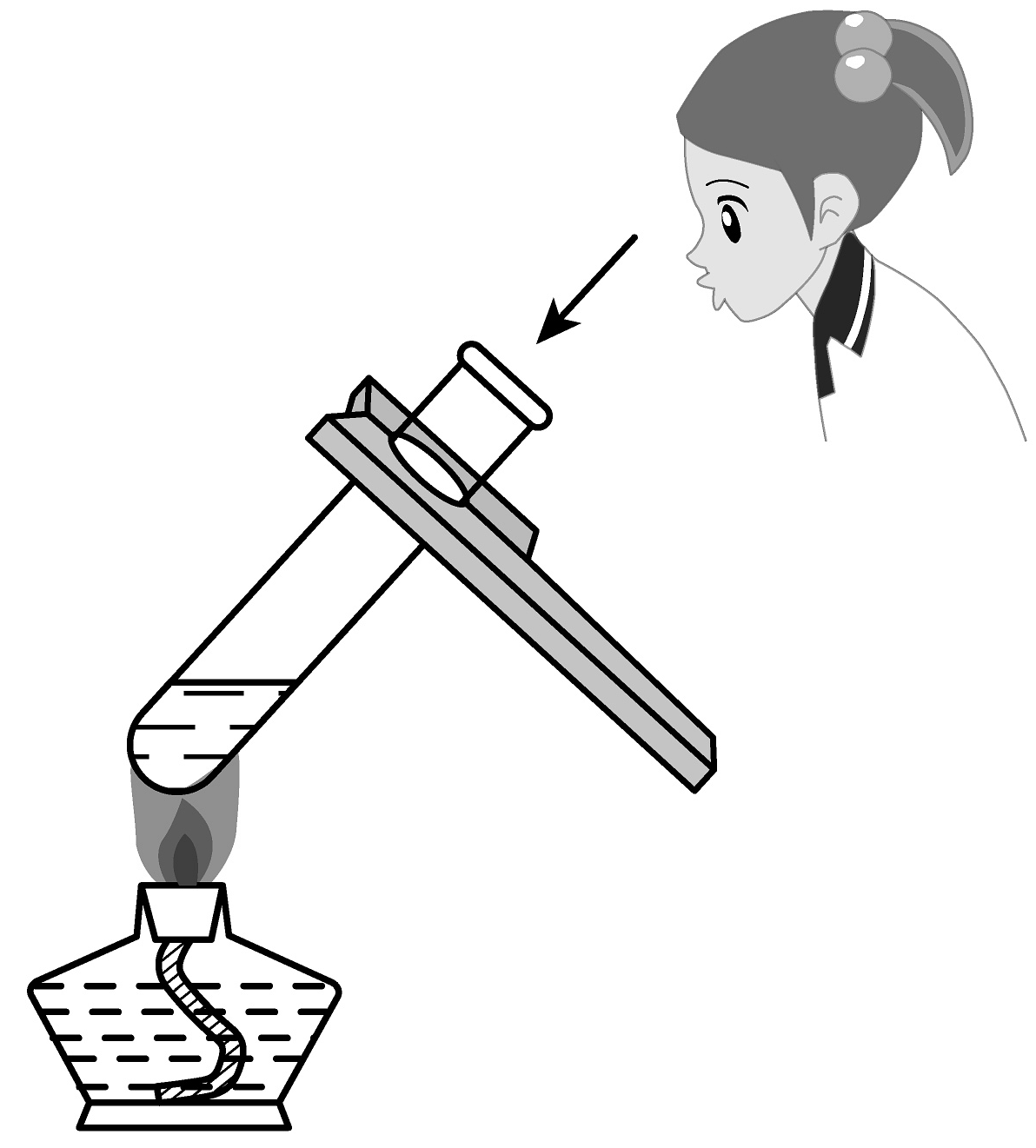
-
3、研发多种用于石油化工生产的催化剂,为我国炼油催化剂制造技术奠定基础的科学家是A、拉瓦锡 B、闵恩泽 C、张青莲 D、道尔顿
-
4、下列做法不符合保护空气和水资源的是A、工业废水直接排放 B、垃圾分类回收 C、积极植树造林 D、加强空气质量检测
-
5、下列有关空气中的成分、水的用途说法错误的是A、氧气能支持燃烧,可用于气割、气焊 B、氮气化学性质不活泼,可用于食品防腐 C、稀有气体通电时能发光,可用作电光源 D、水不能燃烧,可用于任何火灾的灭火
-
6、下列物质中,属于氧化物的是A、氧气 B、水 C、氮气 D、稀有气体
-
7、下列图标中,表示“国家节水标志”的是A、
 B、
B、 C、
C、 D、
D、
-
8、下列属于化学变化的是A、钢铁生锈 B、冰雪融化 C、铁水凝固 D、陶瓷破碎
-
9、小李同学在化工颜料店发现一种“银粉”,他猜想该“银粉”可能是银粉、铝粉或锌粉中的一种。为了确定“银粉”的成分,小李将一小包密封良好的“银粉”带回实验室,进行了如下实验和分析。
实验1:取少量“银粉”于试管中,滴加足量稀硫酸,观察到“银粉”全部溶解(杂质忽略不计),且有气体产生。
实验2:为进一步确定“银粉”是何种金属,小李同学另取1.8g“银粉”放入质量为100g的烧杯中,再把100g稀硫酸平均分成四份依次加入,每次充分反应后进行称量,实验数据如下表:
所加稀硫酸的次数
第一次
第二次
第三次
第四次
烧杯及所盛物质的总质量/g
126.7
151.6
176.6
201.6
据此计算分析:
(1)、“银粉”一定不是(填写化学式);生成氢气总的质量为。(2)、“银粉”是何种金属?同学们经过小组讨论,得出一种方案:若“银粉”为铝,可依据生成氢气的总质量计算出消耗铝的质量,从而作出判断。请你写出这种方案的计算过程。 -
10、
金属材料在人类文明的发展中起着重要作用,我们应该从多角度了解。
Ⅰ.冶炼钢铁
(1)钢铁是生活中最常见的金属材料,高炉炼铁中常用赤铁矿作为原料,写出高炉中赤铁矿炼铁的主要反应的化学方程式________。
Ⅱ.金属的活动性
某兴趣小组探究金属镍(Ni)与铁、铜的金属活动性顺序。
【查阅资料】
镍与稀盐酸或稀硫酸反应,生成+2价的无色溶液,并放出氢气。
【作出猜想】
(2)小组同学结合所学知识作出如下猜想:
猜想一:Ni>Fe>Cu
猜想二:Fe>Ni>Cu
猜想三: ________
【探究实验】
(3)完成下列表格:
实验内容
实验现象
实验结论
实验①:将砂纸打磨过的镍片加入到盛有适量稀硫酸的试管中
________
猜想三错误
实验②:将砂纸打磨过的铁片加入到盛有硫酸镍溶液的试管中
铁片表面有固体析出
猜想________正确
(4)实验②中发生反应的化学方程式为________。
【实验结论】
由上述实验及分析可得Fe、Ni、Cu的金属活动性顺序。
Ⅲ.钢铁的锈蚀与防护
取四枚相同的洁净无锈铁钉分别放入四支试管中,进行如图实验,现象如下表。
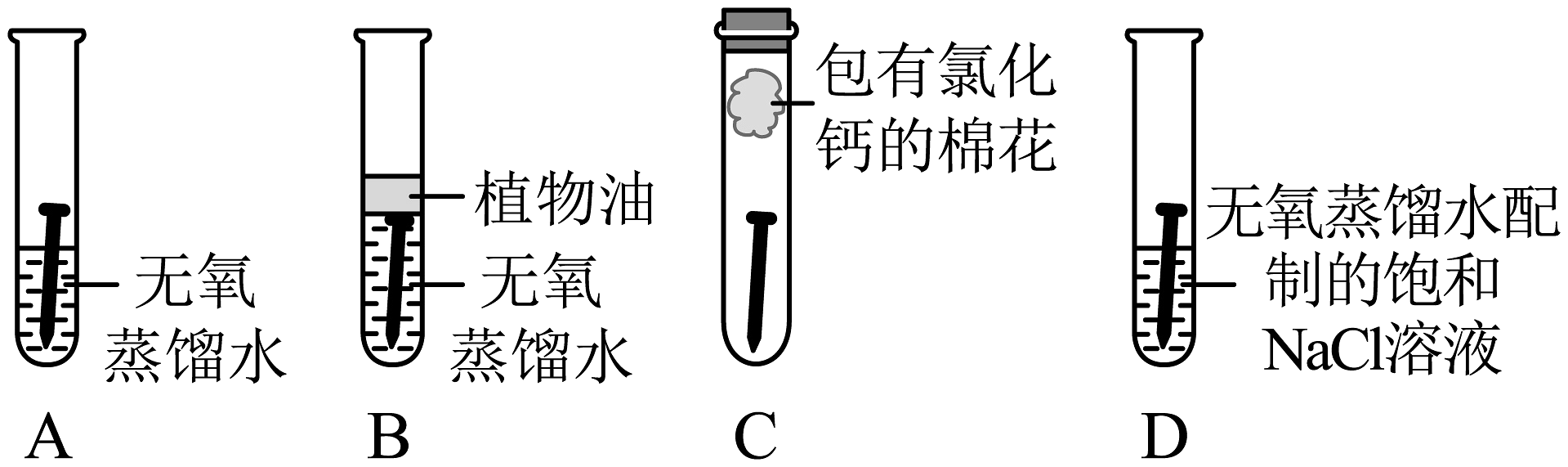
试管
A
B
C
D
一周后现象
铁钉表面有一层铁锈
铁钉表面无明显变化
铁钉表面无明显变化
铁钉表面有较厚铁锈
(5)对比A、B、C试管中实验现象,说明铁锈蚀主要是铁与________发生化学反应。
(6)对比A、D试管中实验现象,说明铁锈蚀还与________有关。
(7)下列金属制品的防护措施不合理的是______(填字母序号)。
A. 车船的表面喷涂油漆 B. 使用后的菜刀用布擦干 C. 铁制品表面镀一层铬 D. 用钢丝球擦除铝制品表面的污渍 -
11、锌精矿(主要成分为ZnS,含少量铜元素)是生产金属锌的主要原料,用锌精矿石火法炼锌的工艺流程如图所示。
 (1)、锌精矿进入沸腾炉前需粉碎处理,这样做的目的是。(2)、沸腾炉的炉气中含有形成酸雨的气体是(填写化学式),产生该气体的原因是(用化学方程式表示)。(3)、还原炉中焦炭与氧化锌反应的化学方程式为。(4)、锌蒸气“冷定”后方能“毁罐”取出,从化学变化角度解释其原因是。(5)、相同质量的下列化合物中,含锌质量最多的是______(填字母序号)。A、ZnO B、ZnS C、ZnCO3 D、Zn(OH)2
(1)、锌精矿进入沸腾炉前需粉碎处理,这样做的目的是。(2)、沸腾炉的炉气中含有形成酸雨的气体是(填写化学式),产生该气体的原因是(用化学方程式表示)。(3)、还原炉中焦炭与氧化锌反应的化学方程式为。(4)、锌蒸气“冷定”后方能“毁罐”取出,从化学变化角度解释其原因是。(5)、相同质量的下列化合物中,含锌质量最多的是______(填字母序号)。A、ZnO B、ZnS C、ZnCO3 D、Zn(OH)2 -
12、在宏观、微观和符号之间建立联系是学习化学的重要思维方式。
 (1)、钛(Ti)被广泛应用于航天工业。钛在元素周期表中信息和原子结构示意图如图1所示,由此可知n=。金属钛常用钛铁矿(主要成分为钛酸亚铁,FeTiO3)为原料冶炼,FeTiO3中Ti元素的化合价为。(2)、图2表示水、二氧化碳和氧气的循环图。从微观角度看,图中三种物质都是由(填“分子”、“原子”或“离子”)构成的。写出由H2O转化为O2的化学方程式。(3)、铝和铁元素种类不同的本质区别是。铝制品比铁制品耐腐蚀的原因是(用化学方程式表示)。(4)、金属铁和硝酸银溶液反应的微观示意图如图3所示。该反应中实际参加反应的微观粒子是(填写微观粒子符号)。
(1)、钛(Ti)被广泛应用于航天工业。钛在元素周期表中信息和原子结构示意图如图1所示,由此可知n=。金属钛常用钛铁矿(主要成分为钛酸亚铁,FeTiO3)为原料冶炼,FeTiO3中Ti元素的化合价为。(2)、图2表示水、二氧化碳和氧气的循环图。从微观角度看,图中三种物质都是由(填“分子”、“原子”或“离子”)构成的。写出由H2O转化为O2的化学方程式。(3)、铝和铁元素种类不同的本质区别是。铝制品比铁制品耐腐蚀的原因是(用化学方程式表示)。(4)、金属铁和硝酸银溶液反应的微观示意图如图3所示。该反应中实际参加反应的微观粒子是(填写微观粒子符号)。 -
13、化学是一门以实验为基础的科学,请回答下列问题。
 (1)、图1中仪器①的名称是。(2)、实验室用大理石和稀盐酸制取CO2 , 发生反应的化学方程式为 , 若选用图1中C作发生装置,使反应停止的操作为。(3)、将净化除杂后的二氧化碳进行如图2性质实验。
(1)、图1中仪器①的名称是。(2)、实验室用大理石和稀盐酸制取CO2 , 发生反应的化学方程式为 , 若选用图1中C作发生装置,使反应停止的操作为。(3)、将净化除杂后的二氧化碳进行如图2性质实验。能使装置E中紫色石蕊变红的物质是(填写化学式),装置F中观察到的现象是 , 装置G中燃着的蜡烛由下而上依次熄灭,由此得出二氧化碳具有的化学性质是。
(4)、实验室常用加热氢氧化钠和醋酸钠的固体混合物制取甲烷气体,应选用图1中的发生装置是(填字母编号)。已知相同条件下甲烷的密度比空气小且难溶于水,若D装置盛满水,收集甲烷气体时,气体的进气口应为(填“a”或“b”)。 -
14、中华文化博大精深,蕴含了丰富的化学知识。按要求回答下列问题。(1)、古籍《辍耕录》记载:“杭人削松木为小片,其薄为纸,镕硫磺涂木片顶端分许,名曰发烛……。”,从燃烧条件分析,松木属于。为防止引发林火,可用泥土覆盖在燃着的松木和灰烬上,从灭火原理分析,主要利用。(2)、《天工开物》中记载:“凡石灰经火焚炼为用,……以水调黏合”。文中石灰指氧化钙,“水调黏合”过程中反应的化学方程式是 , 反应的基本类型是。(3)、《吕氏春秋》中记载:“金(铜单质)柔锡(锡单质)柔,合两柔则刚”。这句话说明合金比其组成金属所具有的特性是。(4)、《太清丹经》中记载了制取“彩色金”的方法:将雄黄(As4S4)和锡粉(Sn)混合,“密固,入风炉吹之、令锅同火色,寒之、开,黄色似金”。
①“彩色金”中(填“含”或“不含”)金(Au)元素。
②制取“彩色金”发生如下反应: , X的化学式。
-
15、室温时,利用压强传感器研究质量相同的一块铝片和一块锌片分别与等浓度、等质量的稀盐酸反应的实验如图甲,压强传感器测得装置内压强随时间的变化关系如图乙。下列说法正确的是
 A、曲线①的压强上升比曲线②高,说明①产生H2总量更多 B、曲线②是铝片与稀盐酸反应的压强变化曲线 C、曲线①中B为最高点,BC段没有发生化学变化 D、反应结束后铝片一定有剩余
A、曲线①的压强上升比曲线②高,说明①产生H2总量更多 B、曲线②是铝片与稀盐酸反应的压强变化曲线 C、曲线①中B为最高点,BC段没有发生化学变化 D、反应结束后铝片一定有剩余 -
16、下列图像所表示的对应关系正确的是
 A、向生铁中加入足量的稀硫酸 B、质量相等的两份KClO3 , 一份单独加热(a),另一份和MnO2混合加热(b) C、向等质量的锌粉和镁粉中分别加入相同浓度的稀盐酸 D、表示某物质的着火点t℃时,该物质燃烧最旺的点是N点
A、向生铁中加入足量的稀硫酸 B、质量相等的两份KClO3 , 一份单独加热(a),另一份和MnO2混合加热(b) C、向等质量的锌粉和镁粉中分别加入相同浓度的稀盐酸 D、表示某物质的着火点t℃时,该物质燃烧最旺的点是N点 -
17、下列关于鉴别、检验、分离、除杂的方法,正确的是
选项
类别
物质
方法
A
鉴别
真假黄金
加稀盐酸,观察现象
B
检验
甲烷
点燃,观察火焰颜色
C
分离
铜粉和铁粉的混合物
加入足量硫酸铜溶液,过滤
D
除杂
除去氧化铜中的木炭
在空气中充分灼烧
A、A B、B C、C D、D -
18、向硝酸铝、硝酸铜和硝酸银的混合溶液中加入一定量的铁粉,反应停止后过滤,得到滤液和滤渣。则下列说法中正确的是A、滤渣中一定含有银和铜 B、当滤液为蓝色时,滤渣中一定有Ag,一定没有Fe C、向滤渣中加入稀盐酸,如果无气泡产生,则滤渣的组成情况有两种 D、向滤渣中加入稀盐酸,如果有气泡产生,说明滤液中只含有硝酸亚铁
-
19、“固态氢能”是利用固体与氢气作用储存氢气的技术。“绿电”与“绿氢”转化示意图如图。下列说法正确的是
 A、绿氢是利用风能、太阳能、煤等可再生能源发电,再电解水生产氢气 B、氢气被合金材料吸收贮存为氢化物,氢气分子的化学性质发生了改变 C、电解水制氢是将电能转化为化学能,产生“
A、绿氢是利用风能、太阳能、煤等可再生能源发电,再电解水生产氢气 B、氢气被合金材料吸收贮存为氢化物,氢气分子的化学性质发生了改变 C、电解水制氢是将电能转化为化学能,产生“ ”的一端连接电源的正极
D、使用绿色电力可以减少二氧化碳等温室气体排放
”的一端连接电源的正极
D、使用绿色电力可以减少二氧化碳等温室气体排放
-
20、用Pt-Rh合金催化氧化NH3制NO,其反应的微观模型如图1,含氮生成物产率随反应温度的变化曲线如图2所示。关于该转化过程的说法错误的是
 A、400℃时,生成的产物只有N2、NO B、该反应前后原子种类发生改变 C、Pt-Rh合金催化氧化NH3制NO,适宜的温度为800℃ D、化学反应前后Pt-Rh合金的质量和化学性质均未改变
A、400℃时,生成的产物只有N2、NO B、该反应前后原子种类发生改变 C、Pt-Rh合金催化氧化NH3制NO,适宜的温度为800℃ D、化学反应前后Pt-Rh合金的质量和化学性质均未改变