相关试卷
-
1、嘉陵江是南充的母亲河,河水中含有泥沙、悬浮物和细菌等。用河水生产严饮用水的工艺流程如图所示。分析流程,回答下列问题:
 (1)、该过程得到的饮用水为(选填“纯净物”或“混合物”)。(2)、过滤操作可除去样中的(选填“可溶性”或“不溶性”)杂质。过滤后发现滤液仍然浑浊,可能的原因是(写出一条即可)。(3)、以下生活实例中,应用过滤原理的是______(填字母序号)。A、用渔网捕鱼 B、用热水沏茶 C、用纱布分离豆浆和豆渣 D、用漏勺捞起煮熟的饺子(4)、南充市自来水水质偏硬,生活中可以降低水的硬度的方法是。
(1)、该过程得到的饮用水为(选填“纯净物”或“混合物”)。(2)、过滤操作可除去样中的(选填“可溶性”或“不溶性”)杂质。过滤后发现滤液仍然浑浊,可能的原因是(写出一条即可)。(3)、以下生活实例中,应用过滤原理的是______(填字母序号)。A、用渔网捕鱼 B、用热水沏茶 C、用纱布分离豆浆和豆渣 D、用漏勺捞起煮熟的饺子(4)、南充市自来水水质偏硬,生活中可以降低水的硬度的方法是。 -
2、用化学用语回答下列问题。(1)、标出二氧化碳中碳元素的化合价。(2)、写出硫酸铜中的阴离子。(3)、地壳中含量最多的前两种非金属元素形成化合物的化学式。
-
3、下列图象能正确反映其对应关系的是

A B C D
A、电解水 B、加热高锰酸钾制氧气 C、向一定量H2O2溶液中加入MnO2固体 D、在密闭容器中用红磷测定空气中氧气的含量 -
4、下列实验设计能达到预期目的或效果的是
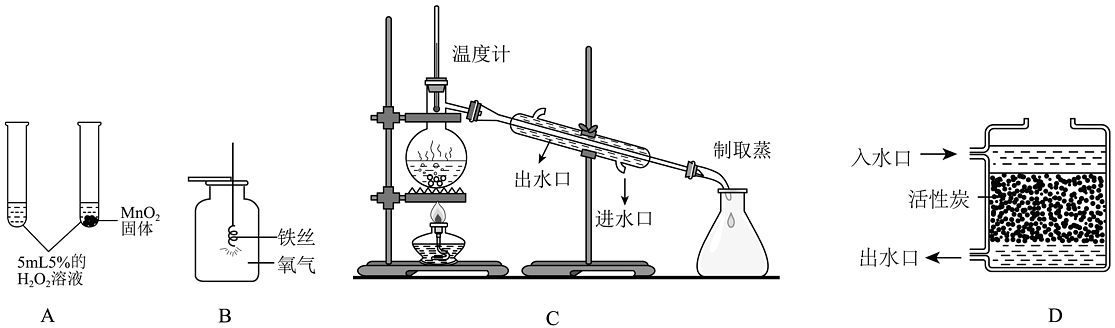 A、证明MnO2是H2O2分解的催化剂 B、铁丝在氧气中燃烧 C、制取蒸馏水 D、获得最好的净水效果
A、证明MnO2是H2O2分解的催化剂 B、铁丝在氧气中燃烧 C、制取蒸馏水 D、获得最好的净水效果 -
5、牛津大学证实地塞米松(化学式为C22H29FO5)可降低新冠肺炎重症死亡率。下列相关叙述正确的是A、地塞米松由碳、氢、氧三种元素组成 B、地塞米松由碳、氢、氧三种原子构成 C、地塞米松中碳、氢、氧三种元素的质量比为22:29:5 D、地塞米松中碳元素的质量分数最高
-
6、如图是教材中水分子分解示意图,其中
 表示氧原子,
表示氧原子, 表示氢原子,根据示意图能得到的正确结论是
表示氢原子,根据示意图能得到的正确结论是 A、该反应属于化合反应 B、水分解过程中氢、氧原子的个数不会改变 C、水分子是该化学变化中的最小微粒 D、水分子由氢分子和氧原子构成
A、该反应属于化合反应 B、水分解过程中氢、氧原子的个数不会改变 C、水分子是该化学变化中的最小微粒 D、水分子由氢分子和氧原子构成 -
7、下列有关事实中,解释错误的是
选项
事实
解释
A
墙内开花墙外香
分子在不断运动
B
氧气助燃,氢气可燃
不同种分子的性质不同
C
水蒸发后体积变大
水分子体积变大
D
夏天湿衣服晾干快
温度越高,分子运动越快
A、A B、B C、C D、D -
8、下列对九年级常见化学演示实验的现象描述正确的是A、红磷在空气中燃烧产生大量白雾 B、硫在空气中燃烧,发出明亮的蓝紫色火焰 C、铁丝在氧气中剧烈燃烧,火星四射,生成四氧化三铁 D、用火柴去点蜡烛刚熄灭时产生的白烟,蜡烛能重新燃烧
-
9、化学是一门以实验为基础的自然科学,下列实验操作正确的是A、吸取液体试剂
 B、读取液体体积
B、读取液体体积 C、过滤
C、过滤 D、气体发生装置
D、气体发生装置
-
10、南充有2200多年的建城史,历史悠久,非物质文化遗产众多。下列非物质文化遗产中,主要利用化学变化进行制作的是A、营山根雕 B、南充大木偶 C、仪陇剪纸 D、阆中保宁醋
-
11、如图是实验室制取气体的一些装置,据图回答有关问题。
 (1)、写出序号②仪器名称:。(2)、实验室用高锰酸钾制取氧气时,可选用发生装置(填字母,下同),但是该装置需要在试管口塞一团棉花,其目的是:。该反应的化学反应方程式为。(3)、某同学想收集一瓶干燥的氧气,在收集装置D-G中选择装置。(4)、能用装置G收集氧气是因为氧气。若用装置G准确测量生成氧气的体积,收集的时机选择(填a或b)。
(1)、写出序号②仪器名称:。(2)、实验室用高锰酸钾制取氧气时,可选用发生装置(填字母,下同),但是该装置需要在试管口塞一团棉花,其目的是:。该反应的化学反应方程式为。(3)、某同学想收集一瓶干燥的氧气,在收集装置D-G中选择装置。(4)、能用装置G收集氧气是因为氧气。若用装置G准确测量生成氧气的体积,收集的时机选择(填a或b)。a.气泡连续均匀冒出时
b.刚冒出气泡时
(5)、若将装置H装满水收集氧气,气体应从端通入。(6)、如图是加热一定质量高锰酸钾时固体质量随时间的变化关系图,请认真观察图像,判断固体质量处于c点时含有种固体。
-
12、材料一:《酒谱》(宋):尝乘舟于黄河中流,以匏瓠接河源水七八升,经宿色如绛。
材料二:东晋《抱朴子》记载,“凡草木烧之即烬,而丹砂(硫化汞HgS)烧之成水银(汞Hg),积变又还成丹砂,其去凡草木亦远矣”。
材料三:《物理小识》(明):寻常定水,矾、赤豆、杏仁……皆可。
材料四:通常情况下,硫单质是黄色晶体,难溶于水,微溶于乙醇,易溶于二硫化碳。硫及其化合物在生产生活中有广泛用途,燃烧硫磺常用于熏蒸消毒和漂白。
(1)、“材料一”中“河源水”是(填“纯净物”或“混合物”)“经宿色如绛”指静置一晚,使水中不溶性杂质沉于水底部。(2)、“材料二”中丹砂受热分解的化学反应方程式为:HgSHg+S;从微观角度分析,该反应过程中,发生改变的微观粒子是(填“分子”或“原子”,下同);反应中出现的最小粒子是。(3)、“材料三”中“矾”[明矾,化学式:KAl(SO4)2•12H2O]溶于水后产生铝离子(写符号)与水反应产生胶状物,对杂质有吸附作用,使杂质沉降来达到净水的目的。(4)、“材料四”中属于硫的物理性质的是(写一条)。写出硫在空气中燃烧的化学反应方程式: , 该反应的基本反应类型是反应。(5)、“生命吸管”是当今户外净水实用装置(如图),下列说法错误的是。
a.超滤膜能滤去全部杂质
b.抗菌颗粒可以去除细菌
c.活性炭能吸附异味
d.通过“生命吸管”可以得到纯水
-
13、通过学习,我们应该会从微观的角度看世界,课堂上,老师给出了A、B、C、D四种粒子的结构示意图(如图所示),同学们畅所欲言,纷纷发表自己看法。下面列举了四名同学的观点。

甲同学:C的质子数与核电荷数都是16
乙同学:A、D属于同种元素
丙同学:A、B、C、D表示的都是原子
丁同学:B与C的化学性质相似
(1)、上述粒子在化学反应中,容易失去电子的是(填字母)。(2)、其中同学的观点不正确。(3)、D微观粒子的符号为。A、B、C三种原子的元素可组成的化合物的化学式是。(4)、化学史给人类以智慧。下列关于科学家的贡献说法错误的是______。A、道尔顿——提出原子学说 B、阿伏加德罗——编制元素周期表 C、拉瓦锡——测定空气中氧气的含量 D、张青莲——精确测定了某些原子的相对原子质量 -
14、如图是某化学反应的微观过程示意图,下列说法错误的是
 A、该反应属于化合反应 B、从宏观角度看,丙属于混合物 C、化学反应前后原子的种类、数目均不变 D、参加反应的甲、乙两物质的微粒个数比为3:2
A、该反应属于化合反应 B、从宏观角度看,丙属于混合物 C、化学反应前后原子的种类、数目均不变 D、参加反应的甲、乙两物质的微粒个数比为3:2 -
15、下列实验现象描述不正确的是A、铁在氧气中燃烧火星四射 B、磷在空气中燃烧产生大量的白雾 C、硫在氧气中燃烧产生蓝紫色火焰 D、碳在氧气中燃烧发出白光
-
16、下面方框内是某泡腾片包装袋上的部分文字。根据该文字判断,下列有关说法不正确的是
维生素C泡腾片说明书
每片含维生素C(C6H8O6)1000mg
配料:柠檬酸(H3Ci)、碳酸氢钠、氯化钠、淀粉[(C6H10O5)n]、山梨糖醇(C6H14O6)
用法:用冷水或温水溶解后服用。
贮藏:请保持将筒盖紧闭,避免受热或受潮。
A、从类别上看:泡腾片属于混合物 B、从性质上看:泡腾片容易溶解在水中 C、从组成上看:维生素C(C6H8O6)中碳元素质量分数最大 D、从结构上看:维生素C(C6H8O6)的分子是由碳、氢、氧三种原子构成的 -
17、正确书写化学方程式是学习化学的基本技能,下列化学方程式书写正确的是A、铁丝在氧气中燃烧:4Fe+3O22Fe2O3 B、铁与硫酸铜反应:Fe+CuSO4=FeSO4+2Cu C、镁条在氧气中燃烧:2Mg+O2MgO2 D、通电分解水:2H2O2H2↑+O2↑
-
18、镓在元素周期表中的信息及其原子结构示意图如下图,下列说法正确的是
 A、镓属于非金属元素 B、图中n=18 C、镓的中子数是31 D、镓的相对原子质量为69.72g
A、镓属于非金属元素 B、图中n=18 C、镓的中子数是31 D、镓的相对原子质量为69.72g -
19、下列标签中化学式书写不正确的是A、
 B、
B、 C、
C、 D、
D、
-
20、锌锰电池中用到石墨、氯化铵、二氧化锰、锌壳等,这几种物质中属于氧化物的是
 A、石墨 B、二氧化锰 C、氯化铵 D、锌
A、石墨 B、二氧化锰 C、氯化铵 D、锌