相关试卷
- 广东省清远市2016-2017学年九年级化学一模考试试卷
- 广西钦州港经济开发区2015-2016学年九年级上学期化学期末考试试卷
- 广西北海市合浦县教育局教研室2013-2014学年九年级上学期化学期末考试试卷
- 广西北海市合浦县2012-2013学年九年级上学期化学期末考试试卷
- 广东省肇庆市鼎湖中学2017-2018学年九年级上学期化学期中考试试卷
- 2016年广西钦州市中考化学试题
- 2015年广西钦州市中考化学试卷
- 广西桂林市灌阳县2015-2016学年九年级上学期化学期中考试试卷
- 广西桂林市灌阳县2015-2016学年九年级上学期化学期中考试试卷
- 广西钦州地区2016-2017学年九年级化学中考模拟考试试卷
-
1、化学是一门以实验为基础的科学。结合所学知识回答下列问题:
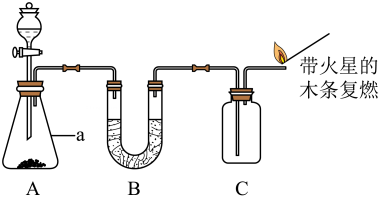 (1)、仪器a的名称。(2)、由图判断,装置A中反应的化学方程式为;下列与实验有关的图标,在该实验中无需标注的是(填序号)。
(1)、仪器a的名称。(2)、由图判断,装置A中反应的化学方程式为;下列与实验有关的图标,在该实验中无需标注的是(填序号)。 (3)、可用装置C收集气体,说明该气体可能具有的物理性质是。
(3)、可用装置C收集气体,说明该气体可能具有的物理性质是。 -
2、锌是维持生命活动的重要元素之一,目前工业上主要采用“酸法”冶炼锌,一兴趣小组以菱锌矿(主要成分是ZnCO3 , 还含有少量的SiO2和为原料制备锌,其工艺流程图如下。回答下列问题:
 (1)、菱锌矿属于(填“纯净物”或“混合物”)。(2)、由此流程可推知SiO2的性质有( )(填字母序号)。A、难溶于水 B、化学性质很活泼 C、不能与稀硫酸反应(3)、“酸浸”时,金属氧化物发生反应的化学方程式为。(4)、操作1、操作Ⅱ为过滤,滤后果汁滤纸(灰色部分代表滤纸),滤液分布的情况最接近图中的( )。A、
(1)、菱锌矿属于(填“纯净物”或“混合物”)。(2)、由此流程可推知SiO2的性质有( )(填字母序号)。A、难溶于水 B、化学性质很活泼 C、不能与稀硫酸反应(3)、“酸浸”时,金属氧化物发生反应的化学方程式为。(4)、操作1、操作Ⅱ为过滤,滤后果汁滤纸(灰色部分代表滤纸),滤液分布的情况最接近图中的( )。A、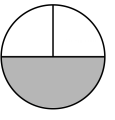 B、
B、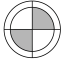 C、
C、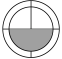 (5)、已知Fe2+和Zn2+开始沉淀和沉淀完全时的pH如下列表格所示,“除杂”过程中加入ZnO的目的是 , 通过调节溶液的pH使Fe+沉淀完全而Zn2+不沉淀,则pH的范围是。
(5)、已知Fe2+和Zn2+开始沉淀和沉淀完全时的pH如下列表格所示,“除杂”过程中加入ZnO的目的是 , 通过调节溶液的pH使Fe+沉淀完全而Zn2+不沉淀,则pH的范围是。
-
3、氯化钠和硝酸钾在不同温度时的溶解度如表,回答下列问题:
温度/℃
10
20
30
40
50
溶解度/g
氧化钠
35.8
36.0
36.3
36.6
37.0
硝酸钾
20.9
31.6
45.8
63.9
85.5
(1)、30℃时,氯化钠的溶解度为g。(2)、由表中数据分析,二者具有相同溶解度的温度范围是20℃<t<℃。(3)、40℃时,将20.0g氯化钠固体加入50.0g水中,充分溶解后所得溶液为溶液(填“饱和”或“不饱和”)。(4)、20℃时,向100.0g质量分数为12.0%的硝酸钾溶液中加入100g硝酸钾固体,充分溶解后,所得溶液中溶质的质量分数为。 -
4、“科学技术是第一生产力”,在材料制造领域,我国自主研发,持续创新。(1)、芯片是人工智能的核心,硅和氮化镓(GaN)都是制造芯片的重要材料。工业制硅过程中涉及反应: , X的水溶液可溶解蓝色的氢氧化铜固体,则盐酸溶解氢氧化铜的化学方程式为 , 镓(Ga)属于元素(填“金属”或“非金属”)。(2)、镁铝合金是目前最轻的合金,可将镁粉和铝粉的混合物粉末加入一定量的硫酸铜溶液中,充分反应后过滤,得到6.0g滤渣A,再向滤液A中滴加稀硫酸至不再有气体产生,收集到mg气体,过滤后得到2.4g滤渣B,则m的取值范围是。
-
5、中国传统文化对人类文明贡献巨大,许多诗句和典籍中都蕴含化学知识。(1)、西晋《蜀都赋》中有“火井沈荧于幽谷,高焰飞煽于天倪。”该句描写了天然气的燃烧,天然气的主要成分完全燃烧的化学方程式为。(2)、《三国志·关羽传》中记载,赤壁之战中,黄盖以“蒙冲斗舰数十艘,实以薪草,……时风盛猛,悉延烧岸上营落”。从燃烧条件分析,“时风盛猛”使火势更旺的原因是。(3)、《梦溪笔谈》中描述了一种液体化石燃料:“颇似淳漆,燃之如麻,但烟甚浓,所沾幄幕皆黑”。该化石燃料是石油,下列说法错误的是( )。A、石油是不可再生能源 B、石油炼制可得到汽油、煤油和柴油 C、化石燃料包括煤、石油、天然气、氢气等 D、化石燃料只能通过燃烧加以利用
-
6、水是生命之源,是“永远值得探究的物质”。(1)、认识水的蒸发:下图是烧杯内的水在不同温度下蒸发时发生变化的微观示意图。请将50℃时相同空间内对应的微观示意图补充完整(图中“○”表示氢原子,“●”表示氧原子)。
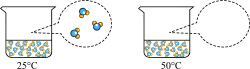 (2)、初探水的组成:电解水装置中,同电源负极相连的电极上产生的气体是H2 , 由此得出关于水的组成的结论是。(3)、了解水的净化:小明同学观察到学校、车站等公共场所安装有直饮式水机,他了解到直饮水机是将自来水净化为可直接饮用的水,其净水原理如图所示,图中步骤①的目的是。
(2)、初探水的组成:电解水装置中,同电源负极相连的电极上产生的气体是H2 , 由此得出关于水的组成的结论是。(3)、了解水的净化:小明同学观察到学校、车站等公共场所安装有直饮式水机,他了解到直饮水机是将自来水净化为可直接饮用的水,其净水原理如图所示,图中步骤①的目的是。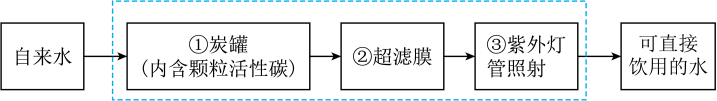 (4)、爱护水资源:保护水资源是全社会的共同责任,下列做法错误的是( )。A、为减少水体污染,要合理使用农药、化肥 B、厨房废水经必要处理后可直接排入九曲河 C、开展生产工作,提高用水效率 D、在河流、湖泊中建设植草滤沟有助于净化水质
(4)、爱护水资源:保护水资源是全社会的共同责任,下列做法错误的是( )。A、为减少水体污染,要合理使用农药、化肥 B、厨房废水经必要处理后可直接排入九曲河 C、开展生产工作,提高用水效率 D、在河流、湖泊中建设植草滤沟有助于净化水质 -
7、草树知春不久归,百般红紫斗芳菲。资阳市市花三角梅备受市民喜爱。(1)、飘落的花瓣、花粉属于哪一类污染物。(2)、嫩叶中富含铁、锌和膳食纤维,锌是人体所需的(选填“微量”或“常量”)元素。(3)、花瓣中含有单宁酸其燃烧时最多可以生成种氧化物。(4)、种植盆栽时,在展叶期为促进其叶片生长茂盛、叶色浓绿,应施加肥(填“钾”或“氮”或“磷”)。
-
8、向碳酸钙与盐酸反应后的废液中逐滴加入碳酸钠溶液,利用pH传感器记录实验数据,所得曲线如图所示,已知氯化钙溶液呈中性,下列说法错误的是( )
 A、废液中含有和HCl B、a→b→c的过程中,先有气泡产生,后有沉淀生成 C、c点对应的溶液中所含溶质种类最少 D、b→c→d的过程中,随着溶液的加入,溶液中氯化钠的质量不断增加
A、废液中含有和HCl B、a→b→c的过程中,先有气泡产生,后有沉淀生成 C、c点对应的溶液中所含溶质种类最少 D、b→c→d的过程中,随着溶液的加入,溶液中氯化钠的质量不断增加 -
9、科技活动中,化学实验小组做了如下实验,以下分析与结论正确的是( )
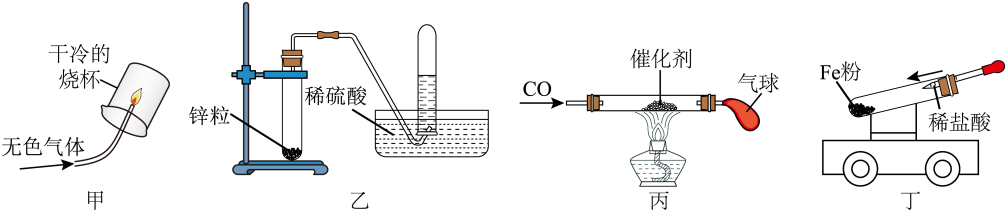 A、甲:甲烷燃烧产生蓝色火焰,烧杯内壁有水珠,说明无色气体为氢气 B、乙:可用于制取和收集氧气,反应后,因有氧气生成而使发生装置中溶液的质量减小 C、丙:反应后玻璃管内固体减少的质量小于气体生成物中氧元素的质量 D、丁:试管内压强增大,小车在光滑地面上向左移动,试管内的反应为
A、甲:甲烷燃烧产生蓝色火焰,烧杯内壁有水珠,说明无色气体为氢气 B、乙:可用于制取和收集氧气,反应后,因有氧气生成而使发生装置中溶液的质量减小 C、丙:反应后玻璃管内固体减少的质量小于气体生成物中氧元素的质量 D、丁:试管内压强增大,小车在光滑地面上向左移动,试管内的反应为 -
10、“碳达峰·碳中和”是我国社会发展重大战略之一。科学研究发现,在催化剂作用下,以太阳能为热源能实现CO2的吸收转化,其反应原理如图。下列说法错误的是( )
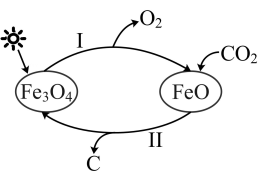 A、有2种金属氧化物参与该循环 B、过程Ⅰ为分解反应,过程Ⅱ为置换反应 C、该循环总反应为 D、该循环中Fe、O、C三种元素的化合价发生了改变
A、有2种金属氧化物参与该循环 B、过程Ⅰ为分解反应,过程Ⅱ为置换反应 C、该循环总反应为 D、该循环中Fe、O、C三种元素的化合价发生了改变 -
11、化学用语是学好化学的基石,下列表述正确的是( )A、硫酸铵中的阳离子:NH4+ B、S2-的结构示意图:
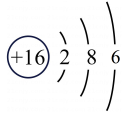 C、3H2O:表示一个水分子中含有3个原子
D、铁粉在氧气中燃烧:
C、3H2O:表示一个水分子中含有3个原子
D、铁粉在氧气中燃烧:
-
12、距今约8万-6万年的资阳濛溪河遗址入选2024年中国十大考古新发现,遗址中出土了多粒炭化的花椒种子,将人类对“麻”的追求提早几万年。花椒皮麻味来(C6H8NO)中C、H、O、N四种元素的质量比为( )A、16:25:1:1 B、36:4:8:7 C、12:1:16:14 D、192:25:14:16
-
13、下列仪器不能在酒精灯上直接加热的是( )A、蒸发皿 B、试管 C、燃烧匙 D、烧瓶
-
14、中华文化博大精深,许多传统习俗蕴含着丰富的科学知识。下列传统节日活动中,主要涉及化学变化的是( )A、春节————燃放烟花 B、重阳节———登高望远 C、端午节————赛舟包粽 D、中秋节————赏月分饼
-
15、我国碳酸盐岩储层具有丰富的油气资源,油气的高效开采是目前研究重点。(1)、Ⅰ.石油开采。石油属于(填“可再生”或“不可再生”)能源。
酸化压裂驱油。向碳酸盐岩储层中注入稀盐酸,能把岩层中的矿物质溶解或冲刷掉,形成有利的石油流动通道。稀盐酸与石灰石反应的化学方程式为。稀硫酸能否代替稀盐酸用于酸化压裂驱油?
【查阅资料】稀硫酸与反应生成微溶的 , 会逐渐在表面沉积成膜,阻碍反应持续进行。膜的形成主要受搅拌速率和硫酸浓度的影响。
【进行实验】实验装置气密性良好如图-1,电磁搅拌器可以提供不同的搅拌速率。
 (2)、实验1:锥形瓶中分别放5g粗颗粒石灰石,加入10mL3%的稀硫酸,在不同搅拌速率下进行实验。锥形瓶内压强变化如图-2。分析可知,搅拌速率越快,膜越(填“难”或“易”)形成。
(2)、实验1:锥形瓶中分别放5g粗颗粒石灰石,加入10mL3%的稀硫酸,在不同搅拌速率下进行实验。锥形瓶内压强变化如图-2。分析可知,搅拌速率越快,膜越(填“难”或“易”)形成。实验2:锥形瓶中分别放5g粗颗粒石灰石,加入10mL不同浓度的稀硫酸,在高转速下进行实验。锥形瓶内压强变化如图-3,分析可知 , 由以上实验可知,使稀硫酸与粗颗粒石灰石持续反应的措施为①;②。
(3)、【得出结论】在实际操作中,选择使用稀盐酸还是稀硫酸驱油,取决于具体的应用场景。CO2增压驱油。向储油层注入CO2可以(填“增大”或“减小”)油层中的压强,使石油顺利流出。
①利用CO2驱油,不仅提高了石油产量,还实现了CO2的地质封存,有助于实现我国“双碳”目标中的。
②处于碳酸盐岩层缝隙中的石油流通不畅,需要向岩层中注入稀盐酸,提高石油流通能力,其原因为。
Ⅱ.石油输送。输油钢铁管道易被腐蚀,有利于减缓管道腐蚀的具体做法有。
-
16、不同场所对水质有不同要求,兴趣小组对鱼缸的用水要求进行研究。(1)、水质酸碱度
金鱼适宜在pH范围为7.1~8.4的水中生存,说明金鱼适宜生存的水质环境呈性。
(2)、溶解氧鱼类生长最适宜的溶氧量一般在每升水5~8mg,鱼缸可以通过水泵循环抽水增加溶氧量,也可以直接通入一定量的氧气。
①分子筛制氧。通过分子筛吸附法使空气中的和分离而获得 , 分子筛中发生的变化是(填“物理变化”或“化学变化”)。
②实验室制氧。实验室用分解制 , 反应的化学方程式为。用下列装置进行实验,装置A中用于固定试管的仪器名称是 , 收集较纯净的 , 可选择的收集装置是(填字母)。
 (3)、水质净化
(3)、水质净化①鱼缸净化装置中的火山石外表粗糙、孔隙多,具有吸附能力,作用类似于。
②鱼缸消毒可以用溶质质量分数为5%的溶液,0.003%的溶液能为金鱼治病。用溶质质量分数为5%的溶液配制500g溶质质量分数为0.003%的溶液,需加入水的体积为mL。(水的密度以计)
-
17、纳米广泛应用于信息产业。某科研小组以四氯化锡固体()为原料制备纳米 , 其主要流程如下:
 (1)、“酸溶”过程,能加快酸溶速率的措施是。(2)、“调pH”过程,尿素溶液与盐酸反应生成和 , 控制溶液pH在5.0左右得到沉淀。此时溶液中的阳离子有、(填离子符号)。(3)、“系列操作”中,从溶液分离出沉淀的操作是。(4)、在500℃条件下生成和 , 反应的化学方程式为。(5)、若制备30.2g的 , 理论上需要获得多少克?(写出计算过程)
(1)、“酸溶”过程,能加快酸溶速率的措施是。(2)、“调pH”过程,尿素溶液与盐酸反应生成和 , 控制溶液pH在5.0左右得到沉淀。此时溶液中的阳离子有、(填离子符号)。(3)、“系列操作”中,从溶液分离出沉淀的操作是。(4)、在500℃条件下生成和 , 反应的化学方程式为。(5)、若制备30.2g的 , 理论上需要获得多少克?(写出计算过程) -
18、化学实验常用到火柴。某小组同学发现火柴头不同朝向时燃烧现象有差异,进行探究。(1)、火柴头含有、等物质,火柴盒侧面涂有发火剂。划火柴过程中(填“吸收”或“放出”)热量,促使分解产生 , 并使火柴头燃烧。上述过程中产生的化学方程式为。(2)、取三根相同火柴,标出检测点位置如图-1。将火柴头按不同朝向固定,同时引燃,并测定检测点温度变化。由图-2可知,火柴燃烧更旺的火柴头朝向为。火柴头朝上,检测点温度几乎没有变化的主要原因是。
 (3)、做铁丝在氧气中燃烧实验,铁丝末端系上火柴梗的目的是。待火柴梗即将燃尽时伸入集气瓶为最佳时机,结合图像分析,你得到的启发是。
(3)、做铁丝在氧气中燃烧实验,铁丝末端系上火柴梗的目的是。待火柴梗即将燃尽时伸入集气瓶为最佳时机,结合图像分析,你得到的启发是。 -
19、徐州是国家历史文化名城,交通便利,农产品丰富。(1)、文物诉说历史。汉代“陶俑”所用材料为(填“无机非金属材料”或“合成材料”)。(2)、高铁通达九州。高铁列车的受电弓滑板用石墨制作,这一应用体现石墨的物理性质是(任写一条)。(3)、甘薯享誉全球。甘薯中的糖类物质来自植物的作用,检验其中的淀粉用。
-
20、铁与溶液接触,表面有红色固体析出,还有气泡产生。经测定溶液显酸性,且反应过程中溶液酸性先增强后略减弱。为探究酸性变化原因,用冷却后的沸水配制4%的溶液,与洁净的铁钉进行如下实验。下列分析不合理的是( )
实验1
实验2
实验3



酸性不变
酸性略减弱
酸性先增强后略减弱
A、红色固体为Cu,说明Fe的金属活动性比Cu强 B、溶液显酸性,推测铁钉表面气泡一定是氢气 C、实验2中加入植物油的作用是为了隔绝氧气 D、实验2、3对比证明,溶液酸性增强与、Fe有关