相关试卷
- 广东省清远市2016-2017学年九年级化学一模考试试卷
- 广西钦州港经济开发区2015-2016学年九年级上学期化学期末考试试卷
- 广西北海市合浦县教育局教研室2013-2014学年九年级上学期化学期末考试试卷
- 广西北海市合浦县2012-2013学年九年级上学期化学期末考试试卷
- 广东省肇庆市鼎湖中学2017-2018学年九年级上学期化学期中考试试卷
- 2016年广西钦州市中考化学试题
- 2015年广西钦州市中考化学试卷
- 广西桂林市灌阳县2015-2016学年九年级上学期化学期中考试试卷
- 广西桂林市灌阳县2015-2016学年九年级上学期化学期中考试试卷
- 广西钦州地区2016-2017学年九年级化学中考模拟考试试卷
-
1、可燃冰(CH4•nH2O)外观像冰,主要含甲烷水合物(由甲烷分子和水分子构成),还含少量二氧化碳等气体。可燃冰的形成要满足三个条件:(1)温度不能太高;(2)压力要足够大;(3)要有甲烷气源。在上述三个条件都具备的情况下,天然气可与水生成甲烷水合物,分散在海底岩层的空隙中。可燃冰具有热值高、储量丰富等优点,因而被各国视为未来石油、天然气的替代能源。甲烷还是重要的化工原料,可制备炭黑、乙炔等。
2017年我国在南海海域成功试采可燃冰,走在世界前列,对保障我国能源安全、优化能源结构具有重要意义。回答下列问题:
 (1)、当今世界能源储量最丰富的是。(2)、可燃冰属于(填“纯净物”或“混合物”),形成的适宜条件是。
(1)、当今世界能源储量最丰富的是。(2)、可燃冰属于(填“纯净物”或“混合物”),形成的适宜条件是。A.高温高压 B.低温高压 C.低温低压
(3)、可燃冰有望成为未来新能源的原因是 , 请你再说出一种新能源:。(4)、下列不属于温室气体的是___________。A、甲烷 B、二氧化硫 C、一氧化二氮 D、二氧化碳(5)、写出甲烷燃烧的反应方程式。 -
2、如图为我国古代“布灰种盐”生产海盐的部分场景,其过程为“烧草为灰,布在滩场,然后以海水渍之,俟晒结浮白,扫而复淋”。经过多次“扫而复淋”,提高卤水浓度获得“上等卤水”(氯化钠的质量分数约为15%),用于煎炼海盐。
 (1)、“1000g”上等卤水”蒸干后,可得氯化钠的质量约为g。用这些氯化钠配制生理盐水,正确的操作顺序(填序号)。A中玻璃棒的作用是。
(1)、“1000g”上等卤水”蒸干后,可得氯化钠的质量约为g。用这些氯化钠配制生理盐水,正确的操作顺序(填序号)。A中玻璃棒的作用是。 (2)、用获得的“上等卤水”煎炼海盐的过程中需要不断搅拌原因是。(3)、将“上等卤水”在100℃恒温蒸发至刚有晶体析出,所得溶液的组成为:150g 溶液中含水100g、NaCl 39.8g、MgCl2 7.65g及其他成分2.55g。将150g 此溶液降温至20℃,有g NaCl 析出(溶解度见表),此时,(填“有”或“没有”)MgCl2析出,此时的溶液是氯化钠的溶液(填“饱和”或“不饱和”)。
(2)、用获得的“上等卤水”煎炼海盐的过程中需要不断搅拌原因是。(3)、将“上等卤水”在100℃恒温蒸发至刚有晶体析出,所得溶液的组成为:150g 溶液中含水100g、NaCl 39.8g、MgCl2 7.65g及其他成分2.55g。将150g 此溶液降温至20℃,有g NaCl 析出(溶解度见表),此时,(填“有”或“没有”)MgCl2析出,此时的溶液是氯化钠的溶液(填“饱和”或“不饱和”)。温度/℃
20
60
100
溶解度/g
NaCl
36.0
37.3
39.8
MgCl2
54.8
61.3
73.0
-
3、下列实验设计与对应的实验目的表述不一致的是


A.检查装置气密性
B.探究水是铁生锈的必要条件之一


C.检验氧气
D.用NaCl溶于水验证质量守恒定律
A、A B、B C、C D、D -
4、下列实验方案不能达到实验目的的是
选项
实验目的
实验方案
A
鉴别硝酸铵和氢氧化钠两种固体
各取少量固体,分别溶于水中,测溶液的温度
B
除去FeSO4溶液中的少量 CuSO4
加入足量铁粉,充分反应后过滤
C
探究锌、铁、铜的金属活动性顺序
将铁丝、铜丝分别插入硫酸锌溶液中
D
鉴别 CO2和 CO
通入紫色石蕊溶液,观察现象
A、A B、B C、C D、D -
5、如图为甲乙两物质的溶解度曲线,下列说法正确的是
 A、甲的溶解度大于乙的溶解度 B、t1℃时,甲、乙两物质饱和溶液中溶质的质量分数均为15% C、要使接近饱和的乙溶液转化为饱和溶液,可以采用加溶质的方法 D、甲物质中有少量乙物质,可以通过蒸发结晶的方法提纯得到甲
A、甲的溶解度大于乙的溶解度 B、t1℃时,甲、乙两物质饱和溶液中溶质的质量分数均为15% C、要使接近饱和的乙溶液转化为饱和溶液,可以采用加溶质的方法 D、甲物质中有少量乙物质,可以通过蒸发结晶的方法提纯得到甲 -
6、建立模型是学习化学的重要方法,下列模型正确的是
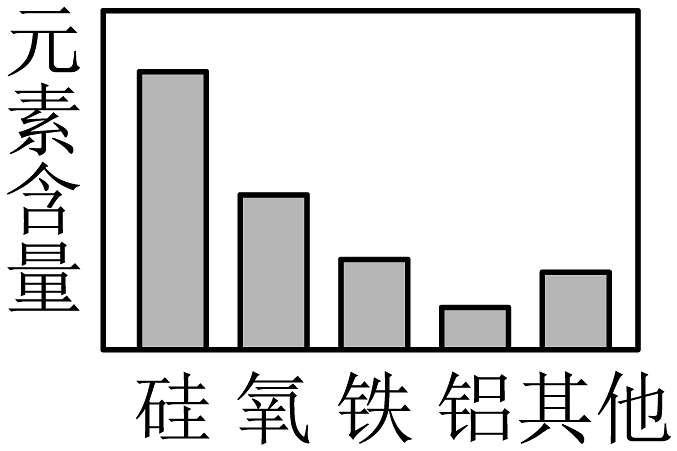

A.地壳中元素分布
B.物质分类


C.原子结构
D.空气组成
A、A B、B C、C D、D -
7、氨催化氧化是制硝酸的主要反应之一,该反应前后分子种类变化的微观示意图如图。下列说法正确的是
 A、反应前后氧元素的化合价改变 B、甲中两元素的质量比是1:3 C、生成的丙与丁的分子个数比为1:1 D、反应过程中共涉及三种氧化物
A、反应前后氧元素的化合价改变 B、甲中两元素的质量比是1:3 C、生成的丙与丁的分子个数比为1:1 D、反应过程中共涉及三种氧化物 -
8、火的使用是人类文明演化的转折点,使人类繁衍。火能给生活带来温暖,使用不当也会带来灾难,带着有关燃烧与灭火的知识,完成问题(1)、了解防灾减灾知识有利于保护人民的生命及财产安全。下列说法不正确的是A、加油站、面粉厂等场所应严禁烟火 B、燃气泄漏,点火检查 C、图书馆着火用液体二氧化碳灭火器灭火 D、森林发生火灾时,可在大火蔓延的线路上砍掉一片树林设置隔离带来灭火(2)、劳动创造幸福,下列劳动项目涉及物质的性质与应用,相关解释正确的是
选项
劳动项目
相关解释
A
进入地窖前先做灯火试验
二氧化碳有毒
B
在厨灶上方安装天然气报警器
天然气易燃且密度大于空气
C
在阳光下晾晒湿衣服
温度升高,水分子变大
D
用活性炭除去冰箱异味
活性炭具有吸附性
A、A B、B C、C D、D(3)、花鼓戏《补锅》中唱到“手拉风箱呼呼响,火炉烧得红旺旺”。下列说法最合理的是 A、风箱拉动过程中增加了可燃物 B、手拉风箱为煤的燃烧提供了充足氧气 C、火炉烧得旺是因为降低了煤的着火点 D、用水浇灭火炉中的火,主要原因是使燃着的煤与空气隔绝
A、风箱拉动过程中增加了可燃物 B、手拉风箱为煤的燃烧提供了充足氧气 C、火炉烧得旺是因为降低了煤的着火点 D、用水浇灭火炉中的火,主要原因是使燃着的煤与空气隔绝 -
9、推理是重要的科学思维方法。下列推理正确的是A、金、银在地球上以单质形式存在,说明金、银的化学性质稳定 B、溶液是均一、稳定的混合物,则均一、稳定的液体一定是溶液 C、CO有毒,所以 CO 不能作燃料 D、医用酒精中水是溶剂,则碘酒中溶剂也是水
-
10、空气是人类生产活动的重要资源。下列关于空气的说法不正确的是A、空气是工业制取氧气的廉价、易得的原料 B、人呼吸空气时呼出的气体中只含有二氧化碳 C、将氮气充入食品包装袋中可起到防腐作用 D、稀有气体原子已经达到稳定结构,所以稀有气体化学性质较稳定
-
11、下列有关数字意义描述正确的是A、3H—3个氢元素 B、C60—60个碳原子 C、:镁元素的化合价为+2价 D、:表示1个铁离子带两个单位正电荷
-
12、下列实验操作错误的是


A.加热液体
B.读取液体体积


C.滴加液体
D.蒸发结晶
A、A B、B C、C D、D -
13、某兴趣小组做铁丝燃烧实验,下列图标与本实验无关的是A、
 B、
B、 C、
C、 D、
D、
-
14、下列过程中,利用了化学反应产生的能量的是A、海水晒盐 B、干冰制冷 C、风力发电 D、烧火煮饭
-
15、2024年巴黎奥运会开幕式上,中国无人机展现硬核实力。无人机使用的锂电池放电时生成亚锰酸锂(),其中锂元素显+1价,则锰元素的化合价是A、+1 B、+2 C、+3 D、-3
-
16、我国是茶文化的发源地。唐代陆羽的《茶经》中记载“其水,用山水上,江水中,井水下。”原因是山泉水中富含硅酸(),有益于人体健康。我们常用“细、馨、苦”形容茶汤的色、香、味,这与其中所含的茶黄素()等物质有关。回答下列小题(1)、硅酸中硅元素的化合价为A、+1 B、+2 C、+3 D、+4(2)、下列有关茶黄素的说法正确的是A、由三种元素组成 B、相对分子质量为564g C、氧元素的质量分数最小 D、由29个碳原子、24个氢原子和12个氧原子构成
-
17、下列操作中,可以鉴别空气、氧气和二氧化碳三瓶气体的是A、观察气体颜色 B、观察在水中的溶解性 C、插入燃着的木条 D、倒入澄清的石灰水
-
18、空气质量与氮氧化物有密切的关系。一氧化氮和二氧化氮是两种重要的氮氧化物。一氧化氮是一种无色气体,熔点-163.6℃,沸点-151℃,密度比空气略大,微溶于水。一氧化氮不稳定,易与空气中氧气发生反应,生成红棕色有刺激性气味的二氧化氮。汽车尾气(含有一氧化碳与一氧化氮等物质)是城市空气的污染源,治理的方法之一是在汽车的排气管上装一个催化转换器,使一氧化碳与一氧化氮反应生成氮气和二氧化碳。一氧化氮广泛分布于生物体内各组织中。在心、脑血管调节等方面有着重要的生物学作用,是心脑血管的保护神。依据上文,回答下列问题:(1)、一氧化氮的物理性质是(写一点)。(2)、若要在实验室中收集一氧化氮,只能用排水法的原因是。(3)、在汽车催化转换器中发生一个重要的化学反应,该反应的文字表达式为。(4)、洁净的空气对人类非常重要。下列有利于保护大气的做法有。
a.使用新能源共享汽车 b.将工厂的烟囱造高,以减大气污染 c.植树造林,防止扬尘污染 d.加强大气监测,改善环境状况
-
19、汽车尾气是城市污染的主要来源,某实验室研制出一种汽车尾气处理装置。该反应的微观示意图如图,下列说法正确的是
 A、C框内的物质属于纯净物 B、该反应说明分子是化学变化的最小粒子 C、图中“◯◯”表示的化学式为2N D、该反应实质是原子的重新排列组合
A、C框内的物质属于纯净物 B、该反应说明分子是化学变化的最小粒子 C、图中“◯◯”表示的化学式为2N D、该反应实质是原子的重新排列组合 -
20、如图为某琥珀酸亚铁口服片的说明书。请计算:
名称:琥珀酸亚铁口服片
主要成分的化学式:
含量:每片 , 含琥珀酸亚铁
适应症:用于治疗缺血性贫血
治疗用量:成人一日片 每日一次
儿童一日片 每日一次
(1)、琥珀酸亚铁的相对分子质量为。(2)、琥珀酸亚铁中碳元素的质量分数为(结果精确至)。(3)、琥珀酸亚铁在口服片中的质量分数为。(4)、按治疗用量服用,成人每天最多补充铁元素的质量为多少?(结果保留两位小数)