相关试卷
- 人教版初中化学九年级下册同步练习-第八单元课题2《金属的化学性质》(基础卷)
- 人教版初中化学九年级下册同步练习-第八单元课题1《金属材料》(提升卷)
- 人教版初中化学九年级下册同步练习-第八单元课题1《金属材料》(基础卷)
- 广东省广州市广州中学2025-2026学年九年级上学期九月月考化学试题
- 人教版(五四学制)初中化学九年级全一册期末质量检测(提升卷)
- 人教版(五四学制)初中化学九年级全一册期末质量检测(基础卷)
- 人教版(五四学制)初中化学八年级全一册期末质量检测(提升卷)
- 人教版(五四学制)初中化学八年级全一册期末质量检测(基础卷)
- 广东省深圳市多校联考2025-2026学年九年级上学期10月期中化学试题
- 湖南省长沙市开福区青竹湖湘一外国语学校2025-2026学年九年级上学期化学第一次月考试卷
-
1、
Ⅰ.通常情况下,氨气是有刺激性气味的无色气体,密度比空气的小,极易溶于水,氨气与氯化氢气体相遇产生白烟,生成氯化铵。根据有关信息,回答下列问题:
(1)写出氨气的物理性质:________(任写一点)。
(2)氨气与氯化氢气体相遇产生白烟发生的是________(填“物理”或“化学”)变化。
(3)化工厂发生大量氨气泄漏,可用洒水的方法来吸收,原因是________。
Ⅱ.从微观角度:用“◯”表示氮原子,“●”表示氧原子。
(4)用“
 ”可表示的粒子是________(填名称);
”可表示的粒子是________(填名称);(5)同温同压下,气体的体积比等于分子数目比。若忽略空气中其他成分,下图可表示空气微观模型的是________(填字母);

Ⅲ.从污染角度:
(6)下列物质中不属于空气污染物的是___________(填字母);
A. 二氧化氮 B. 二氧化硫 C. 一氧化碳 D. 二氧化碳 (7)为改善空气质量,下列做法正确的是___________(填字母);
A. 禁止使用化石燃料 B. 适当控制机动车使用 C. 关闭所有厂矿产业、禁止烧煤 D. 加强建筑工地、道路扬尘监管 (8)空气质量分级标准如下表:
空气质量指数
50以下
51~100
101~150
151~200
201~300
300以上
质量级别
Ⅰ
Ⅱ
Ⅲ
Ⅳ
Ⅴ
Ⅵ
质量状况
优
良
轻度污染
中度污染
重度污染
严重污染
某地区空气质量指数保持在16~45之间,那么该地区空气质量状况总体保持在________(填“优”或“良”)。
-
2、建立宏观、微观和符号之间的相互联系是化学学科的特点。请根据下列信息回答有关问题:
 (1)、图1为粒子之间的转化关系图,其中①表示的粒子是。(2)、图2中选项表示镁原子结构示意图,该原子在化学反应中易失电子形成(填离子符号)。(3)、图2中表示相对稳定结构的选项有。(4)、A-C所示粒子共表示种元素(填数字)。(5)、B元素位于元素周期表第周期。(6)、A粒子所示结构示意图中“8”的意义。
(1)、图1为粒子之间的转化关系图,其中①表示的粒子是。(2)、图2中选项表示镁原子结构示意图,该原子在化学反应中易失电子形成(填离子符号)。(3)、图2中表示相对稳定结构的选项有。(4)、A-C所示粒子共表示种元素(填数字)。(5)、B元素位于元素周期表第周期。(6)、A粒子所示结构示意图中“8”的意义。 -
3、下列实验操作不规范的是A、查气密性:先将导管伸入水中,再用双手紧握试管外壁 B、固定装置:将试管口略向下倾斜,固定在铁架台上 C、加热药品:先让试管底部均匀受热,再对高锰酸钾所在部位加热 D、收集气体:装满氧气的集气瓶倒放在桌面上
-
4、我国是茶的故乡、茶文化发祥地、世界最大产茶国,茶兴于唐而盛于宋,目前“中国传统制茶技艺及其相关习俗”成功列入联合国教科文组织人类非物质文化遗产代表作名录。当代茶俗,以传统与时尚相融合的方式,不断渗透进我们的生活。回答下列小题(1)、生活中常见到富硒茶、富硒矿泉水、富硒粮食、富硒水果、富硒鸡蛋、富硒蔬菜,其中“硒”指的是A、元素 B、原子 C、离子 D、分子(2)、《清顶香茶》中记载:“日出卧龙日暮色,月生青顶月茶香”,从微观角度解释煮茶时闻到茶香的原因是A、分子可以分解为原子 B、分子之间的间隔变大 C、分子获得能量后运动速率加快 D、分子的总数增大(3)、市场上有很多“富硒产品”,硒在元素周期表中的部分信息如图所示。下列说法正确的是
 A、硒属于金属元素 B、硒的原子序数为34 C、硒的相对原子质量为78.97g D、1个硒原子中有34个中子
A、硒属于金属元素 B、硒的原子序数为34 C、硒的相对原子质量为78.97g D、1个硒原子中有34个中子 -
5、下列物质在空气或氧气中燃烧现象的描述,正确的是A、木炭在空气中燃烧,保持红热,放出热量,产生能使澄清石灰水变浑浊的气体 B、铁丝在氧气中剧烈燃烧,火星四射,放出热量,生成黑色的四氧化三铁 C、硫在氧气中燃烧,发出微弱的淡蓝色火焰,放出热量,产生刺激性气味的气体 D、红磷在空气中燃烧,生成大量的白色烟雾,放出热量
-
6、下列关于CO2组成的说法中,正确的是 。A、CO2是由碳原子和氧原子组成的 B、CO2是由碳原子和氧分子组成的 C、CO2是由碳元素和氧元素组成的 D、CO2是由碳和氧气组成的
-
7、项目式化学学习小组的同学制作了野外生存简易净水器(如图)完成下面小题。
 (1)、下列有关分析合理的是A、该装置净水的原理是吸附 B、该装置可以降低水的硬度 C、塑料膜可用棉布代替 D、塑料膜上的水分子停止了运动(2)、水是宝贵的自然资源。下列有关水的认识正确的是A、生活中加热煮沸降低水的硬度 B、工业上使用明矾对自来水消毒 C、农业上提倡大田漫灌浇灌作物 D、家庭中大力推广使用含磷洗涤剂
(1)、下列有关分析合理的是A、该装置净水的原理是吸附 B、该装置可以降低水的硬度 C、塑料膜可用棉布代替 D、塑料膜上的水分子停止了运动(2)、水是宝贵的自然资源。下列有关水的认识正确的是A、生活中加热煮沸降低水的硬度 B、工业上使用明矾对自来水消毒 C、农业上提倡大田漫灌浇灌作物 D、家庭中大力推广使用含磷洗涤剂 -
8、第19届杭州亚运会主火炬塔燃烧的液体燃料是被称为“零碳甲醇”(化学式为CH3OH)的物质,“零碳甲醇”是利用氢气与二氧化碳合成的一种绿色能源,其生产过程如图1所示。图2是反应II在一定条件下,在有、无分子筛膜时,甲醇的产率随温度变化的关系。
 (1)、甲醇(化学式为CH3OH)中碳元素和氢元素的质量比。(2)、由图2提供的信息可知,为提高甲醇的产率,合成甲醇应选择的最佳条件为。(3)、图1反应II的化学方程式为。(4)、采用上述流程工艺,反应II每吸收二氧化碳8.8t,理论上能产出甲醇的质量为多少?(请写出计算过程)
(1)、甲醇(化学式为CH3OH)中碳元素和氢元素的质量比。(2)、由图2提供的信息可知,为提高甲醇的产率,合成甲醇应选择的最佳条件为。(3)、图1反应II的化学方程式为。(4)、采用上述流程工艺,反应II每吸收二氧化碳8.8t,理论上能产出甲醇的质量为多少?(请写出计算过程) -
9、CaCl2·2H2O(二水合氯化钙)可用于食品加工、制药等领域。工业上生产CaCl2·2H2O的主要流程示意图如下图所示。
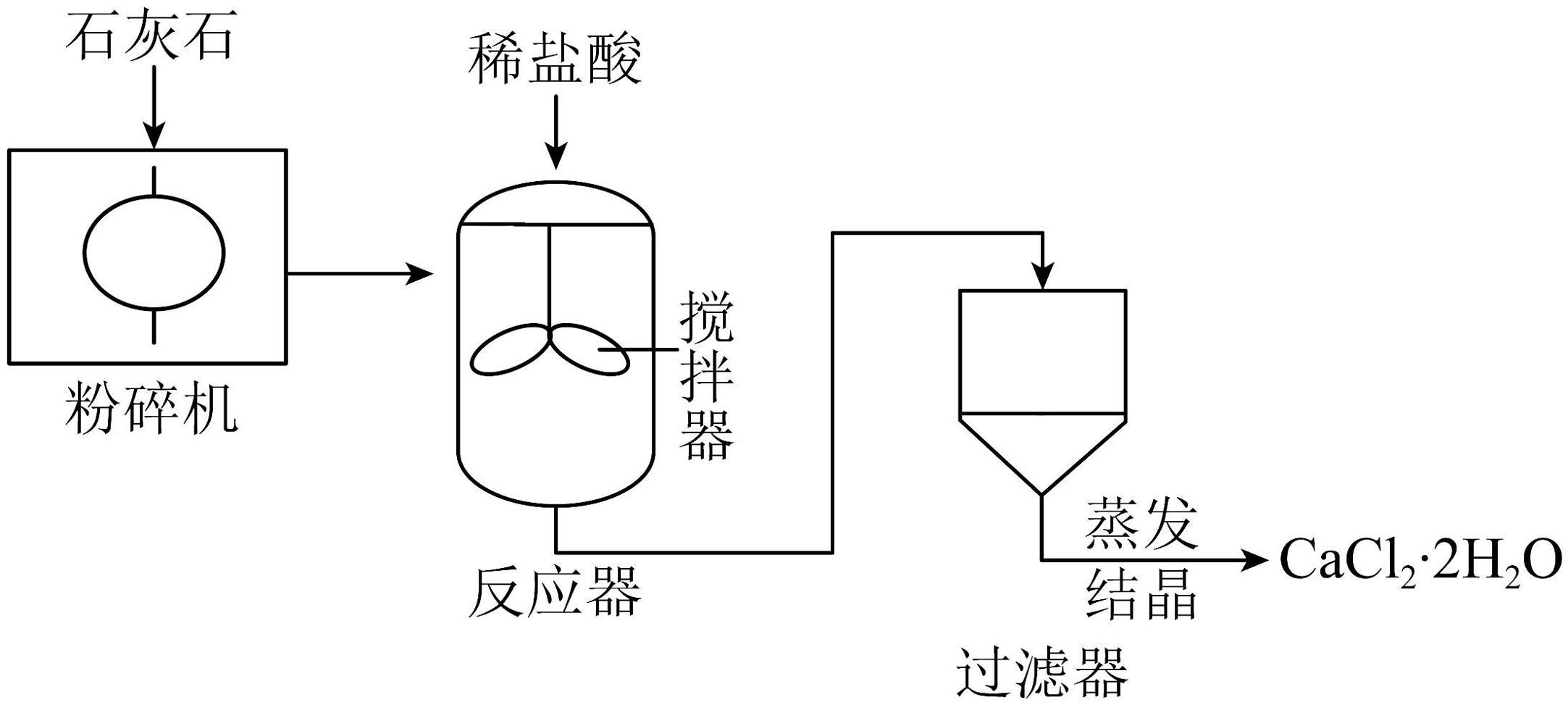 (1)、石灰石主要成分的化学式;CaCl2中氯元素的化合价为。(2)、反应器中发生反应的化学方程式为。(3)、上述流程中,粉碎机和搅拌器所起的作用是。(4)、反应器生成的气体,其固态叫做;该气体的一个用途。(5)、在实验室进行过滤操作时要用到的玻璃仪器有玻璃棒、烧杯、;过滤后仍然浑浊的可能原因。(填写一个)
(1)、石灰石主要成分的化学式;CaCl2中氯元素的化合价为。(2)、反应器中发生反应的化学方程式为。(3)、上述流程中,粉碎机和搅拌器所起的作用是。(4)、反应器生成的气体,其固态叫做;该气体的一个用途。(5)、在实验室进行过滤操作时要用到的玻璃仪器有玻璃棒、烧杯、;过滤后仍然浑浊的可能原因。(填写一个) -
10、某学习小组对二氧化碳的来源、性质、吸收等开启了“低碳行动“项目化学习探究之旅。(1)、主题一:探究家庭中二氧化碳的来源
【实验设计】
同学用两个相同的塑料瓶分别收集了炒菜前后灶台旁的气体。放在阳光下照射,观察水柱的移动情况。(在阳光照射下,富含二氧化碳气体的封闭环境比在普通空气环境中升温更快)

【实验现象】
红墨水水柱向边移动。(填“左”或“右”)。
【实验结论】
炒菜后空气中二氧化碳含量增多,说明燃气燃烧产生了二氧化碳。
(2)、主题二:探究CO2的性质操作
现象
性质

X为澄清石灰水时,现象为
CO2能与石灰水反应,
化学方程式为
X为紫色石蕊溶液时,现象为
CO2能与水反应生成

低处的蜡烛先熄灭,
高处的蜡烛后熄灭
;
CO2不燃烧,也不支持燃烧
【实践活动】
老师提供了自制汽水的标准配方:小苏打1.5g,柠檬酸1.5g,白糖10g,凉开水400mL。为改善口感,小组对标准配方进行了如下调整:增加小苏打、柠檬酸的用量,使汽水中的CO2更多,但可能会引发的问题是。
A.汽水甜度过大 B.制作过程中,造成液体喷出 C.打开瓶盖时,瓶盖弹出伤人
(3)、主题三:迈向碳中和低碳途径
低碳行动具体措施
减少二氧化碳的排放
减少使用化石燃料,更多使用清洁能源。
促进二氧化碳的吸收
植树造林,利用植物的吸收大气中的CO2.
-
11、
I:气体的制取及性质


(1)若用大理石与稀盐酸来制取CO2气体,为组装气体发生装置,应选择题18-1图的仪器是、E、C(填字母);若用如图所示I装置收集CO2 , 应从端进气(填“a”或“b”)。
(2)若用KMnO4制取O2 , 除用如图上述部分仪器外,还必需补充的仪器是(填仪器名称)。该反应的化学方程式为。
(3)收集一瓶O2并进行性质实验:
操作
现象
结论

铁丝燃烧时,(填字母),生成黑色固体
a.产生大量白烟
b.发出耀眼的白光
c.剧烈燃烧,火星四射
O2具有氧化性
从安全角度分析,水的作用是。
Ⅱ.跨学科实践活动:设计并制作简易制氧机(如图)

查阅资料:超氧化钾(KO2)产氧效率高,适合作生氧剂。
(4)原理分析:4KO2+2CO2=2K2CO3+3O2 , 4KO2+2X=4KOH+3O2↑,则X的化学式为。
(5)过滤仓中的水除了有过滤杂质的作用外,还起到的作用是(填字母)。
a.加快O2的生成 b.通过气泡观察生成的速率
(6)验证过滤仓导出的气体是O2的方法为。
-
12、据央视新闻报道:2023年3月25日,我国首次将光伏发电制成氢能应用于电力系统。
光伏发电制氢:利用太阳能产生的余电,将水分解并转化为氢气,可以得到“绿氢”。
固态储氢:利用固体与氢气发生物理吸附或化学反应等作用,可以把氢气储存起来。如镁系合金储氢原理之一是镁在一定条件下与氢气发生作用生成氢化镁(MgH2)。
固态氢能发电:其形式之一是在一定条件下将固态储氢装置释放的氢气注入燃料电池。氢气在燃料电池中与氧气发生化学反应,产生直流电,可实现能量的转化,为我们提供“绿电”。

能源站通过氢能的制取、存储、发电、加氢一体化,实现“绿电”与“绿氢”之间的灵活转换,很好地解决了新能源发电的随机性、季节性波动强的难题。
依据所给信息,回答下列问题:
(1)、光伏发电得到的“绿氢”,主要通过产生的余电将水分解而获得。(2)、图中制氢装置内电解水反应的产物是氧气和。(3)、镁属于(填“金属”或“非金属”)。镁在储氢过程中有化学变化发生,判断的依据是过程中生成了(填名称)。(4)、MgH2易与水发生反应生成Mg(OH)2(氢氧化镁)和H2 , 请写出MgH2与水反应的化学方程式为。据此,镁系合金储氢装置需要注意的安全问题之一是。(5)、燃料电池发电实现能量的转化,把能转化为电能。 -
13、新能源的开发和利用促进了能源结构向多元、清洁和低碳转变。(1)、目前,人类利用的能量大多来自化石燃料,如煤、和天然气。化石燃料属于(选填“可再生能源”或“不可再生能源”)。(2)、做饭时,天然气燃烧不充分,锅底易出现黑色物质,此时可调(选填“小”或“大”)燃气灶的进风口,使燃料充分燃烧,节约能源。(3)、我国研制出一种新型催化剂,在这种催化剂作用下,二氧化碳可以转化为汽油,主要转化过程如图所示(部分生成物已略去)。

①催化剂在化学反应前后质量和不变。
②过程I中反应生成CO同时生成水,该反应的化学方程式为。
(4)、随着科学技术的发展,氢能源的开发利用已取得很大进展。氢气作为新型能源的优点是(答一点即可)。 -
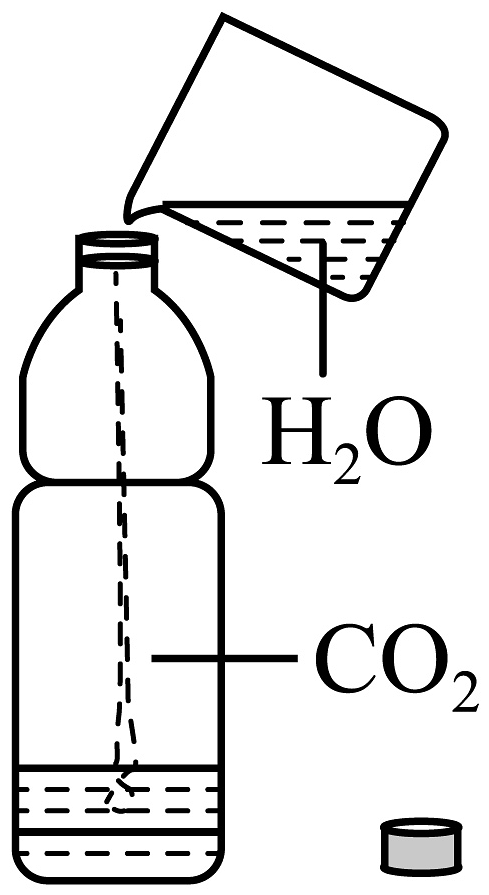
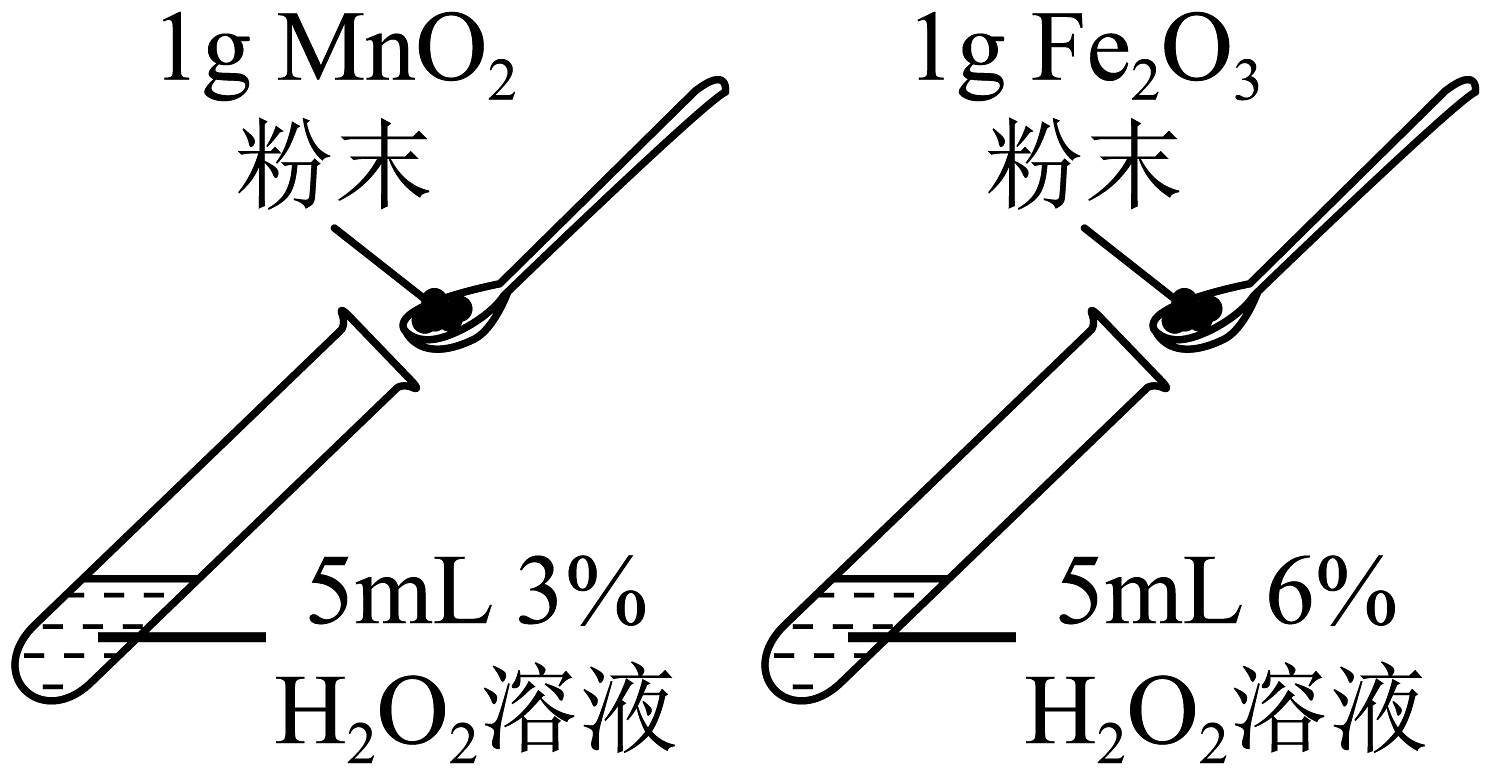
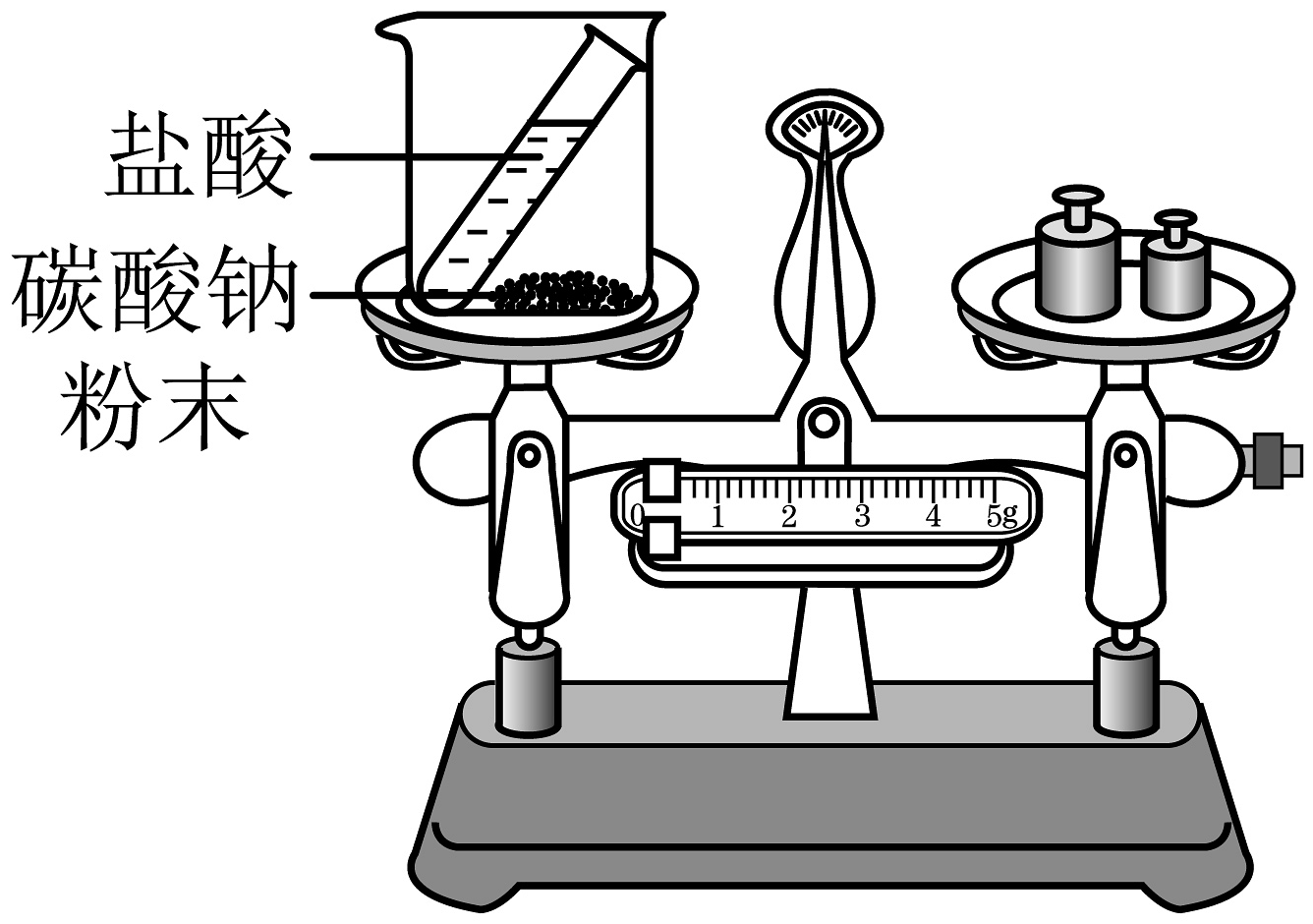
14、下列实验设计能达到实验目的的是
实验目的
A.证明CO2溶于水且能和水反应
B.探究不同催化剂的
催化效果
实验设计
实验目的
C.实验证明红磷的着火点比白磷的高
D.探究质量守恒定律
实验设计

 A、A B、B C、C D、D
A、A B、B C、C D、D -
15、“劳动创造幸福,实干成就伟业。”下列劳动项目所涉及的化学知识正确的是
选项
劳动项目
化学知识
A
用明矾处理较浑浊的天然水
明矾主要起杀菌消毒
B
利用铅笔进行书写绘画
石墨具有导电性
C
清理家中鱼缸并通入空气
空气中的氧气易溶于水
D
炒菜时,油锅着火用锅盖盖灭
灭火原理是隔绝氧气
A、A B、B C、C D、D -
16、维生素C(C6H8O6)主要存在于蔬菜和水果中,它能促进人体生长发育,增强人体对疾病的抵抗力。下列关于维生素C的说法中,不正确的是A、维生素C由C、H、O三种元素组成 B、1个维生素C分子由6个碳原子、8个氢原子、6个氧原子构成 C、维生素C的相对分子质量为176g D、维生素C中氢元素的质量分数最小
-
17、人类的进步发展离不开化学家的贡献。下列化学家及其贡献对应错误的是A、我国化学家闵恩泽院士,研发了多种用于石油化工生产的催化剂 B、张青莲主持测定了铟、铱、铕等元素的相对原子质量 C、徐寿与人合译《化学鉴原》并制定了元素中文名称的命名规则 D、袁隆平因发现青蒿素获得诺贝尔奖
-
18、2023年7月12日朱雀二号成功发射,它是全球首枚以液氧液态甲烷(CH4)为推进剂的运载火箭。请结合题图,回答下列小题
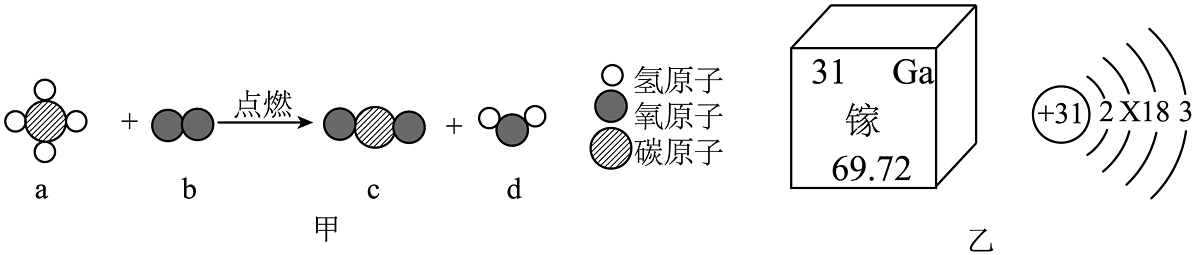 (1)、液态甲烷燃烧的微观示意图如图甲所示,下列说法错误的是A、反应前后分子数目不变 B、反应前后元素种类不变 C、a分子中碳、氢原子个数比为1:4 D、反应生成c、d的质量比为22:9(2)、镓是火箭上重要半导体材料,镓元素相关信息见图乙,下列有关镓元素说法错误的是A、镓元素为金属元素 B、镓原子的中子数是31 C、图中X的数值是8 D、镓的相对原子质量是69.72
(1)、液态甲烷燃烧的微观示意图如图甲所示,下列说法错误的是A、反应前后分子数目不变 B、反应前后元素种类不变 C、a分子中碳、氢原子个数比为1:4 D、反应生成c、d的质量比为22:9(2)、镓是火箭上重要半导体材料,镓元素相关信息见图乙,下列有关镓元素说法错误的是A、镓元素为金属元素 B、镓原子的中子数是31 C、图中X的数值是8 D、镓的相对原子质量是69.72 -
19、工业上一般采用分离液态空气的方法获得大量氧气,液态氧通常储存在钢瓶里。在实验室中,常用分解高锰酸钾或过氧化氢溶液来制取氧气。完成下面小题(1)、在“实验室加热高锰酸钾制取氧气”实验中,不需要标记的图标是A、
 B、
B、 C、
C、 D、
D、 (2)、下列有关氧气压缩成液态氧过程的说法正确的是A、氧分子体积变小 B、氧分子间空隙变小 C、氧分子数目变少 D、氧分子质量变小(3)、下列有关加热高锰酸钾制取氧气的实验操作正确的是A、
(2)、下列有关氧气压缩成液态氧过程的说法正确的是A、氧分子体积变小 B、氧分子间空隙变小 C、氧分子数目变少 D、氧分子质量变小(3)、下列有关加热高锰酸钾制取氧气的实验操作正确的是A、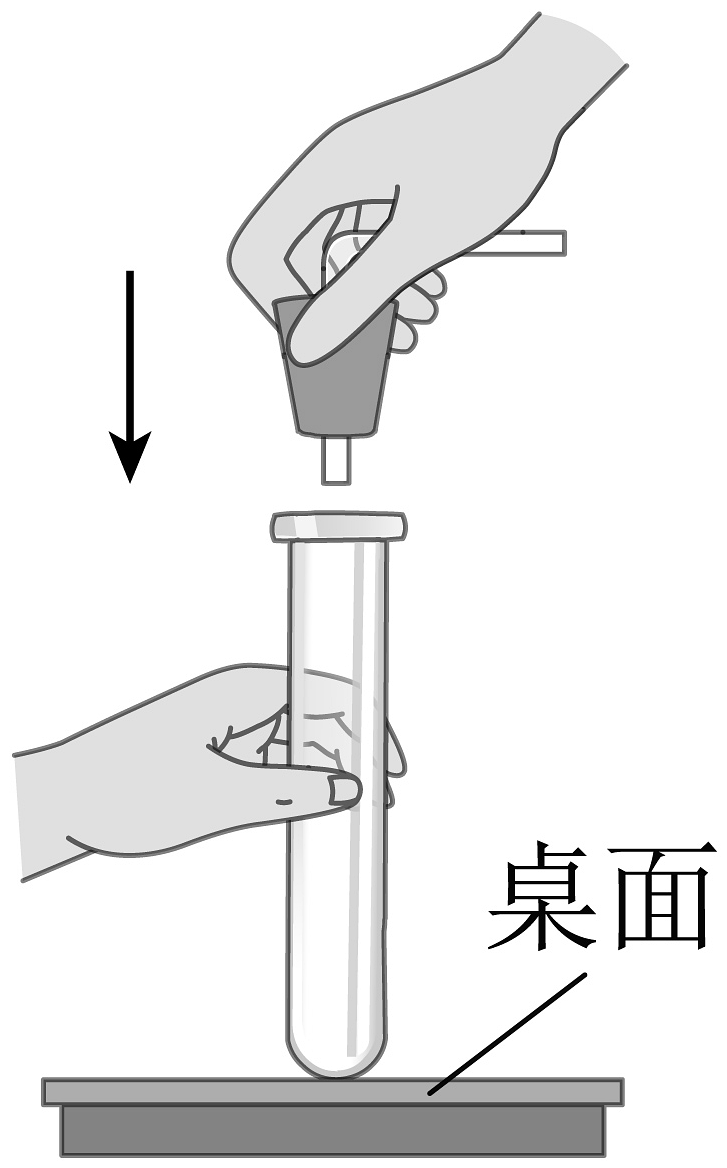 组装仪器
B、
组装仪器
B、 检查气密性
C、
检查气密性
C、 加热固体
D、
加热固体
D、 氧气验满
氧气验满
-
20、某化学兴趣小组测定大理石样品中碳酸钙的质量分数。在25g大理石样品中加入100g稀盐酸恰好完全反应(已知杂质不与盐酸反应,忽略盐酸的挥发及的溶解),反应后容器内混合物的质量为116.2g。(1)、产生的气气质地是g。(2)、该大理石样品中碳酸钙的质量分数是多少?