相关试卷
-
1、某学生用的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤滴定管后立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酸碱指示剂;
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)、以上操作步骤中有一步有错误,请指出编号 , 该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)。(2)、(双选)下列操作会引起实验结果偏大的是( )A、在锥形瓶装液前,留有少量蒸馏水 B、滴定前,装标准碱液的滴定管尖嘴有气泡,滴定后无气泡 C、锥形瓶先用蒸馏水洗涤后,再用待测液润洗 D、用滴定管量取待测液时将一滴待测液滴在锥形瓶外(3)、最合适的酸碱指示剂为 , 它的变色范围是。判断达到滴定终点的现象是。(4)、以下是实验数据记录表。滴定次数
盐酸体积(mL)
NaOH溶液的读数(mL)
滴定前
滴定后
1
20.00
0.00
18.25
2
20.00
0.10
18.45
3
20.00
0.30
19.75
通过计算可得,该盐酸浓度为:mol/L。
-
2、试根据沉淀溶解平衡知识回答问题:
常温下,CaS的 , 饱和溶液中存在平衡:。
(1)、该温度下,将氯化钙溶液硫化钠溶液等体积混合,(填“能”或“不能”)产生沉淀。滴加少量盐酸,(填“增大”或“减小”),请从平衡移动原理的角度解释:。(2)、若向CaS悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式。(3)、已知 , 在的溶液中,当刚开始沉淀时,溶液的pH为(保留1为小数,下同);若要使其沉淀完全,pH的范围是。 -
3、下表是几种弱电解质的电离平衡常数(25℃)
平衡常数的计算:电解质
电离方程式
平衡常数K
(1)、用溶液滴定20.00mL某未知浓度的一元酸HX溶液,如右图所示。其中①点所示溶液中 , ③点所示溶液中存在 , 则HX的电离平衡常数。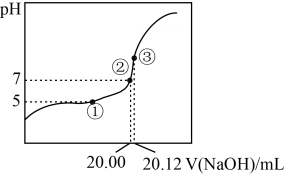 (2)、水解反应是典型的可逆反应。请写出Na2CO3水解反应的离子方程式:。(3)、水解反应的化学平衡常数称为水解常数(用表示),类比化学平衡常数的定义,请写出Na2CO3第一步水解反应的水解常数的表达式:。根据上表数据计算,25℃该常数的数值为(保留2位小数)。
(2)、水解反应是典型的可逆反应。请写出Na2CO3水解反应的离子方程式:。(3)、水解反应的化学平衡常数称为水解常数(用表示),类比化学平衡常数的定义,请写出Na2CO3第一步水解反应的水解常数的表达式:。根据上表数据计算,25℃该常数的数值为(保留2位小数)。 -
4、下表是几种弱电解质的电离平衡常数(25℃)
电解质
电离方程式
平衡常数K
回答下列问题:
(1)、由上表分析,若①CH3COOH②③HA④均可看作酸,则它们酸性由强到弱的顺序为(填序号)。(2)、试写出H2CO3与NH3·H2O等物质的量混合所得盐的电离方程式:;试写出HA与Na3PO4反应的离子方程式:。(3)、25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:(填“>”、“=”或“<”)。(4)、(双选)25℃时,向10mL0.01mol/LHA溶液中滴加VmL0.01mol/L氨水,混合溶液中粒子浓度关系正确的是( )A、若混合液pH>7,则V≥10 B、若混合液pH<7,则 C、V=10时,混合液中水电离程度大于10mL0.01mol/LHA溶液中水的电离程度 D、V=5时,(5)、已知BaSO4的溶解度随温度升高而增大。如左上图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题: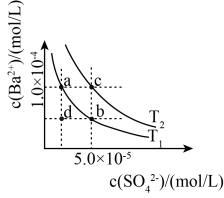
①T1T2(填>、=、<)。
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法错误的是
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
-
5、(双选)下列有关说法中错误的是( )A、某温度时的混合溶液中 , 说明该溶液呈中性(为该温度时水的离子积常数) B、常温下,由水电离出的的溶液的pH可能为2或12 C、已知 , , 向含有、且浓度均为0.010mol/L溶液中逐滴加入0.010mol/L的AgNO3溶液时,先产生沉淀 D、常温下CH3COOH的电离平衡常数 , 某pH=4.8的CH3COOH和CH3COONa混合溶液中,
-
6、已知。三种金属硫化物在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
 A、a点没有ZnS沉淀生成 B、可用MnS除去MnCl2溶液中混有的少量ZnCl2 C、向CuS悬浊液中加入少量水,平衡向溶解的方向移动,达到新平衡后增大 D、CuS和MnS共存的悬浊液中,
A、a点没有ZnS沉淀生成 B、可用MnS除去MnCl2溶液中混有的少量ZnCl2 C、向CuS悬浊液中加入少量水,平衡向溶解的方向移动,达到新平衡后增大 D、CuS和MnS共存的悬浊液中, -
7、关于沉淀溶解平衡和溶度积常数,下列说法错误的是( )A、只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 B、向1mL2mol/LNaOH溶液中先滴加2滴0.1mol/LMgCl2溶液,再滴加2滴0.1mol/LFeCl3溶液,先生成白色沉淀,后生成红褐色沉淀,说明 C、25℃时在水中的溶解度大于其在溶液中的溶解度 D、已知某温度下 , , 则的平衡常数约为
-
8、已知:25℃时, , 。下列说法正确的是( )A、25℃时,饱和溶液与饱和溶液相比,前者的大 B、25℃时,在的悬浊液加入少量的NH4Cl固体,增大 C、25℃时,固体在20mL0.01mol/L氨水中的比在20mL0.01mol/LNH4Cl溶液中的小 D、25℃时,在的悬浊液加入NaF溶液后,不可能转化成为MgF2
-
9、下列叙述正确的是( )A、醋酸溶液的导电能力可能比稀硫酸强 B、硫磺是单质,不导电,因此硫磺是非电解质 C、SO3溶于水,其水溶液能导电,故SO3是电解质 D、强电解质都是离子化合物,因此NaCl是离子化合物
-
10、和的大量排放会对环境产生影响,科学家在积极探索用化学方法吸收并综合利用CO和(1)、I.重整吸收。主要反应如下:
①
②
在容积固定的某密闭容器中,反应物投料比按发生上述反应,CO2、CH4的平衡转化率随温度变化的曲线如右图所示。
根据消耗可以判断:图中曲线(选填“A”或“B”)表示CO2的平衡转化率随温度的变化趋势。
提高CH4的平衡转化率的措施为(列举一条)。
(2)、图中X点的v(CH4 , 正)v(CH4 , 逆)(选填“>”、“<”或“=”)。若起始 , 反应至5min时,CH4的转化率达到Y点,且为0.2mol/L,则0~5min内H2O(g)的平均反应速率v=mol/(L·min)。
(3)、Ⅱ.ZnO悬浊液吸收 , 再催化氧化得到硫酸盐。向ZnO悬浊液中缓缓通入SO2 , SO2吸收率及溶液pH变化如图所示。已知:微溶于水,易溶于水。
在0~10min,溶液pH几乎保持不变,该阶段主要产物为(填化学式)。在30~40min,SO2吸收率迅速降低,该阶段主要反应的离子方程式为。 (4)、调节吸收SO2所得溶液的pH为4.5~6.5,缓缓通入O2 , 则溶液pH将(选填“增大”、“减小”或“不变”)。
(4)、调节吸收SO2所得溶液的pH为4.5~6.5,缓缓通入O2 , 则溶液pH将(选填“增大”、“减小”或“不变”)。 -
11、(双选)已知: 。恒温恒容下,在10L的密闭容器中加入和 , 经过2min达到平衡状态,反应放热。下列判断正确的是( )A、在2min内, B、若再充入 , 达到平衡后的质量分数会减小 C、在1min时, D、若恒温恒压下,在10L的密闭容器中加入和 , 平衡后反应放热小于
-
12、碱式硫酸铁是一种新型高效絮凝剂,常用于污水处理,在医疗上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝等)生产碱式硫酸铁的工艺流程如下所示:

部分正离子以氢氧化物形式沉淀时溶液的pH如表所示:
沉淀物
开始沉淀
2.3
7.5
3.4
完全沉淀
3.2
9.7
4.4
请回答下列问题:
(1)、加入少量NaHCO3的目的是将溶液的pH条件至范围,以除去 , 可能发生的离子方程式为。(2)、在实际生产中,反应Ⅱ中常同时通入O2 , 以减少NaNO2的用量,O2与NaNO2在反应中均作。若参与反应的O2有11.2L(标准状况),则相当于节约了molNaNO2。(3)、碱式硫酸铁溶于水后产生的可部分水解生成 , 该水解反应的离子方程式为。(4)、在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有及。为检验所得的产品中是否含有 , 应当先用稀硫酸溶解样品。请简述后续的检验方法:。 -
13、下列溶液中有关物质的量浓度的关系正确的是( )A、在溶液中, B、含有、、、的溶液中,离子浓度大小关系可能为: C、物质的量浓度相等的HF溶液和NaF溶液等体积混合: D、0.1mol/L的溶液中:
-
14、常温下,有关醋酸溶液的叙述中错误的是( )A、pH=5.6的CH3COOH与CH3COONa混合溶液中: B、将pH=3的醋酸稀释为pH=4的过程中,比值减小 C、浓度均为0.1mol/L的和溶液等体积混合后: D、amL pH=3的醋酸溶液与bmL pH=11的NaOH溶液恰好完全中和时,a=b
-
15、下列各种情况下一定能大量共存的离子组为( )A、pH=7的溶液中:、、、 B、常温下由水电离出的的溶液中:、、、 C、pH=1的溶液中:、、、 D、无色溶液中:、、、
-
16、下列事实与盐类水解原理无关的是( )A、明矾用于净水 B、实验中常将FeCl3晶体溶于较浓盐酸中配制FeCl3溶液 C、用小苏打中和过多的胃酸 D、用氯化铵和氯化锌溶液除铁锈
-
17、《礼记·内则》“冠带垢,和灰清漱;衣裳垢,和灰清浣。”古人洗涤衣裳冠带,所用的就是草木灰浸泡的溶液。下列说法错误的是( )A、草木灰的主要成分是K2CO3 B、洗涤利用了草木灰溶液的碱性 C、洗涤时加热可增强去油污能力 D、草木灰做肥料时可与铵态氮肥混合施用
-
18、如图表示的是某离子X的水解过程示意图,则离子X可能是( )
 A、 B、 C、Na+ D、
A、 B、 C、Na+ D、 -
19、(1)、常温下,NaF溶液呈性,用离子方程式表示溶液呈该性的原因。将0.1mol/LNaF溶液与0.1mol/LHF溶液等体积混合,溶液呈酸性,则其中各离子物质的量浓度由大到小的顺序为。(2)、物质的量浓度相同的①②③④四种稀溶液中,浓度由大到小的顺序是(填序号)。
-
20、(1)、常温下,0.05mol/L硫酸溶液中,mol/L,水电离的mol/L。将1mL该溶液加水稀释到100mL,稀释后的溶液中。(2)、T1℃时,纯水中 , 则纯水中mol/L,此时温度(填“高于”“低于”或“等于”)25℃。若温度不变,滴入盐酸后 , 则溶液中mol/L,由水电离的mol/L。(3)、T2℃时,测得的NaOH溶液的pH为11,则该温度下水的离子积常数。该温度(填“高于”“低于”或“等于”)25℃。(4)、常温下,设pH=5的溶液中由水电离出的为c1;pH=5的溶液中由水电离出的为 , 则。(5)、常温下,pH=13的溶液aL与pH=3的溶液bL混合(混合后溶液体积变化忽略不计),若所得混合溶液呈中性,则a∶b=。(6)、已知t℃时, , 在该温度时将pH=9的NaOH溶液aL与pH=2的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=3,则a∶b=。