相关试卷
-
1、合成氨的发展体现了化学科学与技术的不断进步。(1)、1898年,化学家用氮气、碳化钙(CaC2)与水蒸气反应制备氨:
i.碳化钙和氮气在1000℃的高温下产生氰氨化钙(CaCN2);
ii.氰氨化钙与水蒸气反应生成氨气。
写出反应ii
 化学方程式:。(2)、20世纪初,以N2和H2为原料的工业合成氨方法研制成功。其反应为:。
化学方程式:。(2)、20世纪初,以N2和H2为原料的工业合成氨方法研制成功。其反应为:。①N2的化学性质稳定,即使在高温、高压下,N2和H2的化合反应仍然进行得十分缓慢。从分子结构角度解释原因:。
②压强对合成氨有较大影响。下图为不同压强下,以物质的量分数x(H2)=0.75、x(N2)=0.25进料(组成1),反应达平衡时,x(NH3)与温度的计算结果。

i.判断压强:p1p2(填“>”或“<”),简述理由:。
ii.在p1、x(NH3)=0.20时,氮气的转化率为。
iii.合成氨原料气中存在不参与反应的Ar时会影响NH3的平衡含量。在p1时,以物质的量分数x(H2)=0.675、x(N2)=0.225、x(Ar)=0.10进料(组成2),反应达平衡时x(NH3)与温度的计算结果与组成1相比有一定变化,在上图中用虚线画出相应曲线。
(3)、我国科学家研制出双催化剂,通过光辐射产生温差(如体系温度为495℃时,纳米Fe的温度为547℃,而的温度为415℃,解决了温度对合成氨工业反应速率和平衡转化率影响矛盾的问题,其催化合成氨机理如图所示。
分析解释:与传统的催化合成氨(铁触媒、)相比,双催化剂双温催化合成氨具备优势的原因是。
-
2、 2023年杭州亚运会开幕式首次使用“零碳甲醇”作为主火炬塔燃料,实现废碳再生、循环内零碳排放。已知某些共价键的键能:
化学键
H-H
C-H
O-H
C-O
C=O
键能/(kJ·mol-1)
436
413
463
351
745
(1)、CO2的电子式为。(2)、CH3OH分子结构如图。
①CH3OH分子中O的杂化轨道类型。
②键长a、b、c从长到短的顺序为。
③乙醇
 沸点(78℃)高于甲醇(65℃)。解释原因:。(3)、在350℃、催化下用CO2制备CH3OH的反应原理如图。
沸点(78℃)高于甲醇(65℃)。解释原因:。(3)、在350℃、催化下用CO2制备CH3OH的反应原理如图。
①该条件下制备甲醇的化学方程式为:。
②下列说法正确的是 (填序号)。
A.电负性由大到小的顺序:O>C>H
B.步骤a涉及s-s σ键的断裂和s-sp3 σ键的形成
C.步骤d、e的反应热(ΔH)相等
D.升高温度可以提高反应速率和CH3OH的平衡产率
(4)、干冰(CO2)的晶胞结构如图所示,若该晶胞边长为apm,则干冰晶体的密度为。(已知:;表示阿伏加德罗常数)
-
3、一定温度下,向含一定浓度金属离子M2+(M2+代表、和)的溶液中通H2S气体至饱和c(H2S)为时,相应的金属硫化物在溶液中达到沉淀溶解平衡时的与pH关系如下图。下列说法不正确的是( )
 A、a点所示溶液中, B、该温度下, C、b点所示溶液中,可发生反应 D、Zn2+、Mn2+浓度均为的混合溶液,通入H2S并调控pH可实现分离
A、a点所示溶液中, B、该温度下, C、b点所示溶液中,可发生反应 D、Zn2+、Mn2+浓度均为的混合溶液,通入H2S并调控pH可实现分离 -
4、分别向相同浓度的Na2CO3、NaHCO3溶液中逐滴加入盐酸,滴定过程中溶液的pH变化如下图,下列说法不正确的是( )
 A、曲线①、②分别表示盐酸滴定Na2CO3、NaHCO3溶液的过程 B、a、b、c点水的电离程度:a>b>c C、a、b、d点均满足: D、ab段和de段发生的主要反应均为:
A、曲线①、②分别表示盐酸滴定Na2CO3、NaHCO3溶液的过程 B、a、b、c点水的电离程度:a>b>c C、a、b、d点均满足: D、ab段和de段发生的主要反应均为: -
5、某小组同学进行如下实验探究沉淀转化:
①向20mL0.1mol·L-1Na2CO3溶液中滴加20mL0.1mol·L-1BaCl2溶液,得浊液Ⅰ;
②向浊液Ⅰ中继续滴加20mL0.1mol·L-1Na2SO4溶液,充分振荡,得浊液Ⅱ;
③将浊液Ⅱ过滤,向滤渣中加入过量盐酸产生气体,过滤、洗涤、干燥,测得剩余固体a的质量大于0.233g。
下列说法不正确的是( )
A、Na2CO3溶液显碱性的原因: B、固体a的成分为BaSO4 C、c(Ba2+)大小关系:浊液Ⅰ<浊液Ⅱ D、由该实验可以推断 -
6、基于水煤气转化反应 , 通过电化学装置制备纯氢的原理示意如下。下列说法不正确的是( )
 A、电解质溶液可以是KOH溶液 B、阴极电极反应为: C、使用阴离子交换膜能减缓单位时间内乙室中c(OH-)的降低 D、该装置中氧化反应和还原反应分别在两极进行,利于制得高纯度氢气
A、电解质溶液可以是KOH溶液 B、阴极电极反应为: C、使用阴离子交换膜能减缓单位时间内乙室中c(OH-)的降低 D、该装置中氧化反应和还原反应分别在两极进行,利于制得高纯度氢气 -
7、一定温度下,在2L的恒容密闭容器中,“甲烷重整”反应()原理如下。

已知“甲烷重整”反应在不同温度下的化学平衡常数:
温度/℃
850
1000
1200
1400
K
0.5
2
275
1772
下列说法不正确的是( )
A、物质a可能是Fe3O4 B、若增大的值,则CH4的平衡转化率降低 C、 D、1000℃,若容器中、 , 则反应处于平衡状态 -
8、根据下列实验操作和现象所得结论正确的是( )
选项
实验操作
现象
结论
A
将 Cl₂通入品红溶液
溶液红色褪去
Cl₂具有漂白性
B
向某溶液中滴加几滴氯水,再滴加KSCN溶液
溶液变红
原溶液中有Fe2+
C
向Ca(ClO)2溶液中通入SO2气体
有沉淀生成
酸性:H2SO3>HClO
D
向Al(OH)3沉淀中分别滴加足量盐酸或NaOH溶液
沉淀均溶解
Al(OH)3是两性氢氧化物,Al 表现一定的非金属性
A、A B、B C、C D、D -
9、下列实验能达到实验目的的是( )
A
B
C
D
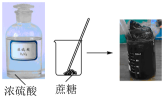

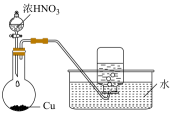
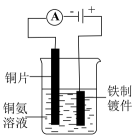
验证浓硫酸具有脱水性
配制100 mL一定物质的量浓度的溶液
制备并收集NO2
铁件镀铜
A、A B、B C、C D、D -
10、下列事实与水解反应无关的是( )A、常温下相同浓度溶液的pH大小:Na2S(aq)>(NH4)2S(aq) B、纯碱溶液去除油污的能力强弱:热纯碱液>冷纯碱液 C、除去工业废水中的Hg2+:向废水中加入FeS固体 D、配制FeCl3溶液:将FeCl3固体溶于浓盐酸,再稀释至所需浓度
-
11、下列反应的方程式不正确的是( )A、C和浓H2SO4反应: B、NH3的催化氧化反应: C、向氢硫酸中通入SO2: D、向FeBr2溶液中通入足量Cl2:
-
12、金属钾可以与水(滴加酚酞溶液)剧烈反应,下列说法不正确的是( )
 A、溶液变红,证明生成了碱性物质 B、钾浮在液面上并燃烧,与其密度及反应的热效应有关 C、钾与水反应比钠与水反应更剧烈,说明钾的金属性比钠强 D、金属钾与水发生反应前后化学键类型不变
A、溶液变红,证明生成了碱性物质 B、钾浮在液面上并燃烧,与其密度及反应的热效应有关 C、钾与水反应比钠与水反应更剧烈,说明钾的金属性比钠强 D、金属钾与水发生反应前后化学键类型不变 -
13、下列应用中未涉及氧化还原反应的是( )A、将过氧化钠置于呼吸面具中供氧 B、将明矾置于浑浊的水中净水 C、将漂白粉置于水中漂白衣物 D、将覆铜板置于氯化铁溶液中制作电路板
-
14、核污染水中含有38Sr、55Cs等多种放射性同位素粒子,会对人体和环境产生危害。下列说法不正确的是( )A、含有的中子比质子多27个 B、Sr位于元素周期表第五周期、第ⅡA族 C、可用沉淀法或离子交换法去除核污染水中的 D、借助元素周期表比较可知Sr的金属性比Cs强
-
15、下列化学用语或图示表达不正确的是( )A、基态S原子的最外层电子轨道表示式:
 B、基态29Cu原子的电子排布式:
C、H2O的VSEPR模型:
B、基态29Cu原子的电子排布式:
C、H2O的VSEPR模型: D、Cl2分子中σ键的形成:
D、Cl2分子中σ键的形成:
-
16、我国科学家首次合成大面积全碳纳米材料——石墨炔,其结构与石墨类似,可用于制备储锂电极材料。下列关于石墨炔的说法不正确的是( )
 A、与石墨互为同分异构体 B、碳原子有sp、sp2两种杂化方式 C、与石墨类似,层间存在范德华力 D、具有传导电子的性能
A、与石墨互为同分异构体 B、碳原子有sp、sp2两种杂化方式 C、与石墨类似,层间存在范德华力 D、具有传导电子的性能 -
17、实验室用浓盐酸、二氧化锰共热制氯气,并用氯气制取氯酸钾、次氯酸钠,并验证氯水的性质。

 (1)、写出实验室用装置①制备氯气的反应方程式。(2)、有同学认为①②装置之间应加入一盛有饱和食盐水的洗气瓶,则此洗气瓶的作用是。(3)、图一中②的试管中盛有15mL 30%的KOH溶液;③的试管中盛有15mL 8%的NaOH溶液,并置于冰水
(1)、写出实验室用装置①制备氯气的反应方程式。(2)、有同学认为①②装置之间应加入一盛有饱和食盐水的洗气瓶,则此洗气瓶的作用是。(3)、图一中②的试管中盛有15mL 30%的KOH溶液;③的试管中盛有15mL 8%的NaOH溶液,并置于冰水浴中;写出制取次氯酸钠的反应方程式 ,
比较制取次氯酸钠和氯酸钾的反应条件,试总结两条差异:
① ②。
(4)、④的试管中加有紫色石蕊试液,实验过程中可观察到的现象是 , 导致该现象的相应微粒为。(5)、反应完毕冷却后,②的试管中有大量晶体析出,图二中符合该晶体溶解度随温度变化规律的曲线是(选填字母);从②的试管中分离该晶体的操作是(填写实验操作名称)。(6)、含氯消毒剂的消毒效果用有效氯表示,有效氯指的是与浓盐酸反应产生Cl2的质量与原消毒液质量的比值。计算10% NaClO溶液的有效氯(保留三位小数)。(7)、传统工业电解饱和食盐水所得的烧碱中往往混有食盐,若要检验其中混有氯离子,简述实验方法、现象和结论。 -
18、某种胃药的止酸剂为碳酸钙(说明书规格为每克含碳酸钙620mg),某同学查阅测定每片中碳酸钙含量的方法有以下几步操作(设药片中的其它成分不与盐酸反应或氢氧化钠反应):
①分别配制250mL 0.100mol·L-1稀盐酸和0.100mol·L-1 NaOH溶液;
②取一粒药片(0.100g)研碎后加入20.0mL蒸馏水;
③加入25.00mL 0.100mol·L-1稀盐酸,搅拌,充分反应;
④用0.100mol·L-1 NaOH溶液中和剩余的盐酸,用去NaOH溶液体积为V mL。
请回答下列问题:
(1)、配制NaOH溶液需要的主要玻璃仪器除了烧杯、胶头滴管外还有。(2)、实验过程中发生的化学反应方程式为、。(3)、为了增加实验的精确性,某同学四次测定所消耗的NaOH(aq)体积数据如下:测定次序
第一次
第二次
第三次
第四次
V[NaOH(aq)]/mL
11.00
12.90
13.10
13.00
请根据这位同学的实验数据,计算药片中碳酸钙的质量分数,并比对说明书上规格判断该碳酸量是否合格
(要求写出计算过程)。
(4)、若在配制NaOH溶液的过程中出现下列情况,则会导致所测碳酸钙的质量分数偏高的是( )(不定项)A、称量NaOH固体时间过长 B、在烧杯中溶解NaOH后,立即转移至容量瓶内 C、溶液转移后未洗涤烧杯和玻璃棒 D、定容时俯视容量瓶刻度线 -
19、由三个原子构成的某气体分子,其摩尔质量为M g/mol,该气体的体积为V L(标准状况),用NA表示阿伏加德罗常数,则:(1)、该气体中所含的原子总数为个。(2)、该气体在标准状况下的密度为。(3)、该气体的一个分子的质量为。(4)、标准状况下,1体积水最多溶解507体积的HCl,则标准状况下盐酸的最大质量分数为(保留三位小数)。(5)、100g 12mol/L(密度为1.19g/mL)的盐酸用100g水稀释后,其物质的量浓度(填“大于”、“等于”或“小于”)6mol/L。
-
20、t℃时,A的溶解度是S g/100g水,其饱和溶液密度为d g·cm-3 , 物质的量浓度为c mol·L-1 , 溶液的质量分数为w,摩尔质量为M g·mol-1 , 实验测得向一定量含A的溶液中加入m g无水A或蒸发掉n g水后恢复到t℃,均为饱和溶液,下列关系式正确的是( )A、 B、 C、 D、