相关试卷
-
1、醋酸和氨水是常用的化学试剂,某研究小组对两种试剂进行了如下实验。(1)、实验一 配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.2 mol·L-1的醋酸溶液,用0.2 mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
配制250 mL 0.2 mol·L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、和。(2)、为标定某醋酸溶液的准确浓度,用0.200 0 mol·L-1的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:实验序号
1
2
3
4
消耗NaOH溶液的体积(mL)
19.05
19.00
18.10
18.95
则该醋酸溶液的准确浓度为(保留小数点后四位)。
(3)、实验二 探究温度对醋酸电离程度的影响
请你设计一个实验完成该探究,请简述你的实验方案。(4)、氨水中存在电离平衡,用电离常数Kb和电离度α(电离部分占总量的比值)来定量表示其电离程度,它们均可通过各浓度氨水对应的c(OH-)进行换算。下面是该小组在25℃ 时测定一系列浓度氨水的pH所对应的c(OH-):【仪器与试剂】酸度计、50 mL碱式滴定管、100mL烧杯、 0.10 mol·L-1氨水
【实验数据】(不必填表格)
烧杯号
V氨水 (mL)
V水(mL)
c (NH3·H2O) (mol·L-1)
c(OH-)
Kb
α
1
50.00
0.00
1.34×10-3
2
25.00
25.00
9.48×10-4
3
5.00
x
4.24×10-4
根据以上信息回答以下问题:

①表格中x = 。
②25℃时,氨水的电离常数Kb ≈ , 通过计算所得所得的数据和简洁文字说明电离度与弱电解质的初始浓度的关系是。
③用0.10mol/L的盐酸分别滴定20.00mL 0.10mol·L-1 NaOH
溶液和20.00mL 0.10mol·L-1氨水所得的滴定曲线如图:请指出盐酸滴定氨水的曲线为(填A或B),请写出曲线上a点所对应的溶液中各离子浓度由大到小的排列顺序。
-
2、某兴趣小组用数字实验系统测定一定浓度碳酸钠的溶液的pH与温度的关系,得到如图所示曲线。下列分析错误的是( )
 A、c点水解程度最大 B、水的电离平衡不会对溶液的pH产生影响 C、a→b段水解平衡向右移动 D、该水解是吸热过程
A、c点水解程度最大 B、水的电离平衡不会对溶液的pH产生影响 C、a→b段水解平衡向右移动 D、该水解是吸热过程 -
3、下列离子方程式书写正确的是( )A、在水溶液中水解: B、硫化钠水解: C、硫酸铜溶液显酸性: D、用Na2CO3溶液处理水垢中的CaSO4:CO32-(aq)+CaSO4(s)CaCO3(s)+SO42-(aq)
-
4、已知反应 , 在催化过程中,不同途径可能生成不同的过渡态(TS为过渡态)和中间产物。发生该反应时,途径Ⅰ和途径Ⅱ的能量变化如图所示,下列说法错误的是( )
 A、途径Ⅰ的最大能垒(活化能)为 B、该反应为放热反应 C、途径Ⅱ比途径Ⅰ的催化效果好 D、催化剂不能改变该反应的反应热
A、途径Ⅰ的最大能垒(活化能)为 B、该反应为放热反应 C、途径Ⅱ比途径Ⅰ的催化效果好 D、催化剂不能改变该反应的反应热 -
5、已知难溶性物质K2SO4·MgSO4·2CaSO4在水中存在如下平衡: K2SO4·MgSO4·2CaSO4(s)2Ca2+(aq)+2K+(aq)+Mg2+(aq)+4SO42- (aq),不同温度下,K+的浸出浓度与溶浸时间的关系如图所示。则下列说法错误的是( )
 A、向该体系中加入饱和NaOH溶液,沉淀溶解平衡向右移动 B、向该体系中加入饱和碳酸钠溶液,沉淀溶解平衡均向右移动 C、该难溶性物质的Ksp=c(Ca2+)·c(K+)·c(Mg2+)·c(SO42-) D、升高温度,溶浸速率增大,平衡向右移动
A、向该体系中加入饱和NaOH溶液,沉淀溶解平衡向右移动 B、向该体系中加入饱和碳酸钠溶液,沉淀溶解平衡均向右移动 C、该难溶性物质的Ksp=c(Ca2+)·c(K+)·c(Mg2+)·c(SO42-) D、升高温度,溶浸速率增大,平衡向右移动 -
6、下列实验方案不能达到相应目的的是( )
选项
目的
实验方案
A
比较 AgCl、AgI 的溶解度大小
向 2 mL 0.1 mol·L-1AgNO3溶液中滴加 2 滴 0.1mol·L-1NaCl 溶液,继续再滴加2滴0.1 mol·L-1 NaI溶液
B
研究酸碱性对化学平衡的影响
向两份5mL0.1 mol·L-1K2Cr2O7溶液中分别加入 5滴3 mol·L-1硫酸和5滴6 mol·L-1的NaOH 溶液
C
对比硫酸溶液、唾液对淀粉水解催化效果
同温时,分别向两份加有2滴碘水的淀粉稀溶液中加入1mL唾液和1mL稀硫酸
D
比较碳酸、醋酸的酸性强弱
向盛有2mL 1 mol·L-1醋酸的试管中加入1 mol·L-1的 Na2CO3溶液
A、A B、B C、C D、D -
7、 下列实验装置正确并能达到实验目的的是( )
 A、装置甲用于测定生成氢气的速率 B、装置乙制取碳酸氢钠 C、装置丙制备无水氯化镁 D、装置丁测定未知醋酸的浓度
A、装置甲用于测定生成氢气的速率 B、装置乙制取碳酸氢钠 C、装置丙制备无水氯化镁 D、装置丁测定未知醋酸的浓度 -
8、下列对生产、生活中事实的解释正确的是( )
选项
事实
解释
A
NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
两者混合会生成CO2和氢氧化铝,可阻止氧气与可燃物接触和降低可燃物表面温度
B
用热的碳酸钠溶液去除油污
加热抑制了碳酸钠的水解
C
合成氨工业使用铁触媒作催化剂
催化剂既能加快反应速率,又能提高氢气的平衡转化率
D
NH4Cl溶液可作焊接金属时的除锈剂
NH4Cl溶液水解呈碱性,可溶解金属氧化物
A、A B、B C、C D、D -
9、下列有关反应的说法正确的是( )A、该反应在任何温度下都能自发进行 B、其他条件一定,平衡时升高温度,v(正)减小,v(逆)增大 C、其他条件不变,将容器体积扩大一倍,PCl5体积分数减小 D、消耗2.24 L , 反应转移0.2 mol电子
-
10、人们可通过改变条件来调控化学反应的速率与限度,使其向着对人类更有益的方向发展。下列条件的改变不是从化学反应速率与限度的角度考虑的是( )A、橡胶轮胎中加入防老化剂 B、燃煤中加入CaO C、化工生产时将金属矿石粉碎再进行预处理 D、制取时使用催化剂
-
11、设为阿伏加德罗常数的值。下列叙述正确的是( )A、固体中含有的NH4+ 数目为 B、密闭容器中通入1molN2与足量H2充分反应,生成的NH3分子数目为 C、体积为的0.溶液中,数目为0.1 D、将含的溶液滴入沸水中,制得的胶体粒子数目为
-
12、下列电离方程式正确的是( )A、Al2(SO4)3 2Al3++3SO42- B、HIH++I- C、HFH++F- D、Ca(OH)2Ca2++2OH-
-
13、下列说法不正确的是( )A、铵态氮肥与草木灰不宜混合施用 B、实验室配制溶液时,将溶在一定浓度的硫酸中,最后加入少许铁粉 C、实验室中盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞 D、加热蒸干CuCl2溶液可以得到CuCl2固体
-
14、腺嘌呤(A)是一种有机弱碱,与盐酸反应生成盐酸盐(AHCl)。下列叙述错误的是( )A、AHCl 属于弱电解质 B、向水中加入AHCl,可促进水的电离 C、向 0.01 mol·L-1AHCl 水溶液中加水稀释,pH 升高 D、AHCl的水溶液中:c ( OH- )+c ( Cl- )=c ( H+ )+c ( AH+ )
-
15、我国古代哲学认为物质是阴阳组成的对立统一体,下列化学知识正确且最能体现阴阳对立统一的是( )A、化学反应伴随能量变化 B、NaHCO3溶液中既有的转换关系又有的转换关系 C、温度升高,纯水中的与均增大 D、绝大多数的化学反应是有限度的,限度越低的反应,化学反应速率越大
-
16、近年来我国科技发展迅速,创新指数排名飙升,下列关于我国新科技的叙述不正确的是( )A、中国空间站使用的砷化镓薄膜光电池,光电池是将化学能转化为电能 B、高铁机车用于导电的受电弓板是碳系新材料,利用石墨导电性、有润滑感性能 C、运载火箭使用了煤油液氧推进剂,火箭推进所需能量来自化学能 D、在汽油燃油车上安装三元催化转换器,可加快尾气中有害气体去除速率
-
17、化学与生活、生产、社会息息相关。下列说法错误的是( )A、冬天应将面团置于温热处发酵 B、蔗糖溶于水是熵减小的过程 C、工业生产中,适当增大廉价的反应物的浓度有利于降低生产成本 D、“冰,水为之,而寒于水”说明等质量的水和冰相比,冰的能量更低
-
18、回答下列问题:(1)、在常温条件下,某密闭容器中含有由3.4gH2和O2组成的混合气体,共含有0.4mol原子。
①该混合气体的平均摩尔质量为。
②混合气体中H2的分子数约为个,H2和O2质量比为。
(2)、12.4gNa2X中含Na+0.4mol,X的相对原子质量是。(3)、在催化剂的作用下,NH3和NO2发生反应生成N2和H2O,每生成7molN2转移电子的物质的量为。 -
19、某化学兴趣小组利用高锰酸钾和浓盐酸反应制取氯气(如图5),并探究氯水的性质。
 (1)、若要制备纯净干燥的Cl2 , 按气流方向连接各仪器接口,顺序为a→→→→→→→d。(2)、写出装置A中反应的化学方程式: , 该反应中盐酸起的作用是。(3)、若将A、B、C相连,制得Cl2后加入适量水,即可制得氯水。将所得氯水分装在两个试管中,进行甲、乙两个实验。
(1)、若要制备纯净干燥的Cl2 , 按气流方向连接各仪器接口,顺序为a→→→→→→→d。(2)、写出装置A中反应的化学方程式: , 该反应中盐酸起的作用是。(3)、若将A、B、C相连,制得Cl2后加入适量水,即可制得氯水。将所得氯水分装在两个试管中,进行甲、乙两个实验。实验甲:甲同学用强光照射其中一个试管中的氯水,同时使用数据采集器采集数据如图6:
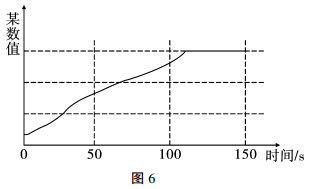
甲同学采集的数据是 (填序号)。
a.氯水的pH随时间的变化
b.溶液中氯离子浓度随时间的变化
c.液面上方氧气体积分数随时间的变化
实验乙:乙同学在另一试管的氯水中加入碳酸氢钠粉末,有无色气泡产生,乙指出氯气与水反应的产物具有酸性,甲同学认为不合理,原因是。
(4)、由于用氯气对饮用水消毒,会使水中的有机物发生氯化,生成有机含氯化合物对人体有害,世界环保联盟即将全面禁止这种消毒方法。建议采用广谱性具有强氧化性的高效消毒剂二氧化氯(ClO2)。我国广泛采用将经干燥空气稀释的氯气通入填有固体氯酸钠(NaClO3)的柱内制得ClO2和另一种漂白物质,表示这一反应的化学方程式是。ClO2为高效低毒的消毒剂,其消毒的效率(以单位质量得到电子数表示)是Cl2的倍(结果保留小数点后两位)。(5)、ClO2在处理含有Mn2+废水时,ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl- , 该反应过程中氧化剂与还原剂的物质的量之比为。 -
20、过氧化钙(CaO2)广泛应用于水产养殖、污水处理,是优良的供氧剂。为了测定CaO2的含量,具体的操作:把样品中的过氧化钙转化为碳酸钙,通过测定碳酸钙沉淀的质量,根据钙元素守恒,求得过氧化钙的质量,具体流程如图4:
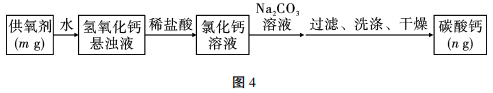 (1)、在流程中过氧化钙(CaO2)与水反应的化学方程式为。(2)、滴加Na2CO3溶液要过量的原因是。(3)、检验沉淀已经洗涤干净的方法是。(4)、若供氧剂的质量m=5g,碳酸钙质量n=6g,请通过计算得出供氧剂中的过氧化钙含量的质量分数为%。(5)、若CaCO3沉淀过滤后不洗涤,则过氧化钙的含量将 (填“偏大”“偏小”或“无影响”)。
(1)、在流程中过氧化钙(CaO2)与水反应的化学方程式为。(2)、滴加Na2CO3溶液要过量的原因是。(3)、检验沉淀已经洗涤干净的方法是。(4)、若供氧剂的质量m=5g,碳酸钙质量n=6g,请通过计算得出供氧剂中的过氧化钙含量的质量分数为%。(5)、若CaCO3沉淀过滤后不洗涤,则过氧化钙的含量将 (填“偏大”“偏小”或“无影响”)。