相关试卷
-
1、K2FeO4是一种高效多功能的新型消毒剂。一种制备K2FeO4的方法如图。
 (1)、生成的电极反应式:。(2)、KOH浓度大小判断:溶液1 溶液2。(填“>”、“=”或“<”)(3)、电解1.5h后,测得η(K2FeO4)=40%,S(K2FeO4)=60%。
(1)、生成的电极反应式:。(2)、KOH浓度大小判断:溶液1 溶液2。(填“>”、“=”或“<”)(3)、电解1.5h后,测得η(K2FeO4)=40%,S(K2FeO4)=60%。已知:
①S(K2FeO4)=60%,说明除K2FeO4之外,还有其他含铁物质生成。经检验,阳极产物中含铁物质仅有K2FeO4和FeOOH,则η(FeOOH)=(保留整数)。(提示:可假定电解过程中Fe消耗10mol)
②判断阳极有水(或OH﹣)放电,判断依据:
ⅰ.水(或OH﹣)有还原性;
ⅱ. 。
③电解过程中使用探测自由基的仪器可以追踪到羟基自由基(•OH)等微粒,羟基自由基是一种中性微粒。
-
2、电化学手段对于研究物质性质以及工业生产中都有重要价值。(1)、Ⅰ.某实验小组利用原电池装置(图1)对FeCl3与Na2SO3的反应进行探究。
取少量左侧电极附近的溶液于试管内,加入铁氰化钾溶液,产生蓝色沉淀。 (2)、检验右侧电极产物的操作及现象是 。(3)、发生氧化反应的电极反应式为 。(4)、Ⅱ.工业上用Na2SO4溶液吸收工业烟气中的低浓度SO2形成吸收液后,再采用阳离子膜电解法,控制电压2。工作原理示意图如图2,阴极区和阳极区的pH随时间的变化关系如图2:
(2)、检验右侧电极产物的操作及现象是 。(3)、发生氧化反应的电极反应式为 。(4)、Ⅱ.工业上用Na2SO4溶液吸收工业烟气中的低浓度SO2形成吸收液后,再采用阳离子膜电解法,控制电压2。工作原理示意图如图2,阴极区和阳极区的pH随时间的变化关系如图2:已知:ⅰ.硫不具有导电能力。
ⅱ.一般地,在溶液中放电速率大于迁移速率。
a处连接电源的 。(填入“正极”或“负极”)(5)、结合电极反应式,说明阳极区pH有所降低的原因:。(6)、通电一段时间后,合金电极需要更换的原因是 。 -
3、在国家“双碳”战略目标的背景下,如何实现碳资源有效利用,成为研究前沿问题。(1)、一碳化学的研究为实际转化提供理论依据和指导。其中关于CO2的催化氢化涉及到的热化学反应方程式如下:
已知:CO2(g)+H2(g)⇌H2O(g)+CO(g) ΔH1=+41.1kJ⋅mol﹣1
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH2=﹣48.9kJ⋅mol﹣1
CO的催化氢化对应的热化学方程式为 。
(2)、L、M可分别表示温度或压强,进行CO的催化氢化时,根据检测数据绘制CO的平衡转化率关系如图所示:
①L为 。
②比较M1和M2的大小,并解释做出判断的原因:。
(3)、工业上生产新能源二甲醚(CH3OCH3)的制备原理之一为:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g)。
①相同温度下,在两个容器中进行上述反应,某时刻测得各组分浓度及容器内反应状态如下表汇总(表中所以数据均为mol/L)
容器
c(CO2)
c(H2)
c(CH3OCH3)
c(H2O)
反应状态
Ⅰ
1.0×10﹣2
1.0×10﹣2
1.0×10﹣4
1.0×10﹣4
达到平衡
Ⅱ
2.0×10﹣2
1.0×10﹣2
1.0×10﹣4
2.0×10﹣4
填写表中空白处反应状态:。(填“正向进行”、“达到平衡”或“逆向进行”),结合必要数据写出判断过程:。
②二甲醚(CH3OCH3)中O为﹣2价,二甲醚可被设计为空气燃料电池,如图所示。写出酸性环境下负极的电极反应式 。
-
4、合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)⇌2NH3(g) ΔH=﹣92kJ/mol
据此回答以下问题:
(1)、该反应的化学平衡常数表达式为K=。(2)、根据温度对化学平衡的影响规律可知,随外界温度升高,该化学平衡常数的值 。(填“增大”、“减小”或“不变”)(3)、控制在一定温度下,若把10molN2与30molH2置于体积为10L的密闭容器内,反应达到平衡状态时,测得混合气体总物质的量变为初始时的。则平衡时氢气的转化率α=(用百分数表示)。
能说明该反应达到化学平衡状态的是 (填字母)。
a.容器内的密度保持不变
b.容器内压强保持不变
c.容器内c(NH3)不变
(4)、可采取电解法在常温常压下合成氨,原理如图所示:①阴极生成氨的电极反应式为 。
②阳极氧化产物只有O2。电解时实际生成的NH3的总量远远小于由O2理论计算所得NH3的量,结合电极反应式解释原因:。

-
5、丁烯(C4H8)是一种重要的化工原料,可由丁烷催化脱氢制备:C4H10(g)⇌C4H8(g)+H2(g) ΔH。该反应平衡转化率、反应温度及压强的关系如图,下列说法正确的是( )
 A、若充入10mol丁烯,则K(470℃)= B、压强p1<P2 , 平衡常数随压强增大而减小 C、ΔH>0,此反应在相对高温时可自发进行 D、使用催化剂降低反应所需活化能,使平衡正向移动
A、若充入10mol丁烯,则K(470℃)= B、压强p1<P2 , 平衡常数随压强增大而减小 C、ΔH>0,此反应在相对高温时可自发进行 D、使用催化剂降低反应所需活化能,使平衡正向移动 -
6、为探究浓度对化学平衡的影响,某同学进行如下实验:

已知:ⅰ中发生的化学反应为:FeCl3+3KSCN⇌Fe(SCN)3+3KCl
下列说法不正确的是( )
A、若ⅰ中加入KSCN溶液的体积改为2mL,不具有说服力,无法达到实验目的 B、观察到现象a比现象b中红色更深,即可证明增加反应物浓度,平衡正向移动 C、进行ⅱ、ⅲ对比实验的主要目的是防止由于溶液体积变化引起各离子浓度变化而干扰实验结论得出 D、若将ⅱ中加入试剂更换为3滴1mol/LKCl溶液,记为现象c,则平衡逆向移动,现象c比现象b红色更浅 -
7、一定温度下,反应I2(g)+H2(g)⇌2HI(g)在密闭容器中达到平衡时,测得c(I2)=0.11mmol•L﹣1 , c(H2)=0.11mmol•L﹣1 , c(HI)=0.78mmol•L﹣1。相同温度下,按下列4组初始浓度进行实验,反应逆向进行的是( )
A
B
C
D
c(I2)/mmol•L﹣1
1.00
0.22
0.44
0.11
c(H2)/mmol•L﹣1
1.00
0.22
0.44
0.44
c(HI)/mmol•L﹣1
1.00
1.56
4.00
1.56
(注:1mmol•L﹣1=10﹣3mol•L﹣1)
A、A B、B C、C D、D -
8、氢氧化锂是制取锂和锂的化合物的原料,用电解法制备氢氧化锂的工作原理如图所示:
下列说法不正确的是( )
 A、b极附近溶液的pH增大 B、a极发生的反应为2H2O﹣4e﹣═O2↑+4H+ C、该法制备LiOH同时还可得到硫酸和氢气等产品 D、当电路中通过0.2mole﹣ , 两极共收集到4.48L气体(标准状况下)
A、b极附近溶液的pH增大 B、a极发生的反应为2H2O﹣4e﹣═O2↑+4H+ C、该法制备LiOH同时还可得到硫酸和氢气等产品 D、当电路中通过0.2mole﹣ , 两极共收集到4.48L气体(标准状况下) -
9、用下图所示的实验装置,按下列实验设计不能完成的实验是( )
选项
实验目的
实验设计
A
制备金属钠
X为石墨棒,水溶液含Na+、Cl﹣ , 开关K置于A处
B
减缓铁的腐蚀
X为锌棒,水溶液含Na+、Cl﹣ , 开关K置于B处
C
在铁棒上镀铜
X为铜棒,水溶液含Cu2+、SO42- , 开关K置于A处
D
比较铁和铜的金属活动性强弱
X为铜棒,水溶液含H+、SO42- , 开关K置于B处
 A、A B、B C、C D、D
A、A B、B C、C D、D -
10、利用如图装置进行实验,开始时,a、b两处液面相平,放置一段时间。下列说法不正确的是( )
 A、a管发生吸氧腐蚀,b管发生析氢腐蚀 B、一段时间后,a管液面高于b管液面 C、a处溶液的pH增大,b处溶液的pH减小 D、a、b两处具有相同的电极反应式:Fe﹣2e﹣═Fe2+
A、a管发生吸氧腐蚀,b管发生析氢腐蚀 B、一段时间后,a管液面高于b管液面 C、a处溶液的pH增大,b处溶液的pH减小 D、a、b两处具有相同的电极反应式:Fe﹣2e﹣═Fe2+ -
11、用铁铆钉固定铜板,通常会发生腐蚀,如图所示。下列说法不正确的是( )
 A、铁铆钉做负极发生锈蚀 B、铁失去的电子通过水膜传递给O2 C、铜板的存在会加速铁铆钉腐蚀 D、铁元素变化过程:Fe→Fe2+→Fe(OH)2→Fe(OH)3→Fe2O3•xH2O
A、铁铆钉做负极发生锈蚀 B、铁失去的电子通过水膜传递给O2 C、铜板的存在会加速铁铆钉腐蚀 D、铁元素变化过程:Fe→Fe2+→Fe(OH)2→Fe(OH)3→Fe2O3•xH2O -
12、在一定条件下,将2molSO2与1molO2加入到1L的密闭容器中,发生反应2SO2(g)+O2(g)⇌2SO3(g),充分反应后,测得平衡时SO3的浓度为1mol⋅L﹣1。此条件下平衡常数K为( )A、0.5 B、1 C、2 D、4
-
13、化学反应可视为旧键断裂和新键形成的过程。下表给出常见化学键键能数据:
化学键种类
H﹣H
H﹣N
N≡N
键能(kJ/mol)
436
X
946
根据热化学方程式N2(g)+3H2(g)⇌2NH3(g) ΔH=﹣92kJ⋅mol﹣1 , 计算X值为( )
A、254 B、360 C、391 D、431 -
14、如图为某装置的示意图,下列说法中不正确的是( )
 A、Cu做正极反应物 B、电子从Zn上经导线运动到Cu上 C、盐桥中的阳离子向右侧烧杯中移动 D、该装置实现了氧化反应和还原反应分开进行
A、Cu做正极反应物 B、电子从Zn上经导线运动到Cu上 C、盐桥中的阳离子向右侧烧杯中移动 D、该装置实现了氧化反应和还原反应分开进行 -
15、下列说法中正确的是( )A、S(g)+O2(g)═SO2(g) ΔH1;S(s)+O2(g)═SO2(g) ΔH2;则ΔH1>ΔH2 B、C(s,石墨)═C(s,金刚石) ΔH=+1.9kJ⋅mol﹣1;则处于相同条件的石墨更加稳定 C、吸热反应不一定可自发进行,放热反应一定可自发进行 D、断裂反应物所有化学键的总能量小于形成生成物所有化学键的总能量的为吸热反应
-
16、汽车尾气净化反应之一:2NO(g)+2CO(g)⇌N2(g)+2CO2(g)ΔH=﹣373.4kJ⋅mol﹣1 , 在恒容密闭容器中达到平衡状态,下列措施可以使平衡向正反应方向移动的是( )A、除去二氧化碳 B、减小压强 C、升高温度 D、加入催化剂
-
17、党的二十大报告指出,深入推进环境污染防治;持续深入打好蓝天、碧水、净土保卫战,基本消除重污染天气。下列不利于可持续发展的是( )
A.氢燃料电池车
B.太阳能电池板
C.风能发电
D.燃煤供暖



 A、A B、B C、C D、D
A、A B、B C、C D、D -
18、(1)、 Ⅰ、我国规定生活用水中镉排放的最大允许浓度为0.005 mg/L。处理含镉废水可采用化学沉淀法。试回答下列问题:
磷酸镉[Cd3(PO4)2]沉淀溶解平衡常数的表达式Ksp=。(2)、一定温度下,CdCO3的Ksp=4.0 × 10-12 , CdS的Ksp=7.9 × 10-27 , 欲将某含镉废水中的Cd2+沉淀下来,最好选用(填“Na2CO3”或“Na2S”)(3)、若往某含镉废水中加入Na2S,当S2-浓度达到7.9 × 10-8 mol·L-1时,水体中Cd2+ 浓度为mol·L-1(已知:Ksp(CdS)=7.9 × 10-27 , Cd的相对原子质量为112);此时是否符合水源标准?(填“是”或“否”)。(4)、Ⅱ、炼锌烟尘(主要成分为ZnO,含少量CuO和FeO)为原料,可以制取氯化锌和金属锌。制取氯化锌主要工艺如下:
下表列出了相关金属离子生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
加入H2O2溶液的作用是。金属离子
Fe3+
Zn2+
Fe2+
开始沉淀的pH
1.1
5.2
5.8
沉淀完全的pH
3.2
6.4
8.8
(5)、流程图中,调节pH时,加入的试剂X可以是(填序号)A、ZnO B、NaOH C、Zn2(OH)2CO3 D、ZnSO4
pH应调整到。
-
19、(1)、I、在 298 K,100 kPa 时,已知:C(s,石墨)的燃烧热为393.5 kJ·mol-1 , H2(g)的燃烧热为285.8 kJ·mol-1 , C2H2(g)的燃烧热为 1299.5 kJ·mol-1。
则 2C(s,石墨) +H2(g) ⇋ C2H2(g) ΔH =kJ·mol-1。
(2)、在2 L的恒温容器中加入240 g石墨和足量氢气发生反应:2C(s,石墨)+H2(g) ⇋ C2H2 (g) 。若5 min达到平衡时石墨的质量为90 g,
则v (H2) = mol·L -1·min-1。
(3)、Ⅱ、在密闭容器中加入1 mol X和3 mol Y发生反应:X(g)+3Y(g) ⇋4Z(g) ΔH <0,回答下列问题:
若该反应在恒温恒容条件下进行:①初始时充入惰性气体,化学反应速率会(填“增大”“减小”或“不变”)。
②平衡时产生1.2 mol 物质 Z,则 X 的转化率α(X) = 。
(4)、若该反应在绝热恒容条件下进行:①相同时间内生成 Z 的量比恒温恒容时多,原因是。
②当气体压强不再变化时,该反应(填“是”或“否”)达到平衡状态。
(5)、Ⅲ、CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3。
①俗称纯碱,因水解而使其水溶液呈碱性,写出第一步水解的离子方程式②已知:25℃时,Ka1(H2CO3)=4.5×10-7 , Ka2(H2CO3)=4.7×10-11 , 当Na2CO3溶液的pH为11时,溶液中的c (HCO3-):c(CO32- ) =
-
20、 甲醇是重要的化学工业基础原料和清洁液体燃料。现在工业上合成甲醇几乎全部采用或CO2加压催化加氢的方法,工艺过程包括造气、合成净化、甲醇合成和粗甲醇精馏等工序。
已知甲醇制备的有关化学反应以及不同温度下的化学平衡常数如下表所示:
化学反应
平衡常数
温度/℃
500
800
①
2.5
0.15
②
1.0
2.50
③
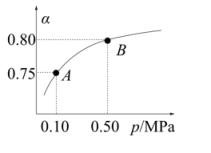
(1)、反应②是(填“吸热”或“放热”)(2)、某温度下反应①中H2的平衡转化率(α)与体系总压强(p)的关系如右图所示,则平衡状态由A变到B时,平衡常数K(A)K(B)(填“>”、“<”或“=”)。根据反应①和②可推导K1、K2与K3之间的关系,则K3 =(用K1、K2表示)
 (3)、在3L容积可变的密闭容器中仅发生反应②,已知c(CO)与反应时间t的变化曲线I如右图所示,若在t0时刻分别改变一个条件,则曲线Ⅰ可变为曲线Ⅱ和曲线Ⅲ。当曲线I变为曲线Ⅱ时,改变的条件是。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是。
(3)、在3L容积可变的密闭容器中仅发生反应②,已知c(CO)与反应时间t的变化曲线I如右图所示,若在t0时刻分别改变一个条件,则曲线Ⅰ可变为曲线Ⅱ和曲线Ⅲ。当曲线I变为曲线Ⅱ时,改变的条件是。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是。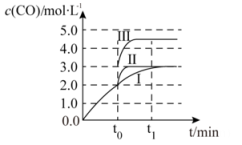 (4)、一定条件下将(g)和(g)以体积比3∶1置于恒温恒容的密闭容器发生反应③,下列能说明该反应达到平衡状态的有____A、体系密度保持不变 B、和的体积比保持不变 C、混合气体的平均相对分子量不变时,反应一定达到平衡状态 D、当破坏中2个碳氧双键,同时破坏中的2个氧氢键,反应一定达到平衡状态(5)、一定条件下,甲醇与一氧化碳反应可以合成醋酸。通常状况下,将a mol·L-1的醋酸与b mol·L-1 Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)= c (CH3COO- ),用含a和b的代数式表示该混合溶液中醋酸的电离常数为。
(4)、一定条件下将(g)和(g)以体积比3∶1置于恒温恒容的密闭容器发生反应③,下列能说明该反应达到平衡状态的有____A、体系密度保持不变 B、和的体积比保持不变 C、混合气体的平均相对分子量不变时,反应一定达到平衡状态 D、当破坏中2个碳氧双键,同时破坏中的2个氧氢键,反应一定达到平衡状态(5)、一定条件下,甲醇与一氧化碳反应可以合成醋酸。通常状况下,将a mol·L-1的醋酸与b mol·L-1 Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)= c (CH3COO- ),用含a和b的代数式表示该混合溶液中醋酸的电离常数为。