相关试卷
-
1、下列说法正确的是( )A、和充分反应后和数目之比为 B、同温同压条件下,和密度之比为 C、同温同压条件下,含原子数相等的、、体积比为 D、同温同压条件下,质量相等的和 , 体积比为
-
2、常温下,向溶液中加少量溶液,反应原理如图所示,下列说法错误的是( )
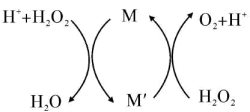 A、生产过程要严格避免混入 B、在整个过程中作催化剂 C、当反应中有生成时,转移电子数为 D、该反应过程中,是 , 是
A、生产过程要严格避免混入 B、在整个过程中作催化剂 C、当反应中有生成时,转移电子数为 D、该反应过程中,是 , 是 -
3、有关反应①;②。下列说法正确的是( )A、②中只是氧化产物 B、①中水发生氧化反应,②中水发生还原反应 C、中阴、阳离子个数比为 D、当反应①和②中转移的电子数相同时,产生的和的物质的量相同
-
4、电导率传感器可辅助探究复分解反应的实质。相同体积的溶液中,离子数目越多,离子所带电荷数越多,电导率越大,溶液导电性越强。将含有酚酞的溶液平均分成两份并置于两个烧杯中,插入电导率传感器,往其中一份滴加稀硫酸,往另一份滴加硫酸钠溶液,滴加过程中,这两份溶液的滴加速率始终相同,测得溶液的电导率变化如图所示。下列说法错误的是( )
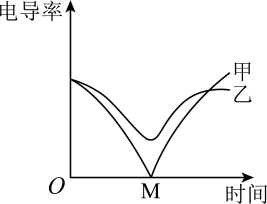 A、甲曲线对应氢氧化钡与硫酸的反应 B、甲曲线电导率减小过程中,溶液由红色变为无色 C、乙曲线对应的反应中四种离子数目都减少 D、乙曲线电导率减小过程中的反应:
A、甲曲线对应氢氧化钡与硫酸的反应 B、甲曲线电导率减小过程中,溶液由红色变为无色 C、乙曲线对应的反应中四种离子数目都减少 D、乙曲线电导率减小过程中的反应: -
5、为阿伏加德罗常数的值,下列说法正确的是( )A、中含有氧原子数为 B、(标准状况)氯气所含的质子数为 C、溶液中含有的数为 D、将加入足量沸水,继续煮沸制得胶体,其中所含胶体粒子数目为
-
6、2023年诺贝尔化学奖授予三位在美工作的科学家,以表彰他们为“发现和合成量子点”作出的贡献。量子点尺寸通常在纳米级别,下列分散质粒子直径在纳米的是( )A、淀粉溶液 B、饱和溶液 C、油水混合物 D、石灰乳
-
7、能正确表示下列化学反应的离子方程式的是( )A、铜与稀盐酸反应: B、将碳酸氢钙溶液与过量的澄清石灰水混合: C、氢氧化钡溶液与稀硫酸的反应: D、醋酸滴在碳酸镁上:
-
8、下列各选项中,不能满足如图一步关系的选项是( )
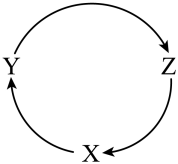 A、X为一氧化碳、Y为二氧化碳、Z为碳酸钠 B、X为氢氧化钠、Y为碳酸氢钠、Z为碳酸钠 C、X为碳酸钙、Y氧化钙、Z为氢氧化钙 D、X为氯化镁、Y为氢氧化镁、Z为氧化镁
A、X为一氧化碳、Y为二氧化碳、Z为碳酸钠 B、X为氢氧化钠、Y为碳酸氢钠、Z为碳酸钠 C、X为碳酸钙、Y氧化钙、Z为氢氧化钙 D、X为氯化镁、Y为氢氧化镁、Z为氧化镁 -
9、下列操作中,不会影响溶液中、、、、、等离子大量共存的是( )A、加入 B、通入 C、通入 D、加入粉
-
10、在生产生活和化学实验中,具有安全意识是重要的科学素养。下列叙述合理的是( )A、铁在氯气中点燃时剧烈反应,所以液氯不能用钢瓶储存 B、“84”消毒液与洁厕灵一起使用,能增强消毒效果 C、在容量瓶中直接溶解药品 D、闻氯气时,用手轻轻扇动,使少量气体飘进鼻孔
-
11、下列说法正确的是( )A、和是同素异形体 B、丁达尔效应是胶体粒子对光折射形成的,是一种物理现象 C、加碘盐、胆矾、液氯、盐酸均为混合物 D、雾和䨪是气溶胶,PM2.5被认为是造成雾霾天气的“元凶”
-
12、下列物质属于非电解质的是( )A、氯水 B、 C、 D、
-
13、第19届亚运会于2023年9月23日至10月8日在浙江杭州举行,共有45个亚洲国家和地区参赛。下列有关说法错误的是( )




亚运会火炬,名为“薪火”,寓意中华文明薪火相传,点燃时发生了剧烈的氧化还原反应
开幕式上依靠着高光源LED镜头在光线暗淡的空间投影展示的“数字烟花”,没有硝烟,不产生垃圾,不涉及化学反应,传递了绿色环保理念
亚运会的游泳池可以用漂粉精消毒
亚运会期间恰逢中秋佳节,月饼保质期不长,商家常在包装袋内加入生石灰防止月饼氧化变质
A
B
C
D
A、A B、B C、C D、D -
14、化工原料异丁烯()可由异丁烷()直接催化脱氢制备:(1)、异丁烯中,C原子的杂化方式为;脱氢过程中,C-C-C键角(填“变大”、“不变”或“变小”)(2)、该反应的化学平衡常数的表达式为。(3)、将一定量的异丁烷充入容积恒定的密闭反应装置,维持温度不变进行反应,判断该反应达到化学平衡状态的标志有。
a.容器内气体压强不再变化
b.容器内气体密度不再变化
c.容器内不再变化
d.异丁烷的消耗速率等于消耗速率的2倍
(4)、一定条件下,以异丁烷为原料生产异丁烯。温度、压强改变对异丁烷平衡转化率的影响如图所示。
①判断、的大小关系:(填“>”或“<”) , 理由是。
②若异丁烷的平衡转化率为40%,则平衡混合气中异丁烯的物质的量分数最多为%(保留小数点后1位)。
(5)、目前,异丁烷催化脱氢制备异丁烯的研究热点是催化活性组分以及载体的选择。下表是以V-Fe-K-O为催化活性物质,反应时间相同时,测得的不同温度、不同载体条件下的数据。温度/℃
570
580
590
600
610
以为载体
异丁烷转化率/%
36.41
36.49
38.42
39.23
42.48
异丁烯收率/%
26.17
27.11
27.51
26.56
26.22
以为载体
异丁烷转化率/%
30.23
30.87
32.23
33.63
33.92
异丁烯收率%
25.88
27.39
28.23
28.81
29.30
说明:收率=(生产目标产物的原料量/原料的进料量)×100%
①由上表数据,可以得到的结论是(填字母序号)。
a.载体会影响催化剂的活性
b.载体会影响催化剂的选择性
c.载体会影响化学平衡常数
②分析以为载体时异丁烯收率随温度变化的可能原因:。
-
15、(1)、Ⅰ.碳酸及碳酸盐与自然界碳的循环有着密切的联系。为了维持正常的生理活动,人体各种体液的pH都要保持在一个较小的pH变化范围。血液的正常pH范围是7.35~7.45.当血浆pH低于7.2会引起酸中毒,高于7.5会引起碱中毒。血浆“”缓冲体系对稳定体系酸碱度有重要作用。该缓冲体系存在如下平衡:
①向缓冲体系加入少量强碱时,上述平衡移动(填“正向”、“逆向”、“不移动”)②当大量酸进入到缓冲体系时,体系中将(填“变大”、“变小”或者“不变”)
③若某温度下的 , 当血浆中时,人体发生(填“酸”或“碱”)中毒。
(2)、Ⅱ.雌黄( )和雄黄()都是自然界中常见的砷化合物,早期曾用作绘画颜料,因都有抗病毒疗效而入药。
可转化为用于治疗白血病的亚砷酸()。亚砷酸在溶液中存在多种微粒形态,各种微粒的物质的量分数与溶液pH关系如图(a)所示。
①人体血液的pH为7.35~7.45,用药后人体中含砷元素的主要微粒是。
②将KOH溶液滴入亚砷酸溶液,当pH调至11时,所发生反应的离子方程式是。
③下列说法中,正确的是(填字母序号)。
a.当时,溶液呈碱性
b.pH=12时,溶液中
c.在溶液中,
(3)、工业含砷(Ⅲ)废水常用铁盐处理后排放。其原理是:铁盐混凝剂在溶液中产生胶粒,其表面带有正电荷,可吸附含砷化合物。测得不同pH条件下铁盐对含砷(Ⅲ)化合物的去除率,如图(b)所示。pH为5~9时,随溶液pH增大,铁盐混凝剂对含砷(Ⅲ)化合物的吸附效果增强。结合图(a)和图(b),解释可能的原因:。
-
16、I.是一种常见的酸, , 可以形成多种醋酸盐。回答下列问题:(1)、在室温下,醋酸钠溶液的约为。(2)、在室温下,若下列溶液的物质的量浓度相同:① ② ③ ④ , 则从大到小的顺序为。(3)、在室温下,等物质的量浓度的与以体积比混合,混合后溶液的 , 求(写出计算结果的表达式)。(4)、冰醋酸中加入一定量的水,可以得到各种不同浓度的醋酸溶液。在下方坐标系中画出随着水的加入量增加,的变化曲线。

II.已知次磷酸是一种一元弱酸;电离平衡常数。
(5)、写出次磷酸与足量反应的离子方程式。(6)、下列说法正确的是____(填字母)。A、导电能力 B、溶液中加入小苏打,可以看到气泡 C、溶液中的离子种类比溶液中的离子种类多 D、常温下,溶液的比溶液的小 -
17、水是极弱的电解质,改变温度或加入某些电解质会影响水的电离。请回答下列问题。(1)、若纯水在100℃时 , 该温度下溶液的。(2)、25℃时,向水中加入少量碳酸钠固体,得到为11的溶液,碳酸钠水解的离子方程式为 , 由水电离出的。(3)、体积均为、均为2的盐酸与一元酸 , 加水稀释过程中与溶液体积的关系如图所示,则是(填“强酸”或“弱酸”),理由是。
 (4)、电离平衡常数是衡量弱电解质电离强弱的物理量。已知:
(4)、电离平衡常数是衡量弱电解质电离强弱的物理量。已知:化学式
电离常数()
①25℃时,等浓度的溶液、溶液和溶液,其溶液的由大到小的顺序为。
②25℃时,在的醋酸溶液中由醋酸电离出的约是由水电离出的的倍。
-
18、T℃时,向容积为2L的刚性容器中充入1 mol CO2和一定量的H2发生反应:CO2(g)+2H2(g) HCHO(g) +H2O(g) ,达到平衡时,HCHO的分压(分压=总压×物质的量分数)与起始的关系如图所示。已知:初始加入2molH2时,容器内混合气体的总压强为1.2p kPa。下列说法不正确的是( )
 A、5 min时反应到达c点,ν(H2)=0.1 mol·L-1·min-1 B、随增大, HCHO(g)的平衡压强不断增大 C、b点时反应的平衡常数Kp = D、由图象可得到:Kp(a)Kp(b)Kp(c)
A、5 min时反应到达c点,ν(H2)=0.1 mol·L-1·min-1 B、随增大, HCHO(g)的平衡压强不断增大 C、b点时反应的平衡常数Kp = D、由图象可得到:Kp(a)Kp(b)Kp(c) -
19、室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项
实验操作和现象
结论
A
室温下,向0.1mol/LNaHCO3溶液中滴加几滴酚酞溶液,溶液变为浅红色
的水解程度大于的电离程度
B
将浓硫酸与无水乙醇混合,加热至 , 产生的气体通入酸性溶液中,高锰酸钾溶液褪色
乙烯气体被酸性溶液氧化
C
向溶液中滴加几滴稀硫酸,未看到明显现象象
与硫酸不反应
D
向两支盛有等体积等浓度溶液的试管中,分别滴入2滴等浓度的NaCl和NaI溶液,一支试管中产生黄色沉淀,另一支中无明显现
A、A B、B C、C D、D -
20、下列说法正确的是( )A、反应达平衡后,降低温度,正反应速率增大、逆反应速率减小 B、合成氨生产中将NH3液化分离,可加快正反应速率,提高H2的转化率 C、工业生产硫酸时,接触室催化氧化SO2时使用热交换器可以充分利用热量,降低生产成本 D、探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL5%H2O2和1mLH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象