相关试卷
-
1、目前,常利用催化技术将汽车尾气中的和转化成和 . 为研究如何增大该化学反应的速率,某课题组设计了以下三组实验探究温度、催化剂的比表面积对反应的影响.
编号
催化剂的比表面积
Ⅰ
280
80.0
Ⅱ
120
Ⅲ
360
80.0
实验测得三组实验中的浓度随时间的变化如下图所示.下列有关说法错误的是( )
 A、 B、曲线1对应的实验中,刚刚达到平衡时,的平均反应速率为 C、增大催化剂的比表面积,使化学反应的速率增大,但的转化率不变 D、曲线1、2、3分别代表的实验编号为Ⅱ、Ⅰ、Ⅲ
A、 B、曲线1对应的实验中,刚刚达到平衡时,的平均反应速率为 C、增大催化剂的比表面积,使化学反应的速率增大,但的转化率不变 D、曲线1、2、3分别代表的实验编号为Ⅱ、Ⅰ、Ⅲ -
2、下列有关实验操作、现象和结论都正确的有( )项.
编号
实验操作
现象
结论
①
常温时,向两支盛有溶液的试管中分别加入,的溶液和的溶液
后者产生气泡又快又多
催化效果更好
②
常温时,同时向体积均为的和酸性溶液中各加入溶液
后者先褪色
反应物浓度越大,反应速率越快
③
向和的草酸溶液中同时滴加3滴酸性高锰酸钾溶液
前者褪色快
反应物温度越高,反应速率越大
④
常温时,同时向同体积和的溶液中各加入2mL的盐酸
无明显现象
无法作为判断速率快慢的依据
A、1 B、2 C、3 D、4 -
3、酸碱中和滴定是一种重要的实验方法,需要用到酸式滴定管和碱式滴定管,下列有关滴定管的判断、使用或操作有误的是( )
A
B
C
D




酸式滴定管
酸式/碱式滴定管
碱式滴定管
酸式滴定管
涂抹凡士林在图中旋塞的a端和旋塞套内的c端,防止漏水
正确读取滴定管的读数为
排出滴定管尖嘴中的气泡
用标准浓度的酸性溶液测定溶液中的含量
A、A B、B C、C D、D -
4、一定条件下,发生分解反应: , 其分解过渡态示意图如下,下列说法不正确的是( )
 A、该反应的活化能为 B、该反应的决速步骤为: C、该反应的 D、键的键能大于
A、该反应的活化能为 B、该反应的决速步骤为: C、该反应的 D、键的键能大于 -
5、为了维持人体正常的生理活动,血液需保持一个较小的pH变化范围(7.35~7.45),血浆中缓冲体系对稳定酸碱度起到重要作用,缓冲原理为: . 一定物质的量浓度的下列物质不能构成缓冲体系的是( )A、 B、 C、 D、氨水
-
6、分解反应中分子碰撞示意图如下,其中可以表示分子有效碰撞的是( )A、
 B、
B、 C、
C、 D、
D、
-
7、下列有关试纸和计的说法中错误的是( )
 A、pH试纸是将试纸用多种酸碱指示剂的混合溶液浸透,再经高温烘干制成的 B、最常用的广泛pH试纸的pH范围是1~14,可以识别的pH误差约为1 C、精密pH试纸的pH范围较窄,可以判别0.2或0.3的pH差 D、pH计又叫酸度计,可以用来精密测量溶液的pH
A、pH试纸是将试纸用多种酸碱指示剂的混合溶液浸透,再经高温烘干制成的 B、最常用的广泛pH试纸的pH范围是1~14,可以识别的pH误差约为1 C、精密pH试纸的pH范围较窄,可以判别0.2或0.3的pH差 D、pH计又叫酸度计,可以用来精密测量溶液的pH -
8、化学与生产、生活和科技息息相关,下列说法错误的是( )A、火箭推动剂的发展历史是从古代的火药到液体推进剂、固体推进剂,再到现如今的高能推进剂和绿色推进剂. B、燃油汽车上的三元催化器中的催化剂提高了反应物中活化分子百分数,加快了反应速率,进而提高了有害物质的转化率,减少了污染物的排放. C、飞秒化学是采用的时间分辨技术跟踪监测化学反应中寿命极短的中间体或过渡态的技术. D、我国科学家研制出新型催化剂,将合成氨的温度和压强分别降到了 , 在节能减排方面取得重大突破.
-
9、经检测,某化工厂排出的废水呈酸性,且其中含有大量。回答下列问题:(1)、下列离子中,能大量存在于该废水中的是____(填字母)。A、 B、 C、 D、(2)、取该废水于烧杯中,向烧杯中逐滴加入溶液至溶液呈碱性,此过程中,原废水中存在的离子的量会发生变化的是、(用离子符号表示)。(3)、某化学社团小组成员欲除去废水样品中的和 , 最终得到中性溶液,设计的方案流程如图所示。
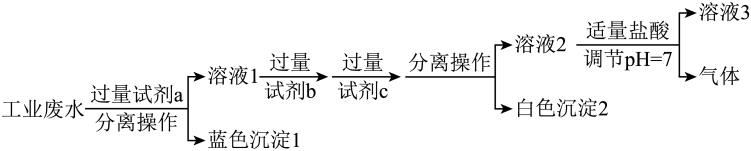
①试剂a、c分别为、(写化学式);“溶液3”所含的溶质离子有、(写离子符号)。
②“分离操作”的名称是。
③向“白色沉淀2”中加入足量盐酸,发生反应的离子方程式为。
-
10、下图是一些单质及其化合物之间的转化关系图。常温常压下,D、F、K均为无色无刺激性气味的气体,B是最常见的无色液体,A是由单质C在D中燃烧生成的淡黄色固体。(反应中生成的部分物质已略去)
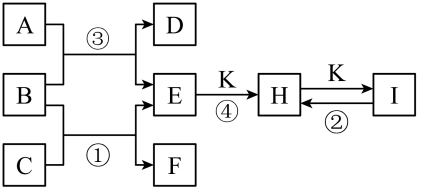
回答下列问题:
(1)、物质A、I的化学式为、。(2)、单质C的实验室保存方法是。(3)、反应③的化学方程式为。(4)、写出反应①的化学方程式并用双线桥法表示电子转移的方向和数目: , 该反应中氧化剂与还原剂质量之比为。(5)、反应④的化学方程式为。 -
11、“分类研究”是重要的学习与科研方法。现有下列9种物质:①HCl气体;②NaCl固体;③;④蔗糖;⑤固体;⑥熔融;⑦氢氧化铁胶体;⑧硫酸溶液;⑨铜。回答下列问题:(1)、上述物质中属于电解质的有 , 能导电的纯净物有。(填序号)(2)、NaCl溶于水的电离方程式为。(3)、上述9种物质中有两种物质在水溶液中发生反应的离子方程式为 , 则该反应的化学方程式为。(4)、溶液与足量的溶液反应的离子方程式为。(5)、实验室制备⑦,需要在沸水中滴加(填化学式)饱和溶液,反应的化学方程式为。
-
12、有一包固体粉末X,可能含有碳酸钙、硫酸铜、硫酸亚铁、镁粉。为确定固体粉末的成分,现取X进行下列实验,实验过程及现象如下图所示(不考虑水、稀盐酸的挥发:碳酸钙与硫酸铜、硫酸亚铁不发生化学反应)。下列说法中正确的是( )
 A、若气体1为纯净物,则原固体X一定不含有碳酸钙 B、若气体1为混合物,则溶液2中可能含有Fe2+、Cu2+、Ca2+ C、若溶液1呈无色,则固体粉末X中不可能含有硫酸铜 D、若溶液2呈浅绿色,则沉淀2一定是纯净物
A、若气体1为纯净物,则原固体X一定不含有碳酸钙 B、若气体1为混合物,则溶液2中可能含有Fe2+、Cu2+、Ca2+ C、若溶液1呈无色,则固体粉末X中不可能含有硫酸铜 D、若溶液2呈浅绿色,则沉淀2一定是纯净物 -
13、把图2中的物质补充到图1中,可得到一个完整的氧化还原型离子方程式(未配平)。

对该氧化还原反应型离子方程式,说法不正确的是( )
A、作氧化剂具有氧化性 B、氧化剂和还原剂的个数之比为 C、若有2个参加反应时则转移电子的个数为10 D、氧化性: -
14、已知: , 实验室制取氯气时,下列实验装置能达到实验目的的是( )A、
 制取
B、
制取
B、 除去中的少量HCl
C、
除去中的少量HCl
C、 干燥
D、
干燥
D、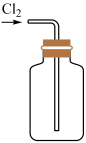 收集
收集
-
15、是一种广谱型的消毒剂,根据世界环保联盟的要求,将逐渐取代成为生产自来水的消毒剂。工业上常用和溶液混合并加酸化后反应制得,在以上反应中氧化剂与还原剂的个数之比为( )A、 B、 C、 D、
-
16、下列化学反应的离子方程式书写正确的是( )A、用小苏打治疗胃酸过多: B、氧化镁与稀盐酸反应: C、氢氧化钡溶液跟硫酸镁反应: D、氢氧化铜和稀盐酸反应:
-
17、下列物质的性质与用途具有对应关系的是( )A、盐酸有挥发性,可用于除铁锈 B、能溶于水,可用于工业制盐酸 C、NaClO具有强氧化性,可用作漂白剂 D、NaOH显碱性,可用作干燥剂
-
18、某同学向一定体积的Ba(OH)2溶液中滴加稀硫酸,测得混合溶液的导电能力随时间的变化如图所示。下列说法中正确的是( )
 A、a时刻Ba(OH)2溶液与稀硫酸没有完全反应 B、AB段溶液的导电能力减弱,说明生成的BaSO4不是电解质 C、BC段溶液的导电能力增大,主要是由于过量的H2SO4电离出的离子导电 D、实验过程中反应的离子方程式为
A、a时刻Ba(OH)2溶液与稀硫酸没有完全反应 B、AB段溶液的导电能力减弱,说明生成的BaSO4不是电解质 C、BC段溶液的导电能力增大,主要是由于过量的H2SO4电离出的离子导电 D、实验过程中反应的离子方程式为 -
19、现有一种固体化合物X不导电,但熔融状态或溶于水导电,下列关于X的说法中,正确的是( )A、X一定为电解质 B、X可能为非电解质 C、X只能是盐类 D、X只能是碱类
-
20、常温下,下列溶液中的微粒能大量共存的是( )A、加入铁产生氢气的溶液: B、的溶液: C、加入硫酸镁的溶液: D、加入氢氧化钠的溶液: