相关试卷
-
1、滴加相同浓度的盐酸或KOH溶液来调节0.01 mol⋅L溶液的pH,实验测得含砷各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与溶液pH的关系如图所示,(类比pH的定义,对于稀溶液可以定义 , 。)下列说法正确的是( )
 A、溶液呈酸性 B、水的电离程度:a点大于c点 C、d点溶液的 D、b点溶液中存在:
A、溶液呈酸性 B、水的电离程度:a点大于c点 C、d点溶液的 D、b点溶液中存在: -
2、一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应生成气体产物,反应中各物质的物质的量变化如图所示。则下列推断合理的是( )
 A、该反应的化学方程式为 B、反应进行到1s时,生成A的速率小于生成B的速率 C、该温度下反应平衡常数为mol/L D、反应达到平衡后,向容器中加入等物质的量的B和C,达到新平衡B的转化率增大
A、该反应的化学方程式为 B、反应进行到1s时,生成A的速率小于生成B的速率 C、该温度下反应平衡常数为mol/L D、反应达到平衡后,向容器中加入等物质的量的B和C,达到新平衡B的转化率增大 -
3、1 mol HCOOH在Pd催化剂表面脱氢的反应历程与能量的关系如图所示,下列说法正确的( )
 A、反应历程用DCOOH代替HCOOH,得到的产物可能有HD和 B、Pd催化剂可以加快反应速率,降低反应的活化能,但不参与反应 C、历程中决速步骤的活化能为80.3 kJ/mol D、以上反应历程涉及极性键和非极性键的断裂与形成
A、反应历程用DCOOH代替HCOOH,得到的产物可能有HD和 B、Pd催化剂可以加快反应速率,降低反应的活化能,但不参与反应 C、历程中决速步骤的活化能为80.3 kJ/mol D、以上反应历程涉及极性键和非极性键的断裂与形成 -
4、难溶盐可溶于盐酸,常温下,用HCl气体调节:浊液的pH,测得体系中或随的变化如图所示。下列说法正确的是( )
 A、曲线N代表随的变化趋势 B、Y点溶液中存在 C、氢氟酸的 D、难溶盐的溶度积
A、曲线N代表随的变化趋势 B、Y点溶液中存在 C、氢氟酸的 D、难溶盐的溶度积 -
5、常温下,下列指定溶液中一定能大量共存的是( )A、水电离出来的 mol/L的溶液中:、、、 B、的溶液中:、、、 C、澄清透明溶液中:、、、 D、与Al反应能放出的溶液中:、、、
-
6、常温下,下列指定溶液中微粒的浓度关系错误的是( )A、0.1 mol⋅L溶液: B、向NH₄Cl溶液中加入适量氨水,得到碱性溶液中: C、等物质的量浓度的和两份溶液中: D、向溶液中滴加稀盐酸得到中性溶液:
-
7、已知常温时HClO和的电离平衡常数分别为和。现将pH和体积都相同的两种酸溶液分别加蒸馏水稀释,pH随溶液体积的变化如图所示,下列叙述正确的是( )
 A、曲线Ⅱ为稀释时pH变化曲线 B、从b点到d点,溶液中减小(HR代表HClO或) C、b点溶液中水的电离程度比c点溶液中水的电离程度大 D、取a点的两种酸溶液,中和相同体积、相同浓度的NaOH溶液,消耗的体积较小
A、曲线Ⅱ为稀释时pH变化曲线 B、从b点到d点,溶液中减小(HR代表HClO或) C、b点溶液中水的电离程度比c点溶液中水的电离程度大 D、取a点的两种酸溶液,中和相同体积、相同浓度的NaOH溶液,消耗的体积较小 -
8、氨基甲酸铵())是合成尿素的一种中间产物。已知某温度下,向恒容密闭容器中加入a mol , 反应 , 达到平衡。下列叙述中不能表明反应达到平衡状态的是( )A、单位时间内消耗1 mol 同时消耗1 mol B、气体的平均相对分子质量不再改变 C、气体的密度不再改变 D、容器内的压强不再改变
-
9、某小组为了探究影响溶液与溶液在酸性条件下反应速率的因素,设计实验方案如表所示。
实验
/mL( mol/L)
/mL( mol/L)
/mL( mol/L)
/mL( mol/L)
/mL
褪色时间t/min
1
5.0
1.5
1.5
0.0
2.0
8
2
5.0
1.5
2.0
0.0
6
3
6.0
1.5
2.5
0.0
0.0
4
4
4.0
1.5
1.5
0.5
3
下列说法正确的是( )
A、若时,实验1和2的结果说明溶液酸性越强,反应速率越快 B、实验3中的反应速率为0.00375mol/(L·min) C、该反应的离子方程式为 D、若时,实验3和4的结果说明催化剂更有利于改变化学反应速率 -
10、下列有关热化学方程式及其描述正确的是( )A、甲烷的燃烧热为890.3 kJ/mol,则甲烷的燃烧热的热化学方程式为:
kJ/mol
B、500℃,30MPa下,将0.5 mol 和1.5 mol 置于密闭容器中充分反应生成 , 放热19.3kJ,其热化学方程式为: kJ/mol C、已知 ; , 则 D、含20.0 g NaOH的稀溶液与稀硫酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为: kJ/mol -
11、我国科学家开发催化剂(Ru-CdS),实现光催化氧化反应。反应如图所示:

下列说法正确的是( )
A、HMF的分子式为 B、HMF能发生取代反应、氧化反应、加成反应、加聚反应 C、可用酸性溶液鉴别HMF和HMFCA D、HMFCA不能与碳酸钠反应 -
12、设为阿伏加德罗常数的值。下列说法正确的是( )A、1 mol 和中含有的电子数都为 B、78 g 和混合物所含离子数为 C、1 mol 与足量NaOH溶液反应生成的溶液中的数目为 D、1 mol 溶于水所得溶液中数目为
-
13、下列化学用语使用正确的是( )A、的空间填充模型:
 B、含有8个中子的碳原子可表示为:
C、与互为同位素
D、用电子式表示氧化钠的形成过程:
B、含有8个中子的碳原子可表示为:
C、与互为同位素
D、用电子式表示氧化钠的形成过程:
-
14、化学与生活紧密相联,下列说法错误的是( )A、规范使用防腐剂可以减缓食物变质速度,保持食品营养价值 B、具有漂白、防腐和抗氧化等作用,可用作食品添加剂 C、《齐民要术》中记载了酒曲的处理:“乃平量一斗,舀中捣碎”,“捣碎”目的是增大接触面积 D、“绿蚁新醅酒,红泥小火炉”是唐代诗人白居易的著名诗句,“新醅酒”是纯净物
-
15、回答下列问题:(1)、在、、、、、、中,只有氧化性的是 , 只有还原性的是 , 既有氧化性又有还原性的是。(2)、高铁酸钠是一种新型绿色消毒剂,主要用于饮用水处理,工业上有一种制备高铁酸钠的化学反应原理可用离子方程式表示为:
①由上述反应可知,氧化性强弱:(填“>”或“<”);
②请用单线桥法表示该反应中电子的转移情况:。
(3)、、、、、、组成的一个氧化还原反应体系中,发生的反应过程。①该反应中,氧化剂是 , 氧化剂在反应过程中转移电子数是;
②将以上物质填入下面横线上,并配平该反应。
-
16、某化学兴趣小组同学利用以下装置制备干燥的氯气并对氯气的性质进行探究。
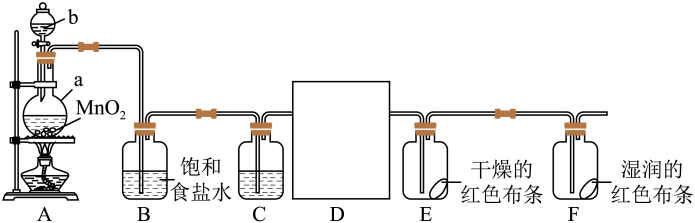 (1)、A装置中a仪器名称是。仪器a中发生反应的离子方程式为。(2)、为收集干燥氯气的仪器,可以选择(填序号)。
(1)、A装置中a仪器名称是。仪器a中发生反应的离子方程式为。(2)、为收集干燥氯气的仪器,可以选择(填序号)。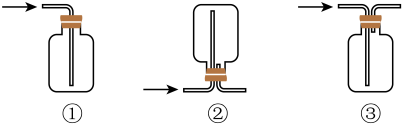 (3)、下列有关该实验的说法中正确的是(填字母)。
(3)、下列有关该实验的说法中正确的是(填字母)。a.B中饱和食盐水主要作用之一是除去氯气中
 氯化氢气体
氯化氢气体b.C中试剂是浓硫酸,目的是干燥氯气
c.中红色布条不褪色,中红色布条裉色,证明氯气不具有漂白性
d.尾气处理时,所用试剂可以选用澄清石灰水
(4)、下图是用强光照射密闭广口瓶中新制氯水时,用数字化传感器采集的图像,下列纵坐标代表的物理量与图像相符的是(填字母)。检验此久置氯水中存在的操作及现象是。
a.氢离子的浓度 b.瓶中氧气的体积分数
c.溶液的导电能力 d.溶液的漂白能力
(5)、图中仪器内试剂在该实验中所体现的性质是。若反应产生了标准状况下的氯气,则参与氧化还原的的物质的量是mol。 -
17、完成下列问题:(1)、实验室金属钠应保存在中。钠长期置于空气中,最后形成的物质是(填化学式)。(2)、金属钠在空气中燃烧生成 , 是否属于碱性氧化物(填“是”或“否”),检验其组成中所含阳离子的方法是:。与足量的反应的化学方程式是 , 每消耗44克 , 固体增重g。(3)、固体中混有少量固体,除杂方法是 , 化学方程式是。(4)、和在外观上相似,可用做家用洗涤剂,如清洗厨房用具的油污等。写出两种能区分二者的化学方法(产生不同化学现象)。
方法一:。
方法二:
-
18、现有如下小实验:
①将少量固体加入溶液中,充分反应
②将5滴饱和溶液加入沸水中,继续煮沸至液体成红褐色
③将少量加入足量稀盐酸中,充分搅拌
④在试管中先加入少量 , 再加入稀 , 充分振荡
⑤向中加入粉末,充分反应
⑥将通入冷的溶液中,充分反应
⑦在中点燃。
回答下列问题:
(1)、上述所标注的物质中,属于氧化物的是 , 属于盐的是(填字母编号)。(2)、上述①~⑦的实验中,发生氧化还原反应的是(填序号)。(3)、①②所得到分散系的本质区别是;②中反应的化学方程式是。
(4)、A在溶液中的电离方程式是;实验①反应的离子方程式是。
-
19、某无色透明溶液中可能大量存在、、、、、、中的几种。取少量该溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。下面说法错误的是( )A、不做任何实验就可以肯定原溶液中不存在、 B、原溶液中肯定存在 C、原溶液可能大量共存的阴离子是、 D、不能肯定原溶液中是否存在、
-
20、下列表示反应中电子转移的方向和数目错误的是( )A、
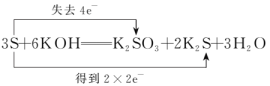 B、
B、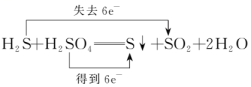 C、
C、 D、
D、