相关试卷
-
1、氯气、漂白粉等都是含氯的消毒剂,某化学兴趣小组利用如图装置制备漂白粉,并收集纯净干燥的氯气。
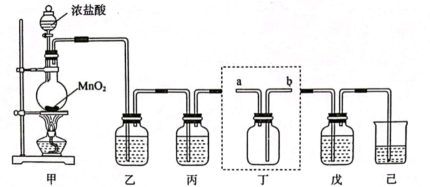
回答下列问题:
(1)、装置甲中发生反应的离子方程式为。(2)、装置乙、丙中盛装的试剂分别为是、。(3)、装置丁用来收集纯净且干燥的氯气,进气口为(填“a”或“b”)。(4)、装置戊中盛装石灰乳用来制备漂白粉,则装置戊中发生反应的化学方程式为。(5)、漂白粉长时间暴露在空气中容易发生变质,为了判断一份久置的漂白粉是否变质及变质程度,甲、乙两位同学分别设计实验进行验证:甲同学取适量漂白粉样品,滴加浓盐酸,将产生的气体直接通入澄清石灰水中,没有发现石灰水变浑浊。乙同学改用滴加稀盐酸,发现产生大量气泡,将气体通入澄清石灰水中,石灰水变浑浊:他又取少量漂白粉样品配成溶液,滴在pH试纸上,最终试纸变白。已知:溶液呈碱性:;
①漂白粉中的能与空气中的和水蒸气反应,从而发生变质,写出该反应的化学方程。
②乙同学认为甲同学的实验无法证明漂白粉是否变质,原因是。
③由乙同学的实验可以证明漂白粉(填“没有变质”、“部分变质”或“完全变质”)
(6)、装置己的作用是吸收多余的氯气,可选用试剂____。(填标号)。A、稀硫酸 B、 C、 D、 -
2、化工专家侯德榜发明的侯氏制碱法为我国经济发展做出了重要贡献。侯氏制碱法的工艺流程图如下:
 (1)、向饱和食盐水中通入和 , 发生的总的化学反应方程式为 , 应先通入。(填“”或“”)。(2)、在实验室中进行“操作1”需要的玻璃仪器有。(3)、煅烧固体1的化学方程式为 , 循环物质X为。(4)、在实验室模拟侯氏制碱法制备 , 从A~E中选择合适的仪器,正确的连接顺序是:a→ , →b,c→(按气流方向,用小写字母表示)。为使A中分液漏斗内的稀盐酸顺利滴下,需要进行的操作是先 , 再将分液漏斗下面的旋塞打开。
(1)、向饱和食盐水中通入和 , 发生的总的化学反应方程式为 , 应先通入。(填“”或“”)。(2)、在实验室中进行“操作1”需要的玻璃仪器有。(3)、煅烧固体1的化学方程式为 , 循环物质X为。(4)、在实验室模拟侯氏制碱法制备 , 从A~E中选择合适的仪器,正确的连接顺序是:a→ , →b,c→(按气流方向,用小写字母表示)。为使A中分液漏斗内的稀盐酸顺利滴下,需要进行的操作是先 , 再将分液漏斗下面的旋塞打开。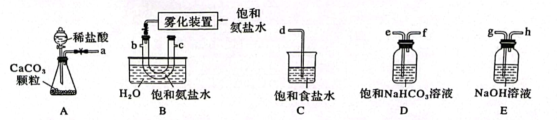 (5)、产品分析:产品纯碱中含有少量 , 把该产品混合物与足量稀硫酸反应,产生的气体先通过足量浓硫酸,再通过足量的 , 固体增重。产品的纯度为(用百分数表示,结果保留到小数点后1位)。
(5)、产品分析:产品纯碱中含有少量 , 把该产品混合物与足量稀硫酸反应,产生的气体先通过足量浓硫酸,再通过足量的 , 固体增重。产品的纯度为(用百分数表示,结果保留到小数点后1位)。 -
3、高铁酸钠()是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种制备流程如图:
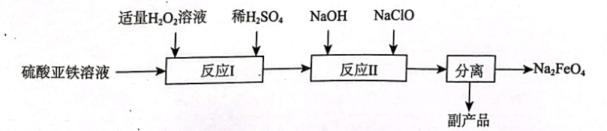
回答下列问题:
(1)、中的化合价为。(2)、写出的电离方程式。(3)、“反应Ⅰ”不能在较高温度下进行的原因是。(4)、“反应Ⅱ”为碱性条件下制备 , 配平该离子反应方程式并用单线桥标出电子转移的方向和数目:++→++ , 该反应中,被 。(填“氧化”或“还原”)
(5)、用高铁酸钠作水处理剂的原理如图所示。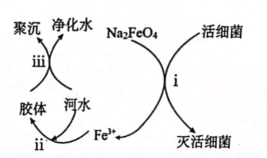
【查阅资料】向胶体中加入电解质后,胶体因失去稳定性而发生离子的聚集以至沉淀,称为电解质对胶体的聚沉作用,简称胶体的聚沉。
①过程i中活细菌表现了。(填“氧化”或“还原”)性,过程ⅲ属于。(填“物理”或“化学”)变化。
②根据上述原理分析,作水处理剂时,的作用有。
-
4、现有下列几种物质:① , ②熔融的MgCl2,③ , ④醋酸溶液,⑤固体,
⑥ , ⑦ , ⑧稀硫酸。按要求回答下列问题:
(1)、其中属电解质的是(填标号,下同),能导电的是。(2)、③和④反应的离子方程式为。(3)、向⑤的水溶液中滴加少量溶液的离子方程式为。(4)、向⑤的稀溶液中缓慢滴加⑧至过量,整个过程中混合溶液的导电能力(用电流强度表示)可近似地用下图中的(填标号)曲线表示。 (5)、⑥的质量为g,含有的的数目为(设为阿伏加德罗常数的值)。(6)、同温同压下,等质量的①和⑦分子数之比为 , 密度之比为。若ag①和⑦的混合气体含有的分子数为b,则cg该混合气体在标准状况下的体积是L
(5)、⑥的质量为g,含有的的数目为(设为阿伏加德罗常数的值)。(6)、同温同压下,等质量的①和⑦分子数之比为 , 密度之比为。若ag①和⑦的混合气体含有的分子数为b,则cg该混合气体在标准状况下的体积是L -
5、向、的混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸的量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( )
 A、a点对应的溶液中:、、、 B、b点对应的溶液中:、、、 C、c点对应的溶液中:、、、 D、d点对应的溶液中:、、、
A、a点对应的溶液中:、、、 B、b点对应的溶液中:、、、 C、c点对应的溶液中:、、、 D、d点对应的溶液中:、、、 -
6、某无色、澄清溶液中可能含有、、、、、、、中的几种,且每种离子的物质的量相等。依次进行下列实验,每步所加试剂均过量,观察到的现象如下:
实验
操作
现象
(1)
用洁净的铂丝蘸取溶液,在酒精上灼烧
火焰的颜色呈黄色
(2)
向溶液中滴加2~3滴紫色石蕊溶液
溶液变红
(3)
向溶液中滴加溶液和稀盐酸
有白色沉淀生成
(4)
将(3)中所得沉淀过滤,向滤液中加入溶液和稀硝酸
有白色沉淀生成
下列结论不正确的是( )
A、不需要进行实验,就可以排除的离子是 B、由实验(1)可以确定溶液中一定有、一定无 C、溶液中肯定含有的离子是、、 D、溶液中肯定不含有的离子是、、 -
7、工业制备锰()单质的过程中会产生高浓度。酸性条件下,用进行脱硫处理的原理如下图所示:
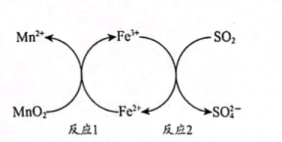
以下列说法中,错误的是( )
A、上述过程中、可以循环使用 B、反应1的离子方程式为: C、脱硫的最终产物为 D、由反应1和反应2可知:氧化性 -
8、亚磷酸()是一种弱酸,其与足量的反应的化学方程式为:
, 亚磷酸受热分解的方程式为:。下列说法正确的是( )
A、属于酸式盐 B、在水溶液中的电离方程式为: C、亚磷酸受热分解的反应中,生成转移 D、亚磷酸受热分解的反应中,氧化产物与还原产物的物质的量之比为1:3 -
9、氯元素的化合价与其形成的常见物质种类的关系如图所示。下列说法错误的是( )
 A、含有的浓溶液与足量的二氧化锰充分反应可制取 B、b能使湿润的有色布条褪色,但是b不具有漂白性 C、c可以用于自来水的杀菌消毒,f可以用于环境杀菌消毒 D、d是很弱的酸,只存在水溶液中
A、含有的浓溶液与足量的二氧化锰充分反应可制取 B、b能使湿润的有色布条褪色,但是b不具有漂白性 C、c可以用于自来水的杀菌消毒,f可以用于环境杀菌消毒 D、d是很弱的酸,只存在水溶液中 -
10、下列物质中,与含有的氧原子数不同的物质是( )A、 B、个分子 C、 D、(标准状况)
-
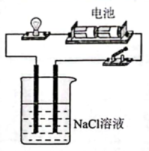
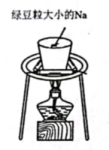
11、下列实验装置(部分夹持装置略)或现象错误的是( )
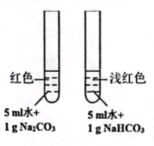
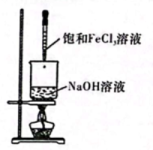
A.滴入酚酞溶液
B.证明氯化钠是电解质
C.钠的燃烧
D.制备氢氧化铁胶体
A、A B、B C、C D、D -
12、下列离子方程式书写正确的是( )A、通入水中: B、过量的与澄清石灰水反应: C、溶液和溶液反应: D、钠与水反应:
-
13、设为阿伏加德罗常数的值。下列说法正确的是( )A、常温常压下,中含有的分子数为 B、中含有的阴离子数目为 C、的铁与足量反应失去电子数为 D、气体溶于水,所得溶液中含有的氯化氢分子为
-
14、以下物质间的各步转化中,均可通过一步反应实现的是( )
①②
③④
A、①③ B、①② C、②③ D、②④ -
15、科学家第一次让18个碳原子连成环,其合成过程如图所示。下列说法正确的是( )
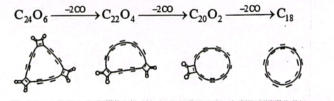 A、的摩尔质量为216 B、含有的碳原子数是 C、转化为的过程中生成了 D、与石墨都是碳元素的同素异形
A、的摩尔质量为216 B、含有的碳原子数是 C、转化为的过程中生成了 D、与石墨都是碳元素的同素异形 -
16、分类是科学研究的重要方法。下列物质的分类正确的是( )A、酸性氧化物:干冰、、 B、碱性氧化物:生石灰、、 C、碱:纯碱、烧碱、熟石灰 D、混合物:汽油、矿泉水、胆矾
-
17、下列物质的用途对应错误的是( )A、——食用碱或工业用碱 B、——泳池消毒剂 C、——呼吸面具或潜水艇中作供氧剂 D、——治疗胃酸过多
-
18、当光束通过下列物质时,不会出现丁达尔效应的是( )A、云、雾 B、胶体 C、蔗糖溶液 D、蓝色钴玻璃
-
19、化学与生产、生活息息相关。下列过程不涉及氧化还原反应的是( )A、绿色植物的光合作用 B、用生石灰作干燥剂 C、用火法炼 D、用对自来水消毒
-
20、次氯酸溶液是常用的消毒剂和漂白剂。某学习小组通过查阅资料知,可用以下两种方法制备次氯酸溶液。(1)、实验一:与水反应
实验装置如图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约为1:3混合通入含水8%的碳酸钠中制备 , 并用水吸收制备次氯酸溶液。
已知:极易溶于水,的沸点为3.8℃,42℃以上分解为和。
该实验用浓盐酸和漂白粉制备氯气,其反应的化学方程式为 , 装置A中饱和食盐水的作用是。 (2)、反应过程中,装置B须放在冷水中,其目的是。(3)、若装置B中反应生成8.7 g , 则反应中转移电子的物质的量为。(4)、装置C中应使用棕色圆底烧瓶的原因是(用化学方程式表示)。(5)、反应能得到较浓的HClO溶液的原因是。(6)、请你设计一个简单的实验,证明实验所得滤液中HClO浓度比饱和氯水中HClO浓度大:。
(2)、反应过程中,装置B须放在冷水中,其目的是。(3)、若装置B中反应生成8.7 g , 则反应中转移电子的物质的量为。(4)、装置C中应使用棕色圆底烧瓶的原因是(用化学方程式表示)。(5)、反应能得到较浓的HClO溶液的原因是。(6)、请你设计一个简单的实验,证明实验所得滤液中HClO浓度比饱和氯水中HClO浓度大:。