相关试卷
-
1、食醋(约含3%~5%的CH3COOH)、纯碱(Na2CO3)和84消毒液(主要成分为NaClO)是生活中常见的化学用品,回答下列问题:(1)、醋酸(CH3COOH)属于电解质(填“强”、“弱”或“非”),在84消毒液中加入少量食醋可以增强其杀菌、消毒的能力,请用离子方程式表示其原因。(2)、用离子方程式表示纯碱溶液呈碱性的原因。(3)、将少量纯碱溶液滴入醋酸溶液中,溶液中 的值变化趋势为(填“增大”、“减小”或“不变”)。(4)、常温下,pH=4的醋酸溶液与pH=10的纯碱溶液中,水电离出的c(OH-)之比为。
-
2、四氯金酸()由王水和纯金反应制得,可用于工业元件的镀金。常温时,用0.1mol/L的NaOH溶液滴定20mL0.1mol/L的溶液,滴定过程中测得混合溶液的温度T、NaOH溶液体积V(NaOH)与pH的关系如图所示。下列叙述错误的是( )
 A、常温时,四氯金酸()的电离平衡常数约为 B、n点溶液中, C、p、n、q三点对应的水解平衡常数: D、p点对应的溶液中,
A、常温时,四氯金酸()的电离平衡常数约为 B、n点溶液中, C、p、n、q三点对应的水解平衡常数: D、p点对应的溶液中, -
3、我国科研团队研制出以K-Sn合金(均为0价)为负极的可充电“K-CO2”电池,碳纳米管作正极,放电反应为4KSn+3CO2=2K2CO3+C+4Sn,则下列说法不正确的是( )A、放电时电流从碳纳米管流向K-Sn合金电极 B、放电时,每消耗19.5 g K,理论上可吸收8.4 L CO2(标准状况) C、该电池的电解质可为KOH水溶液 D、充电时,阳极电极反应式为C+2−4e-=3CO2↑
-
4、在体积均为2 L的恒温密闭容器1、2中,同时充入1 mol Cl2(g)和1 mol PCl3(g),在起始温度不同的条件下发生反应:PCl3(g)+Cl2(g) PCl5(g)。下列叙述错误的是( )
 A、起始反应温度:容器1>容器2 B、平衡时压强:容器1<容器2 C、容器2中达到平衡时PCl5产率为80% D、其它条件不变,3min后向容器1中再充入1 mol PCl5(g),达新平衡后PCl3(g)的体积分数减小
A、起始反应温度:容器1>容器2 B、平衡时压强:容器1<容器2 C、容器2中达到平衡时PCl5产率为80% D、其它条件不变,3min后向容器1中再充入1 mol PCl5(g),达新平衡后PCl3(g)的体积分数减小 -
5、25℃时,将25 mL 12 mol·L-1的盐酸与100 mL 2 mol·L-1 NaOH溶液混合后,再稀释至200 mL,该溶液的pH为(已知:lg5=0.7)( )A、0.3 B、1.3 C、0.7 D、1.7
-
6、恒容高压氢气氛围中CO在铑基催化剂表面主要发生反应为2CO(g)+4H2(g)C2H5OH(g)+ H2O(g),该反应的速率方程为= k c2(CO),其中k为速率常数,下列说法中错误的是( )A、充入CO的量越多,平衡体系中C2H5OH的浓度越大 B、在该体系中继续充入H2可提高反应速率 C、在该体系中加入适量生石灰可提高反应物的平衡转化率 D、对铑基催化剂进行改良可能会进一步提高催化效率
-
7、已知几种化学键的键能数据,N≡O键:;Cl-Cl键:;Cl-N:;N=O: , 则反应的ΔH为 (ClNO的结构式为Cl-N=O)( )A、(289-2a) B、(a-243) C、(2a+341) D、(896-2a)
-
8、我国十大科技突破-海水直接电解制H2 , 其工作原理如图(防水透气膜只允许水分子通过)。下列说法不正确的是( )
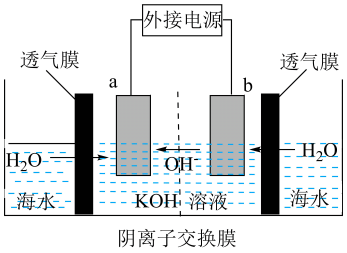 A、b为电解池的阴极 B、a的电极反应式为4OH--4e-=O2↑+2H2O C、去除透气膜,a极发生的电极反应不变 D、电解池工作时,海水侧的离子浓度理论上逐渐增大
A、b为电解池的阴极 B、a的电极反应式为4OH--4e-=O2↑+2H2O C、去除透气膜,a极发生的电极反应不变 D、电解池工作时,海水侧的离子浓度理论上逐渐增大 -
9、常温下,Ag2S与CuS在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )
 A、Ksp(Ag2S)=10-29.2 B、向含CuS沉淀的悬浊液中加入Na2S饱和溶液,Ksp (CuS)减小 C、若Z点为Ag2S的分散系,ν(沉淀)>ν(溶解) D、CuS(s)+2Ag+(aq)Ag2S(s)+Cu2+(aq)平衡常数很大,反应趋于完全
A、Ksp(Ag2S)=10-29.2 B、向含CuS沉淀的悬浊液中加入Na2S饱和溶液,Ksp (CuS)减小 C、若Z点为Ag2S的分散系,ν(沉淀)>ν(溶解) D、CuS(s)+2Ag+(aq)Ag2S(s)+Cu2+(aq)平衡常数很大,反应趋于完全 -
10、由γ-羟基丁酸生成γ-丁内酯的反应为HOCH2CH2CH2COOH
 +H2O。在25℃下,γ-羟基丁酸水溶液的初始浓度为0.180 mol·L-1 , 测得γ-丁内酯的浓度随时间变化的数据如图所示:
+H2O。在25℃下,γ-羟基丁酸水溶液的初始浓度为0.180 mol·L-1 , 测得γ-丁内酯的浓度随时间变化的数据如图所示:t/min
21
50
80
100
120
160
220
∞
c/ mol·L-1
0.024
0.050
0.071
0.081
0.090
0.104
0.116
0.132
则下列说法不正确的是( )
A、在50~80 min内,以γ-丁内酯的浓度变化表示的反应速率为7×10-4 mol·L-1·min-1 B、25℃时该反应的平衡常数K=2.5 C、120 min时γ-羟基丁酸的转化率为50% D、为提高γ-羟基丁酸的平衡转化率,除适当控制反应温度外,还可采用的措施是及时分离出γ-丁内酯 -
11、已知2H2O(l)=2H2(g)+O2(g) ∆H=+571.0 kJ·mol-1 , 两步热循环制H2的过程如图。下列说法正确的是( )

过程I:2Fe3O4(s)=6FeO(s)+O2(g) ∆HⅠ =+604.8 kJ·mol-1
过程II:H2O(l)+3FeO(s)=Fe3O4(s)+H2(g) ∆H II
A、该制氢过程中FeO为催化剂 B、整个过程中能量转化形式只存在太阳能转化为化学能 C、过程II在任何温度下均为自发反应 D、根据盖斯定律∆H I+∆H II=0 -
12、常温下浓度均为0.1 mol·L-1的①CH3COOH(aq);②NaOH(aq);③CH3COONa(aq),下列叙述正确的是( )A、①中 B、②③稀释相同倍数,变化较大的是③ C、①③等体积混合以后, D、①②等体积混合后水的电离程度比①③等体积混合后水的电离程度大
-
13、液氨中存在类似水的微弱电离:。某温度时,液氨的离子积 , 若规定 , 则下列叙述不正确的是( )A、纯液氨中: B、其他条件不变,增加液氨的量,电离平衡正向移动 C、该温度下,液氨的pN=15 D、该温度下,向液氨中加入固体,液氨中与的乘积不变
-
14、下列实验操作及现象、对应结论均正确的是( )
选项
实验操作及现象
结论
A
向AgCl固体滴加饱和Na2CrO4溶液,有砖红色沉淀生成
Ksp(Ag2CrO4)<Ksp(AgCl)
B
向含酚酞的Na2CO3溶液中加入BaCl2固体,溶液红色变浅
Na2CO3溶液中存在水解平衡
C
用pH试纸分别测定同等条件下NaClO溶液和CH3COONa
溶液的pH,前者pH值较大
Ka(CH3COOH)> Ka(HClO)
D
向一定浓度的Na2S2O3溶液中滴入稀盐酸,溶液变浑浊
盐酸将Na2S2O3还原为S单质
A、A B、B C、C D、D -
15、贮备电池主要用于应急救援和武器系统。Mg-AgCl电池是一种可被海水激活的贮备电池,电池总反应为Mg+2AgCl=MgCl2+2Ag。下列叙述正确的是( )A、放电时电子由Mg经海水移动到AgCl B、若将镁换成锌,该装置将不能构成海水原电池 C、负极会发生副反应:Mg+2H2O=Mg(OH)2+H2↑ D、正极反应为Ag++e-=Ag
-
16、牙釉质的主要成分为羟基磷酸钙[Ca5(PO4)3OH],在牙齿表面存在着如下平衡:Ca5(PO4)3OH(s)5Ca2+(aq)+3PO(aq)+OH-(aq)Ksp=6.8×10-37mol9•L-9 , 已知Ca5(PO4)3F的Ksp=2.8×10-61mol9•L-9。下列说法错误的是( )A、残留在牙齿上的糖会发酵产生H+ , 使羟基磷酸钙沉淀溶解平衡右移,破坏牙釉质 B、按时刷牙可减少食物残留,从而减少有机酸的产生,防止腐蚀牙齿 C、用含NaOH的溶液漱口,可使平衡左移,保护牙齿 D、含氟牙膏使Ca5(PO4)3OH转化为更难溶的Ca5(PO4)3F,促进牙齿表面矿物质的沉积,修复牙釉质
-
17、下列依据热化学方程式得出的结论正确的是( )A、正丁烷(g)异丁烷(g) ΔH<0,则正丁烷比异丁烷稳定 B、 , 则的燃烧热为 C、 , 则稀和稀完全反应生成时,放出热量 D、 ; , 则
-
18、下列实验不能达到目的的是( )




A.进行酸碱反应中和热测定
B.往铜牌表面镀银
C.用滴定法测量KI溶液的物质的量浓度
D.采集压强数据判断电化学腐蚀类型
A、A B、B C、C D、D -
19、工业上为除去MgCl2酸性溶液中的Fe2+ , 可在搅拌的条件下加入(或通入)试剂X和Y,过滤后,再向滤液中加入适量盐酸,则下列X、Y的组合中正确的是( )A、Cl2、Na2CO3 B、H2O2、MgCO3 C、空气、NH3·H2O D、O2、Fe2O3
-
20、化学与生产、生活密切相关,下列说法不正确的是( )A、NH4Cl与ZnCl2溶液可作焊接金属时的除锈剂 B、飞秒化学技术可跟踪和检测化学反应中某些寿命极短的中间体或过渡态 C、Na2S用作工业废水中Cu2+、Hg2+的沉淀剂,是利用了其还原性 D、把Cr、Ni加入普通钢中制成不锈钢可增强抗腐蚀性