相关试卷
-
1、100mL 甲溶液可能含有H+、K+、NH、Ba2+、CO、SO、Cl-中的若干种。取该溶液进行连续实验,过程如图(所加试剂均过量,气体全部逸出)。下列说法中不正确的是( )
 A、原溶液一定不存在 H+、Ba2+ , 可能存在K+ , 可通过焰色试验来检验 B、原溶液一定存在Cl- , 且c(Cl-)≤0.1mol/L C、沉淀1转化为沉淀2时,放出的气体标况下的体积为224mL D、若甲溶液中先加 BaCl2溶液,产生白色沉淀,再加足量稀盐酸沉淀不溶解,不能证明此溶液中含有SO
A、原溶液一定不存在 H+、Ba2+ , 可能存在K+ , 可通过焰色试验来检验 B、原溶液一定存在Cl- , 且c(Cl-)≤0.1mol/L C、沉淀1转化为沉淀2时,放出的气体标况下的体积为224mL D、若甲溶液中先加 BaCl2溶液,产生白色沉淀,再加足量稀盐酸沉淀不溶解,不能证明此溶液中含有SO -
2、某营养液中含有KAl(SO4)2、K2SO4、KCl三种溶质,实验测得部分离子的浓度如图甲表示。取200mL样品加水稀释,测得 Al3+的浓度(c)随溶液体积(V)的变化如图乙曲线表示。下列判断错误的是( )
 A、图甲中X离子为SO B、图乙中c1=8.0 C、营养液中 KCl与K2SO4的物质的量之比为2: 1 D、营养液中K2SO4的浓度是2mol/L
A、图甲中X离子为SO B、图乙中c1=8.0 C、营养液中 KCl与K2SO4的物质的量之比为2: 1 D、营养液中K2SO4的浓度是2mol/L -
3、铋(Bi)是第ⅤA族元素,+3价时较稳定,铋酸钠(NaBiO3)溶液呈无色。现取一定量的硫酸锰(MnSO4)溶液,依次滴加下列溶液,对应现象如下表所示:(已知I2能使淀粉碘化钾试纸变蓝)
加入溶液
①适量铋酸钠溶液
②过量双氧水
③适量KI-淀粉溶液
实验现象
溶液呈紫红色
溶液紫红色消失,产生气泡
溶液缓慢变成蓝色
在上述实验条件下,下列结论正确的是( )
A、H2O2被高锰酸根离子还原成O2 B、KI-淀粉溶液中滴加铋酸钠溶液,溶液出现蓝色 C、实验②的离子方程式为 D、氧化性强弱顺序: -
4、如图是利用“手持”技术测定阳光照射不同气体温度变化曲线,其中四个容器均密闭、体积相等且初始压强均为101 kPa。

下列说法错误的是( )
A、实验开始时,四种气体密度相同 B、若容器的容积为22.4 L,13:00时N2原子个数少于2NA C、12:30-13:30时间范围内CO2压强最大 D、CO2是四种气体中温室效应最显著的 -
5、建构数学模型来研究化学问题,既直观又简洁。下列建构的数轴模型正确的是( )A、钠在氧气中燃烧,钠的氧化产物:
 B、向烧碱溶液通入
B、向烧碱溶液通入 C、分散系的分类:
C、分散系的分类: D、FeBr2溶液中通入Cl2 , 铁元素存在形式(已知还原性:Fe2+>Br-):
D、FeBr2溶液中通入Cl2 , 铁元素存在形式(已知还原性:Fe2+>Br-):
-
6、我国“蛟龙”号载人潜水器重要部件是用钛合金材料制造的。金属钛(Ti)抗腐蚀性能好,在高温环境下具有强还原性。以金红石(主要成分为TiO2)为原料生产钛的工艺流程如下,下列说法错误的是( )
 A、①中发生的反应:TiO2+2C+2Cl2TiCl4+2CO B、钠可以与 TiCl4溶液反应制备金属钛 C、②中氩气的作用是隔绝空气,防止金属钛和金属镁被氧化 D、钛抗腐蚀性好是因为常温下钛与氧气化合生成一层致密氧化膜
A、①中发生的反应:TiO2+2C+2Cl2TiCl4+2CO B、钠可以与 TiCl4溶液反应制备金属钛 C、②中氩气的作用是隔绝空气,防止金属钛和金属镁被氧化 D、钛抗腐蚀性好是因为常温下钛与氧气化合生成一层致密氧化膜 -
7、下列反应的离子方程式或电离方程式正确的是( )A、向CaCl2溶液中通入CO2气体:Ca2++CO2+H2O=CaCO3↓+2H+ B、NaHSO3在水中的电离:NaHSO3=H++SO+Na+ C、NH4HSO4溶液与 Ba(OH)2溶液按溶质物质的量1:1反应:H++SO+Ba2++OH-=BaSO4↓ +H2O D、工业用绿矾(FeSO4·7H2O)处理酸性废水中重铬酸根(Cr2O),生成Cr3+:6Fe2++Cr2O+14H+=6Fe3++2Cr3++7H2O
-
8、设NA表示阿伏加德罗常数,下列说法正确的是( )A、7.8gNa2O2晶体中所含离子总数为0.4NA B、80gFe2(SO4)3在溶液中形成的Fe(OH)3胶体粒子数等于 0.4NA C、常温常压下, 23gNO2和N2O4的混合气体含有NA个氧原子 D、0.1molNa2O2固体与足量H2O 充分反应,转移0.2NA个电子
-
9、下列对离子共存问题的评价正确的是( )
选项
离子组
评价
A
强碱性的溶液中:Na+、K+、HCO、NO;
不能大量共存于同一溶液中,因会发生如下反应:HCO+OH-=H2O+CO2↑
B
与 Fe 反应能生成H₂的溶液:K+、Ca2+、NO、CH3COO⁻
能大量共存于同一溶液中
C
滴加石蕊溶液显蓝色的溶液中:Na+、Cl-、NH、CO
不能大量共存,因会发生如下反应:NH+OH-=NH3·H2O
D
含大量SO的澄清溶液:Mg2+、Cu²⁺、Cl-、NO;
不能大量共存于同一溶液中,因会发生如下反应:Mg2++ SO =MgSO4↓
A、A B、B C、C D、D -
10、如图中,A为一种常见的金属单质,B、C、D、E是常见的化合物,它们的焰色试验均为黄色。下列叙述不正确的是( )
 A、以上反应中属于氧化还原反应的有①②③④ B、向固体E中加入少量水,可观察到E结块变为晶体,并放热 C、加热5.00gD和E的固体混合物,使E完全分解,固体混合物的质量减少了0.31g,则原混合物中D的质量为4.16g D、反应①可观察到A 迅速熔化,最后生成淡黄色固体
A、以上反应中属于氧化还原反应的有①②③④ B、向固体E中加入少量水,可观察到E结块变为晶体,并放热 C、加热5.00gD和E的固体混合物,使E完全分解,固体混合物的质量减少了0.31g,则原混合物中D的质量为4.16g D、反应①可观察到A 迅速熔化,最后生成淡黄色固体 -
11、目前,汽车尾气系统中均安装了催化转化器。在催化转化器中,汽车尾气中的CO 和NO在催化剂的作用下发生反应,生成CO2和N2 , 用NA表示阿伏加德罗常数的值,判断下列结论中错误的是( )A、在催化转化器中发生的反应为2CO+2NO2CO2+N2 B、该反应中CO 做还原剂 C、通过催化转化器中的反应减少了汽车尾气排放所造成的空气污染 D、生成22.4L CO2时转移电子数目为2NA
-
12、应用下列装置能达到实验目的的是( )
选项
A
B
C
D
装置




目的
用Na2O2固体粉末“随开随用、随关随停”制氧气
制备Fe(OH)3胶体
用铁丝蘸取碳酸钾溶液进行焰色试验
用于除去CO2中的HCl(g)
A、A B、B C、C D、D -
13、向一定量的稀硫酸中通入或加入适量X,通入或加入X的质量与溶液导电能力(用电流强度I表示)的变化关系如图所示,下列说法错误的是( )
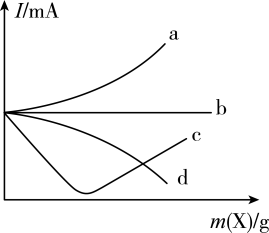 A、曲线a:X可能为气体 B、曲线b:X可能为固体 C、曲线c:X可能为固体 D、曲线d:X可能为水
A、曲线a:X可能为气体 B、曲线b:X可能为固体 C、曲线c:X可能为固体 D、曲线d:X可能为水 -
14、下列前后两个反应可以用同一个离子方程式表示的是( )A、钠与水反应;钠与稀硫酸反应 B、过氧化钠与硫酸氢钠溶液;过氧化钠与稀盐酸 C、碳酸氢钡溶液与足量氢氧化钠溶液;碳酸氢钠溶液与足量氢氧化钡溶液 D、碳酸钠溶液中逐滴加入少量稀盐酸; 稀盐酸中逐滴加入少量碳酸钠溶液
-
15、“宏观辨识—微观探析—符号表征”是化学学习的重要方法。某化学反应的微观示意图如下,下列分析正确的是( )
 A、分析反应类型:该反应属于置换反应 B、分析物质种类:图中反应物均为电解质 C、分析反应价值:该反应实现了无机物向有机物的转化 D、分析表示方法:该反应生成的生成物分子个数比为 1:1
A、分析反应类型:该反应属于置换反应 B、分析物质种类:图中反应物均为电解质 C、分析反应价值:该反应实现了无机物向有机物的转化 D、分析表示方法:该反应生成的生成物分子个数比为 1:1 -
16、天宫课堂的“点水成冰”实验中,我国航天员王亚平用蘸有CH3COONa粉末的小棒触碰液体球后(成分为饱和 CH3COONa溶液),它开始“结冰”,下列说法正确的是( )A、液体球中溶质粒子直径大于 100mm B、CH3COONa属于氧化物,熔融状态可以导电 C、水和冰互为同素异形体 D、CH3COONa可用厨房中的食醋和小苏打反应制得
-
17、下列关于气体摩尔体积的说法中,正确的是( )A、1molH2和O2的混合气体在标准状况下的体积约22.4L B、相同温度和压强下,不同气体的体积由气体分子的大小决定 C、若1mol气体的体积为22.4L,则它一定处于标准状况下 D、标准状况下, 1mol H2O和 1mol H2所占有的体积相同
-
18、化学源于生活又服务于生活。下列应用与所述的化学知识没有关联的是( )
选项
应用
化学知识
A
浓硫酸运输的警示标志为

浓硫酸有腐蚀性
B
用FeCl3腐蚀Cu 刻制印刷电路板
铁比铜还原性强
C
放电影时,放映机到银幕间形成光柱
胶体的丁达尔效应
D
用NaHCO3作膨松剂制作面包
NaHCO3受热分解产生CO2
A、A B、B C、C D、D -
19、“84消毒液”与硫酸溶液反应可以制取氯气,反应方程式为。为探究氯气的性质,某同学设计了如下所示的实验装置。

请回答:
(1)、在该实验中,制取氯气的装置是(填字母)。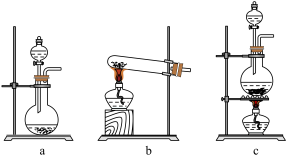 (2)、装置B、C中依次放的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是 , 请提出合理的改进方法。(3)、D中现象是 , 反应的离子方程式为。(4)、写出氯气与NaOH溶液反应的离子方程式。
(2)、装置B、C中依次放的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是 , 请提出合理的改进方法。(3)、D中现象是 , 反应的离子方程式为。(4)、写出氯气与NaOH溶液反应的离子方程式。 -
20、化学是一门以实验为基础的学科,研究小组需要经常做实验。(1)、I.某研究小组甲在探究Na2O2的性质实验时,发现Na2O2样品与过量水反应,待完全反应不再产生氧气后,得溶液M。溶液M可使酸性KMnO4溶液褪色,同时放出氧气。小组成员查阅资料表明,Na2O2与水反应还可生成H2O2。
Na2O2与水反应生成H2O2的反应是否属于氧化还原反应(填是、否)。(2)、完成并配平该反应的离子方程式:+H2O2+H+=+O2↑+
(3)、II.某研究小组乙模拟侯德榜制碱法制取碱,流程如图:
已知:几种盐的溶解度
“侯氏制碱法”誉满全球,其中的“碱”为(填化学式)根据图示装置I中反应的化学方程式为;装置II中反应的化学方程式为。物质 NaCl NH4HCO3 NaHCO3 NH4Cl 溶解度 36.0 21.7 9.6 37.2 (4)、该流程中可循环利用的物质是(填化学式)(5)、下列选项中哪种物质可以鉴别浓度相同的Na2CO3溶液和NaHCO3溶液____。A、澄清石灰水 B、氢氧化钠溶液 C、稀盐酸 D、BaCl2溶液(6)、请写出(5)中能鉴别Na2CO3和NaHCO3两种物质并且能产生悬浊液的离子方程式:。