相关试卷
-
1、下列说法正确的有( )
①根据酸分子中H原子个数将酸分为一元酸、二元酸等
②酸性氧化物都能和水反应生成酸,碱性氧化物都能和水反应生成碱
③海水、空气、漂白粉、盐酸均为混合物
④电解质在适当条件下一定能导电
⑤电解质溶液导电的原因是溶液中有自由移动的阴、阳离子
⑥熔融态的电解质都能导电
⑦在电流作用下,盐酸中的HCl电离成和
A、2个 B、3个 C、4个 D、5个 -
2、下列实验装置或操作能达到实验目的的是( )
A
B
C
D
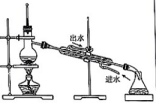


分离苯和四氯化碳的混合物
配制一定浓度的NaOH溶液
利用焰色反应检验某溶液中是否含有Na元素
蒸发结晶得到氯化钠晶体
A、A B、B C、C D、D -
3、下列关于离子检验的说法错误的是( )A、向溶液中加入稀氢氧化钠溶液,若未产生使湿润的红色石蕊试纸变蓝的气体,证明原溶液中不含 B、向溶液中加入溶液,产生白色沉淀,再加稀盐酸,沉淀不消失,不能证明原溶液中一定有 C、向溶液中加入盐酸酸化的溶液,有白色沉淀生成,不能证明原溶液中一定有 D、NaOH溶液、溶液、溶液三种无色溶液,用稀能一次性鉴别出来
-
4、下列实验操作中,正确的是( )A、蒸发操作时,将KCl溶液直接蒸干得到KCl晶体 B、分液操作时,分液漏斗中下层液体从下口放出后,再将上层液体从下口放出到另一个烧杯中 C、蒸馏操作时,先点燃酒精灯,后通冷却水 D、萃取操作中,倒转分液漏斗振荡并适时旋开活塞放气
-
5、结晶水合物受热时能失去部分或全部结晶水。取加热,剩余固体的质量随温度的变化如图所示。100℃时所得固体的化学式为( )
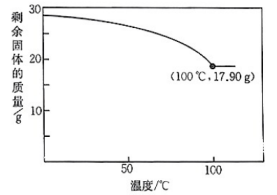 A、 B、 C、 D、
A、 B、 C、 D、 -
6、设为阿伏加德罗常数的值,下列说法正确的是( )A、标准状况下,1.8 g水中含有的电子数为 B、1 mol碳正离子()所含质子总数为 C、常温常压下,2.2 g由和组成的混合气体中含有的原子总数为 D、溶液中含有的数目为 .
-
7、纳米级硒化铜(硒化铜粒子直径是几纳米至几十纳米)是钠离子电池的正极材料,在酸性条件下可通过生物催化氧化法制备纳米级硒化铜,下列有关说法不正确的是( )A、当光束通过纳米级硒化铜时,可以产生一条光亮的通路 B、纳米级硒化铜属于纯净物 C、纳米级硒化铜是一种导电材料 D、纳米级硒化铜粒子直径比直径大
-
8、次磷酸是一种精细化工产品,其水溶液中存在分子。有关的性质如下图:

按照物质的树状分类法和交叉分类法,应属于( )
①一元酸 ②二元酸 ③三元酸 ④热稳定性强的物质 ⑤热稳定性差的物质
⑥氧化物 ⑦化合物 ⑧含氧酸 ⑨电解质 ⑩非电解质
A、①⑤⑦⑧⑨ B、③⑤⑦⑧⑩ C、①④⑦⑧⑨ D、②⑤⑦⑧⑩ -
9、下列关于氯及其化合物的说法正确的是( )A、实验室可通过二氧化锰与稀盐酸共热制取氯气 B、氯元素在自然界中既有游离态,又有化合态 C、氯气是一种黄绿色、有强烈刺激性气味的无毒气体 D、氯气和液氯均不能使干燥的有色布条褪色
-
10、杭州亚运会打造“绿色建筑”,亚运场馆大量使用了碲化镉(CdTe)发电玻璃。下列说法正确的是( )A、和的质子数一定相等 B、的中子数比质子数多14个 C、的相对原子质量为128 D、与互为同位素
-
11、下列各组物质的分类正确的是( )A、电解质:硫酸、盐酸、 B、非电解质:、铜、 C、酸性氧化物:、、 D、同位素:、
-
12、漂白粉具有很强的杀菌、消毒、净化和漂白作用,其有效成分是( )A、 B、 C、 D、
-
13、25℃时,某些弱电解质的电离常数如表所示,回答下列问题。
弱电解质
电离常数
(1)、25℃时,0.02盐酸的pH约为 , 该溶液中水电离出的。()(2)、少量的通入溶液中,发生反应的离子方程式为 , 该过程中,溶液中水电离出的会(填“增大”、“减小”或“不变”)。(3)、某同学用0.2000的盐酸标准液滴定25.00未知浓度的溶液。平行滴定三次所得的实验数据如下表:实验次数
1
2
3
消耗标准液体积/
20.02
23.45
19.98
①图中需用到的仪器为(填标号),所选仪器在使用前需要。

②溶液的浓度为 , 下列操作会使测定结果偏大的是(填标号)。
A.装待测液的锥形瓶未润洗
B.装标准液的仪器水洗后直接装液
C.滴定过程中,部分标准液滴到锥形瓶外
D.滴定终点读数时俯视刻度线
-
14、氮和氮的化合物与人类关系密切。已知:
i.
ii.
iii.
(1)、 (用含a、b、c的式子表示)。(2)、T℃时, 。各步反应的能量变化如图1所示,其中吸附在催化剂表面上的物种用“*”标注。图中决速步骤的反应方程式为;。
图1
(3)、某小组往一恒温恒压含有铁触媒的容器中充入1和3 , 模拟合成氨的反应,不同温度下达到平衡时混合物中氨气的体积分数与总压强(p)的关系如图2。
图2
①图中温度、、由大到小的顺序为 , 图中x、y、z、w四点中,化学反应速率最快的是点。
②y点时,的平衡转化率为;在温度时,该反应的平衡常数(为以分压表示的平衡常数,分压=总压×物质的量分数,用含的式子表示)。
③若在恒容条件下发生该反应,下列说法正确的是(填标号)。
A.温度升高,将增大
B.当时,反应达到了平衡
C.当的体积分数不再改变时,反应达到了平衡
D.断裂1键的同时断裂6键,说明反应达到了平衡
(4)、氨的催化氧化过程中同时发生的反应主要如下:反应Ⅰ.
反应Ⅱ.
测得相同时间内、的产率与温度的关系如图3所示。

图3
①反应Ⅱ为(填“放热”或“吸热”)反应。
②随着温度升高,的产率先增大后减小的原因为。
-
15、化学反应伴随着能量变化,研究化学反应中的能量变化具有重大意义。请回答下列问题:(1)、Ⅰ.硫与硫的氧化物转化过程中能量变化如图所示:
表示的燃烧热的热化学方程式为。 (2)、对于反应:
(2)、对于反应:①(填“低温”、“高温”或“任意温度”)有利于该反应正向自发进行。
②在一密闭容器中仅发生该反应,下列措施有利于提高的平衡转化率的是(填标号)。
A.升高温度 B.压缩容器体积 C.增大浓度 D.再充入一定量的
(3)、Ⅱ.某化学兴趣小组利用如图装置进行中和反应反应热的测定实验。
实验步骤:
①量取50mL0.25mol•L-1H2SO4 , 溶液倒入小烧杯中,测量温度;
②量取50mL0.55mol•L-1NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。
仪器a的名称为 , 使用的溶液稍微过量的原因是。(4)、实验数据记录:实验次数
反应物的初始温度/℃
反应后体系的温度/℃
溶液
溶液
平均值
1
25.2
25.4
28.6
2
24.9
25.1
28.4
3
25.3
25.3
28.0
4
25.0
25.2
28.3
设实验所用的酸、碱溶液的密度均为1 , 反应前后溶液的比热容。计算该实验的 。
(5)、实验过程中,向溶液中加碱时,分多次加入溶液,将会导致测得的(填“偏大”或“偏小”,下同);若用0.55氨水代替溶液,将会导致测得的。 -
16、硝酸是中学常见的强酸,某化学兴趣小组设计实验探究硝酸的性质。(1)、Ⅰ.往0.1溶液中逐滴加入6稀硝酸,随着反应的进行,溶液先变成棕色后逐渐变成棕黄色。对于棕色的形成原因,同学们提出猜想:
猜想1:溶液呈棕色可能是低浓度导致的。
猜想2:溶液呈棕色可能是(棕色)导致的。
猜想3:溶液呈棕色可能是溶解在溶液中导致的。
已知:(棕色)。
溶液与稀硝酸生成和无色气体的离子方程式为;往反应后的溶液中滴加溶液,观察到溶液颜色变为 , 说明溶液中有。(2)、小组同学用图1装置进行实验,观察到石墨1上有无色气泡冒出,正极的电极反应式为 , 整个过程中未观察到石墨2附近溶液出现棕色,说明猜想错误。
图1
(3)、Ⅱ.铝在浓硝酸中的钝化是非常特殊的变化过程,化学小组用图2装置探究铝(已打磨掉表面的氧化膜)钝化所需的硝酸浓度。实验过程和现象记录如表,钝化生成 , 回答下列问题:
图2
电解质溶液为7.5的硝酸:铝棒为极,电极反应式为。硝酸浓度/
()
电流计指针偏转情况
电流计反转所需时间/s
铝棒变化
铜棒变化
7.5
灵敏电流计指针大幅度偏向右侧
不发生反转
逐渐溶解
有气泡产生
8
灵敏电流计指针大幅度偏向右侧,然后缓慢向左偏转
8
开始变暗,8s后有气泡产生
开始有气泡产生,8s后逐渐溶解
9
灵敏电流计指针大幅度偏向右侧,然后稍快向左偏转
4
开始变暗,4s后有气泡产生
开始有气泡产生,4s后逐渐溶解
10
灵敏电流计指针大幅度偏向右侧,然后快速向左偏转
1
迅速变暗并有气泡产生
有少量气泡产生并逐渐溶解
(4)、电解质溶液为9的硝酸:0~4s内,负极上的电极反应为;4s后铜棒发生(填“氧化”或“还原”)反应;探究装置的尾气吸收装置可选择(填标号)。



a
b
c
d
-
17、常温下,向一定体积0.2的溶液中逐滴滴入0.2的稀盐酸。溶液中水电离出的氢离子浓度的负对数[用表示,]与加入盐酸体积的关系如图所示。忽略溶液混合时体积变化和温度变化,已知 , 下列叙述错误的是( )
 A、的 B、c点溶液中水电离出的 C、b~c点间溶液中: D、d点溶液中:
A、的 B、c点溶液中水电离出的 C、b~c点间溶液中: D、d点溶液中: -
18、一种水系可逆锌一二氧化碳电池结构如图(在电场的作用下,双极膜的阴、阳膜复合层间的解离成和并分别通过阴膜和阳膜),下列说法正确的是( )
 A、放电时,正极区溶液的增大 B、放电时,双极膜产生的移向选择性催化材料 C、充电时,若阴极增重6.5g,则阳极产生1.6g D、充电时,选择性催化材料的电极反应为
A、放电时,正极区溶液的增大 B、放电时,双极膜产生的移向选择性催化材料 C、充电时,若阴极增重6.5g,则阳极产生1.6g D、充电时,选择性催化材料的电极反应为 -
19、恒温时,向如图所示的密闭容器中(活栓已经固定住活塞)加入10和1 , 进行反应 。下列有关叙述正确的是( )
 A、其他条件不变,将图示容器换成绝热容器,B的平衡转化率会增大活塞活栓 B、混合气体的密度不再改变时,反应达到平衡状态 C、若反应达到平衡后,拔去活栓,再充入适量(不参与反应),平衡逆向移动 D、若反应达到平衡后拔去活栓,再次达到平衡时,C的体积分数会减小
A、其他条件不变,将图示容器换成绝热容器,B的平衡转化率会增大活塞活栓 B、混合气体的密度不再改变时,反应达到平衡状态 C、若反应达到平衡后,拔去活栓,再充入适量(不参与反应),平衡逆向移动 D、若反应达到平衡后拔去活栓,再次达到平衡时,C的体积分数会减小 -
20、某同学设置了如图所示装置(电解质溶液均过量),下列说法正确的是( )
 A、a极的电极反应为 B、N试管收集到黄绿色的气体 C、电路中每转移2电子,理论上乙池阴极区生成2 D、甲池b极消耗的气体与乙池阴极产生的气体的体积比为2∶1
A、a极的电极反应为 B、N试管收集到黄绿色的气体 C、电路中每转移2电子,理论上乙池阴极区生成2 D、甲池b极消耗的气体与乙池阴极产生的气体的体积比为2∶1