相关试卷
-
1、杭州亚运会主火炬用了一种全球大型赛事中从未使用过的燃料——“零碳甲醇”,其制备过程包括:①H2O经太阳光光解制成H2;②空气中CO2与H2反应生成CH3OH。下列叙述不正确的是 ( )A、过程①氧化产物和还原产物的物质的量比为1:2 B、过程②既属于化合反应,也属于氧化还原反应 C、CO2既属于酸性氧化物,也属于非电解质 D、该制备方式的优点是零污染排放,且循环使用
-
2、下列日常生活中的常见物质不属于金属材料的是( )




选项
A.铝合金门窗
B.青铜器
C.“故宫红”涂料
D.铀锆储氢合金
A、A B、B C、C D、D -
3、NaHCO3不稳定,受热易分解,现有2.96 g未完全分解的碳酸氢钠样品,欲测定其分解率,将其完全溶于水制成溶液,然后向此溶液中缓慢滴加稀盐酸,并不断搅拌。溶液中有关离子的物质的量随盐酸加入的变化如图所示,则
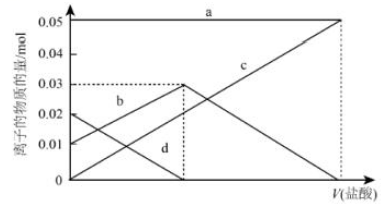 (1)、NaHCO3受热分解的方程式为。(2)、a、d对应的离子分别是、(填离子符号)。(3)、原NaHCO3的分解率为。
(1)、NaHCO3受热分解的方程式为。(2)、a、d对应的离子分别是、(填离子符号)。(3)、原NaHCO3的分解率为。 -
4、氯酸锶[]白色结晶粉末,主要用于制造红色烟火。下图为实验室制取氯酸锶的实验装置图,请回答下列问题:
 (1)、仪器b的名称是。(2)、A中发生反应的离子方程式为。(3)、装置B中所装试剂名称为: , 其作用是。(4)、装置C中发生反应的化学方程式为:。(5)、装置D中反应一段时间后,可观察到装置D中红色逐渐褪去,某实验小组的同学对红色突然褪去的原因进行猜想,请补充猜想并回答问题:
(1)、仪器b的名称是。(2)、A中发生反应的离子方程式为。(3)、装置B中所装试剂名称为: , 其作用是。(4)、装置C中发生反应的化学方程式为:。(5)、装置D中反应一段时间后,可观察到装置D中红色逐渐褪去,某实验小组的同学对红色突然褪去的原因进行猜想,请补充猜想并回答问题:猜想一:氯水中的酸或氯分子与NaOH发生反应,将NaOH消耗所致;
猜想二:。
假如猜想一成立,请设计实验证明该猜想红色褪去的原因:。
-
5、已知短周期元素W、X、Y、Z、M、Q和R在周期表中的相对位置如下所示。
W
Z
M
X
Y
Q
R
请填写下列空白:
(1)、元素Q在周期表中的位置为 , Z的原子结构示意图为。(2)、下列说法不正确的是____。A、常温时,X单质能与水发生剧烈反应 B、气态氢化物的稳定性:Z<M C、Y的最高价氧化物对应水化物是强碱 D、R的单质具有漂白性(3)、X、Z、M元素的原子半径由小到大的顺序为(用元素符号表示)。(4)、Z、M分别与W形成含10个电子分子的化学式是、。(5)、写出Y的氧化物与X的最高价氧化物对应水化物反应的化学方程式。 -
6、利用铁元素价类二维图可多角度研究含铁物质的性质及其转化关系,完成下列问题。
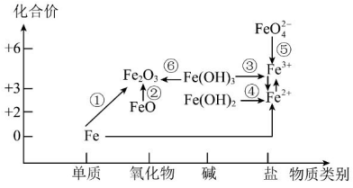 (1)、下列物质中的铁元素只有还原性的是____(填字母)。A、Fe B、FeSO4 C、FeCl3 D、Fe2O3(2)、4.8克Fe2O3中Fe元素的物质的量为mol。(3)、下列有关说法正确的是____。A、纯净的铁是银白色的 B、FeO不稳定,在空气中受热能迅速被氧化成Fe2O3 C、FeO、Fe2O3均属于碱性氧化物 D、除去FeCl2溶液中混有的少量CuCl2杂质,可以向混合液中加入NaOH(4)、是一种白色固体,实验室制时会显红褐色,原因是(用化学方程式表示)。(5)、设计实验证明某待测溶液中存在:。(6)、酸性高锰酸钾溶液具有强氧化性,将它滴入FeSO4溶液中时,溶液变为棕黄色。请补充并配平下列离子方程式:
(1)、下列物质中的铁元素只有还原性的是____(填字母)。A、Fe B、FeSO4 C、FeCl3 D、Fe2O3(2)、4.8克Fe2O3中Fe元素的物质的量为mol。(3)、下列有关说法正确的是____。A、纯净的铁是银白色的 B、FeO不稳定,在空气中受热能迅速被氧化成Fe2O3 C、FeO、Fe2O3均属于碱性氧化物 D、除去FeCl2溶液中混有的少量CuCl2杂质,可以向混合液中加入NaOH(4)、是一种白色固体,实验室制时会显红褐色,原因是(用化学方程式表示)。(5)、设计实验证明某待测溶液中存在:。(6)、酸性高锰酸钾溶液具有强氧化性,将它滴入FeSO4溶液中时,溶液变为棕黄色。请补充并配平下列离子方程式: -
7、完成下列小题(1)、侯氏制碱法所制的“碱”的化学式为。(2)、向碳酸钠溶液中通入CO2的离子方程式为:。(3)、工业制漂白粉的化学方程式为:。
-
8、下列实验方案设计、现象和结论都正确的是( )
选项
方案设计
现象
结论
A
向Na2CO3溶液中滴加酚酞溶液
溶液颜色变为红色
Na2CO3属于碱
B
向FeCl3和CuCl2的混合溶液中加少量铁粉
反应结束后无固体剩余
的氧化性强于
C
向FeSO4溶液中依次加入氯水、KSCN溶液
溶液变红色
该FeSO4溶液已变质
D
向某溶液中滴加盐酸,将产生的气体通入澄清石灰水中
澄清石灰水变浑浊
溶液中含有
A、A B、B C、C D、D -
9、在不同温度、浓度的条件下,Cl2与NaOH溶液的反应,可以生成NaClO或NaClO3。现将氯气缓缓通入冷NaOH溶液,测得、物质的量n(mol)与反应时间t(min)的关系曲线如图。下列说法不正确的是( )
 A、之前发生的反应: B、a点时溶液中 C、 , 离子的物质的量下降的原因可能是发生反应: D、整个过程,参加反应所需NaOH与氯气的物质的量之比为2∶1
A、之前发生的反应: B、a点时溶液中 C、 , 离子的物质的量下降的原因可能是发生反应: D、整个过程,参加反应所需NaOH与氯气的物质的量之比为2∶1 -
10、X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示。若Z原子的最外层电子数是最内层电子数的3倍,下列说法正确的是( )
X
Y
Z
W
A、简单气态氢化物的稳定性:X>Y B、原子半径:X<Z<W C、Z的氧化物对应的水化物是强酸 D、W的单质具有强氧化性 -
11、将新制氯水置于三颈瓶内,将pH传感器、氯离子传感器、氧气传感器分别插入三颈瓶中(如左下图),用强光照射氯水,进行实验并采集数据,获得相关变化曲线(如右下图)。若能够证明氯水中HClO在光照下发生了分解反应,则右下图中纵坐标不可以表示的物理量是( )
 A、氯离子的浓度 B、氧气的体积分数 C、氢离子的浓度 D、氯气分子的浓度
A、氯离子的浓度 B、氧气的体积分数 C、氢离子的浓度 D、氯气分子的浓度 -
12、下列各组物质之间通过一步反应不能实现如图所示转化关系的是( )
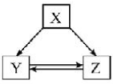
选项
X
Y
Z
A
C
CO
CO2
B
Fe
FeCl2
FeCl3
C
Na2O2
NaOH
Na2CO3
D
Al2O3
Al(OH)3
AlCl3
A、A B、B C、C D、D -
13、自来水是自然界中的淡水经过絮凝、沉淀、过滤、消毒等工艺处理后得到的。高铁酸钾(K2FeO4 , 极易溶于水)是常见的水处理剂,其原理如图所示。下列说法正确的是( )
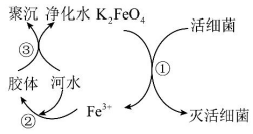 A、K2FeO4的摩尔质量为198 B、K2FeO4具有强氧化性 C、此过程中Fe元素被氧化 D、该处理剂能净水的原因是生成了沉淀
A、K2FeO4的摩尔质量为198 B、K2FeO4具有强氧化性 C、此过程中Fe元素被氧化 D、该处理剂能净水的原因是生成了沉淀 -
14、使用容量瓶配制溶液时,下列操作会使所配溶液浓度偏高的是( )A、用天平称量固体时,砝码放在了左盘,药品放在了右盘 B、转移溶液前容量瓶内有少量蒸馏水 C、定容时,俯视容量瓶的刻度线 D、定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
-
15、同温同压下,下列关于相同质量的NH3和H2S说法正确的是( )A、体积之比为1∶2 B、密度之比为1∶2 C、物质的量之比为1∶2 D、原子个数之比为3∶8
-
16、向一定体积的M溶液中逐滴加入N溶液,测得混合溶液的导电能力随时间变化的曲线如图示,则M、N可能是下列哪种组合( )
 A、HCl、NaOH B、H2SO4、 C、AgNO3、NaCl D、BaCl2、Na2CO3
A、HCl、NaOH B、H2SO4、 C、AgNO3、NaCl D、BaCl2、Na2CO3 -
17、周期表中同族元素的原子结构相似,在性质上具有相似性和递变性。下列说法不正确的是( )A、钠燃烧生成Na2O2 , 锂燃烧也能生成Li2O2 B、钠与水能反应生成NaOH和H2 , 钾也能与水反应生成KOH和H2 C、氯气能与铁反应生成FeCl3 , 溴单质也能与铁反应生成FeBr3 D、氯气与冷的NaOH稀溶液反应生成NaCl和NaClO,溴单质与冷的NaOH稀溶液也反应生成NaBr和NaBrO
-
18、下列离子方程式中,正确的是( )A、用氯化铁溶液腐蚀覆铜板: B、氯气溶于水发生反应: C、向氯化铝溶液中滴加氨水: D、向硫酸氢钠溶液中加入至硫酸根离子恰好沉淀完全:
-
19、下列各组离子在对应条件下能大量共存的是( )A、在pH=1的溶液中:、、、 B、无色澄清溶液:、、、 C、遇酚酞变红的溶液:、、、 D、遇石蕊变红的溶液:、、、
-
20、下列溶液中浓度与50 mL 1.5 mol/L Na2SO4溶液中浓度相等的是( )A、75 mL 1 mol/L的FeSO4溶液 B、25 mL 3 mol/L K2SO4溶液 C、150 mL 0.5 mol/L的溶液 D、150 mL 0.5 mol/L的H2SO4溶液