相关试卷
-
1、已知反应:①;②。下列说法正确的是( )A、反应①中,当有22.4L 参与完全反应时,有2mol电子转移 B、反应②中,HCl只做还原性 C、反应②中,氧化产物与还原产物之比为1∶1 D、根据反应①②得出,氧化性由弱到强的顺序为
-
2、如图所示是铁及其化合物的“价一类”二维图,下列有关叙述错误的是( )
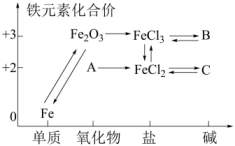 A、由图可预测:高铁酸盐()具有氧化性 B、可能是 C、的反应类型不可能是复分解反应 D、C在空气中受热转化为A
A、由图可预测:高铁酸盐()具有氧化性 B、可能是 C、的反应类型不可能是复分解反应 D、C在空气中受热转化为A -
3、下列除杂试剂和分离方法都正确的是( )
选项
物质(括号内为杂质)
除杂试剂
分离方法
A
Fe(Cu)
盐酸
过滤
B
()
NaOH溶液
过滤
C
(Fe)
水蒸气
加热
D
(HCl)
NaOH溶液
洗气
A、A B、B C、C D、D -
4、设表示阿伏加德罗常数的值,下列叙述正确的是( )A、常温常压下,11.2L氮气所含的原子数目为 B、常温常压下,28g CO中所含原子数为2 C、标准状况下,11.2L水中含有分子的数目为0.5 D、1mol 含有的电子数为11
-
5、体检时的一些指标常用物质的量浓度表示(可将元素近似折算成相应离子)。根据下图相关数据,下列分析不正确的是( )
项目名称
结果
状态单位
参考值范围
总钙 TCa
2.57
2.1~2.7
磷 P
1.51↑
0.8~1.5
镁 Mg
0.95
0.75~1.25
钾 K
仪器故障维修
3.5~5.5
钠 Na
135~160
氯 Cl
95~105
A、 B、可用焰色试验测定钾离子的含量 C、该报告中指标正常 D、若某人10mL血清样本中含钙离子1.2mg,则其钙含量略偏高 -
6、下列陈述Ⅰ和Ⅱ均正确且具有因果关系的是( )
选项
陈述Ⅰ
陈述Ⅱ
A
储氢合金可用于以为燃料的汽车
合金的熔点低,硬度大
B
纯碱能与酸反应
纯碱能与治疗胃酸过多
C
二氧化碳可以灭火
金属钠着火用二氧化碳灭火
D
过氧化钠可用作航天员的供氧剂
能与或水反应生成氧气
A、A B、B C、C D、D -
7、下列图示方法能完成相应实验的是( )
 A、用图①配制一定物质的量浓度的NaOH溶液 B、用图②制备氢气并检验其可燃性 C、用图③做焰色试验时用清洗铂丝后灼烧 D、用图④制备少量并能较长时间看到其白色
A、用图①配制一定物质的量浓度的NaOH溶液 B、用图②制备氢气并检验其可燃性 C、用图③做焰色试验时用清洗铂丝后灼烧 D、用图④制备少量并能较长时间看到其白色 -
8、下列有关0.2溶液的说法不正确的是( )A、100mL该溶液与200mL 0.1 溶液恰好完全反应 B、100mL该溶液中浓度与10mL 0.4 KCl溶液中相同 C、取出该溶液20mL,加水稀释至200mL后,得到溶液的浓度为0.02 D、100mL该溶液中的物质的量为0.02mol
-
9、水热法制备纳米颗粒Y(化合物)的反应为。下列说法中,不正确的是( )A、是还原剂 B、Y的化学式为 C、 D、每有1mol参加反应,反应转移的电子为4mol
-
10、管道工人用浓氨水检验氯气管道是否漏气,如果管道某处漏气,则会产生白烟,发生的反应为。下列叙述正确的是( )A、22.4L 的物质的量为1mol B、1mol 的质量为71g/mol C、只做还原剂 D、1mol 固体含有2mol离子
-
11、下列反应对应的离子方程式正确的是( )A、将溶液与酸性溶液混合: B、氢氧化镁与稀硫酸反应: C、向稀盐酸中加入少量铁粉: D、碳酸钡和稀硫酸:
-
12、下列叙述中正确的是( )A、中阴、阳离子的个数比为1∶1 B、为检验含有NaCl,先加入盐酸溶解,再滴入溶液,是否有白色沉淀 C、金属钠投入到溶液,能置换出红色的铜 D、相同质量的金属Na在常温和加热下与空气反应,失去的电子数一样多
-
13、将一定量潮湿通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色。甲装置中所盛试剂可能是:①浓硫酸 ②NaOH溶液 ③纯碱溶液 ④饱和食盐水 ⑤溶液( )
 A、①④⑤ B、②④⑤ C、①②③⑤ D、①②③④⑤
A、①④⑤ B、②④⑤ C、①②③⑤ D、①②③④⑤ -
14、下列各组溶液中,离子间因氧化还原反应而不能大量共存的是( )A、、、、 B、、、、 C、、、、 D、、、、
-
15、中国科学技术大学的钱逸泰教授等以和金属钠为原料,在700℃时制造出1-50纳米级金刚石粉末。该成果发表在世界权威的《科学》杂志上,立刻被科学家们高度评价为“稻草变黄金”。对此有下列一些理解,其中错误的是( )A、金刚石与石墨是同素异形体 B、这个反应是置换反应 C、是一种化合物 D、纳米级金刚石粉末属于胶体
-
16、分类是科学研究的重要方法。下列物质分类正确的是( )A、碱性氧化物:、 B、盐:、KSCN C、电解质:二氧化碳、氯气 D、碱:纯碱、一水合氨
-
17、人工合成Cn的过程可表示为:。下列叙述正确的是( )A、合成Cn的过程为化学变化 B、的中子数为165 C、Cn元素位于第七周期ⅡA族 D、与互为同位素
-
18、形状记忆合金是一种在加热升温后能完全消除其在较低的温度下发生的变形,恢复其变形前原始形状的合金材料,即拥有“记忆”效应的合金。下列变化不是利用合金记忆效应的是( )A、脊柱侧弯矫形采用的哈伦顿棒,如果矫形棒的矫正力有变化,把温度升高到比体温约高5℃,就能恢复足够的矫正力 B、合金在高温环境下制作好天线,再在低温下把天线压缩成一个小球,运上太空中,太阳光的辐射使小球恢复原来的形状 C、将某合金用于制造精密仪器或精密车床,一旦由于震动、碰撞等原因变形,只需加热即可排除故障 D、汽车受损变形后,利用钣金喷漆整形
-
19、我国科技事业迅速发展,成果显著。下列成果所涉及的材料不属于金属材料的是( )A、神舟十二号航天员头盔面窗的材料——聚碳酸酯 B、国产大飞机C919的主体材料——铝锂合金 C、我国航空母舰的主体材料——合金钢 D、“奋斗者”号深潜器载人舱的外壳——钛合金
-
20、某同学利用钠与硫酸铜溶液进行实验,并对其现象进行分析,研究其产物组成。(1)、硫酸铜溶液的配制:准确称取五水硫酸铜(CuSO4·5H2O)晶体2.5000g,溶解后转移至100mL容量瓶中。
①上述实验过程中,用不到的实验仪器有 (填标号)。

②该CuSO4溶液的浓度为mo/L。
③通过理论计算,当上述硫酸铜与钠完全反应,溶液质量变化为 g。
(2)、将配好的CuSO4溶液,分3组进行实验,实验结果如下图所示:序号
CuSO4溶液体积/mL
金属钠质量/g
实验现象
a
15
0.01g
迅速产生大量蓝色沉淀
b
15
0.1g
蓝色沉淀和黑色沉淀共存
c
15
1.0g
出现大量黑色沉淀
查阅资料得知:极细的铜粉,外观呈现黑色
①a组中的蓝色沉淀成分主要是。
②将c组中黑色沉淀进行抽滤,干燥,对其成分进行初步的猜想
猜想ⅰ:金属钠将铜置换出来,以极细的铜粉存在;
猜想ⅱ:金属钠与水反应剧烈放热,。
设计一个简单的实验,证明猜想ⅰ是错误的。
(3)、为进一步验证黑色固体的成分,该同学求助实验室检测,得到黑色固体中含铜化合物主要有硫酸氧化铜[Cu2O(SO4)]、碱式硫酸铜[Cu(OH)x(SO4)y]氧化铜[CuO]三种。写出钠与硫酸铜反应生成碱式硫酸铜的化学方程式。(4)、根据实验结果,可以得到的结论为(写一条)。